Acido acetoacetico
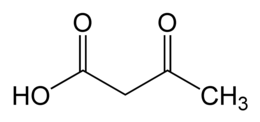
L'acido acetoacetico è un composto chimico avente formula C4H6O3. Possedendo, oltre al gruppo carbossilico (acido), un gruppo chetonico sul carbonio 3 (o carbonio β), è considerato un β-chetoacido della cui famiglia è il più semplice.
| Acido acetoacetico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 3-ossobutanoico | |
| Nomi alternativi | |
| acido diacetico acido β-chetobutirrico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H6O3 |
| Massa molecolare (u) | 102.09 g/mol |
| Numero CAS | |
| PubChem | 96 |
| DrugBank | DBDB01762 |
| SMILES | CC(=O)CC(=O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 291 K | 3,6 |
| Solubilità in acqua | (20 °C) solubile |
| Temperatura di fusione | 36.5 °C (309.5 K) |
| Temperatura di ebollizione | decomposizione |
| Indicazioni di sicurezza | |
Biochimica
modificaIn condizioni fisiologiche (pH = 7), l'acido acetoacetico è presente sotto forma della sua base coniugata, l'acetoacetato.
L'acetoacetato viene prodotto nei mitocondri delle cellule epatiche a partire dall'acetoacetil Coenzima A (CoA). All'inizio viene aggiunto un ulteriore gruppo acetile (derivante da una molecola di acetil CoA) al 3-idrossiisovaleril CoA, in seguito tramite la perdita di una molecola di acetil CoA viene ottenuto l'acetoacetato.[1]
Nei mammiferi, l'acetoacetato (insieme a due altri corpi chetonici) viene rilasciato nel flusso sanguigno per essere utilizzato come fonte di energia nei periodi di digiuno, durante l'esercizio fisico o come conseguenza del diabete mellito di tipo 1.[2] Prima di essere utilizzato all'interno delle cellule viene riconvertito in acetoacetil CoA tramite l'aggiunta di una molecola di CoA. In seguito viene spezzato in due molecole di acetil CoA dall'enzima tiolasi che quindi entrano nel ciclo dell'acido citrico.[1]
Alcuni tessuti, fra i quali il muscolo cardiaco e la corticale renale, preferiscono utilizzare come fonte di energia l'acetoacetato al posto del glucosio.[senza fonte]
Sintesi e proprietà
modificaL'acido acetoacetico può essere preparato tramite l'idrolisi del dichetene, dimero dell'etenone. Lo stesso procedimento può essere utilizzato per ottenere gli esteri dell'acido acetoacetico utilizzando il corrispondente alcol al posto dell'acqua.[3]
Generalmente l'acido acetoacetico viene prodotto in situ a 0 °C e utilizzato immediatamente poiché tende a decomporsi in acetone e anidride carbonica.[4] La forma acida ha un tempo di emivita di 140 minuti a 37 °C in acqua, mentre la base coniugata ha un tempo di emivita di 130 ore.[5]
L'acido acetoacetico in soluzione è in equilibrio tautomerico con la sua forma enolica, la quale viene stabilizzata tramite una coniugazione estesa e legame a idrogeno intramolecolare. Questo equilibrio è fortemente solvodipendente: la forma chetonica è predominante in solventi protici (98% di abbondanza in acqua) mentre la forma enolica rappresenta il 25-49% in solventi non polari.[6]
Applicazioni
modificaGli esteri acetoacetici sono usati per la reazione di acetoacetilazione, che è ampiamente usata nella produzione di gialli di arilidi e coloranti di diarilide. Sebbene gli esteri possano essere usati in questa reazione, il dichetene reagisce anche con alcoli e ammine a dare i corrispondenti derivati dell'acido acetoacetico.[7]
Note
modifica- ^ a b (EN) Lubert Stryer, Biochemistry, 2ª edizione, 1981, p. 393.
- ^ Stryer, Lubert., Biochemistry, 4th ed, W.H. Freeman, 1995, ISBN 0-7167-2009-4, OCLC 30893133. URL consultato il 24 febbraio 2019.
- ^ Bohnet, Matthias, 1933-, Ullmann's encyclopedia of industrial chemistry, Sixth edition, ISBN 978-3-527-30673-2, OCLC 751968805. URL consultato il 24 febbraio 2019.
- ^ METHYLGLYOXAL-ω-PHENYLHYDRAZONE, in Organic Syntheses, vol. 32, 1952, p. 84, DOI:10.15227/orgsyn.032.0084. URL consultato il 24 febbraio 2019.
- ^ (EN) Rw Hay e Ma Bond, Kinetics of the Decarboxylation of Acetoacetic acid, in Australian Journal of Chemistry, vol. 20, n. 9, 1967, p. 1823, DOI:10.1071/CH9671823. URL consultato il 24 febbraio 2019.
- ^ (EN) Karen D. Grande e Stuart M. Rosenfeld, Tautomeric equilibriums in acetoacetic acid, in The Journal of Organic Chemistry, vol. 45, n. 9, 1980-4, pp. 1626-1628, DOI:10.1021/jo01297a017. URL consultato il 24 febbraio 2019.
- ^ Kiran Kumar Solingapuram Sai, Thomas M. Gilbert e Douglas A. Klumpp, Knorr Cyclizations and Distonic Superelectrophiles, in J. Org. Chem., vol. 72, n. 25, 2007, pp. 9761-9764, DOI:10.1021/jo7013092, PMID 17999519.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su acido acetoacetico
Collegamenti esterni
modifica- (EN) acetoacetic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.