Acido glicirretico
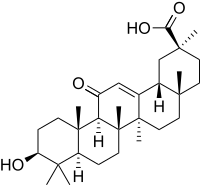
L'enoxolone, chiamato anche acido 18-β-glicirretico o acido glicirretinico, è un acido organico triterpenico pentaciclico, derivato dalle beta-amirine, ottenuto dall'idrolisi dell'acido glicirrizico, che viene estratto dalla liquirizia.[1]
| Acido glicirretico | |
|---|---|
 | |
| Nome IUPAC | |
| acido (2S,4aS,6aS,6bR,8aR,10S,12aS,12bR,14bR)-10-idrossi-2,4a,6a,6b,9,9,12a-eptametil-13-osso-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,11,12,12a,12b,13,14b-icosaidropicene-2-carbossilico | |
| Nomi alternativi | |
| enossolone | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C30H46O4 |
| Massa molecolare (u) | 470,694 g/mol |
| Numero CAS | |
| Numero EINECS | 207-444-6 |
| PubChem | 10114 |
| DrugBank | DBDB13089 |
| SMILES | CC1(C2CCC3(C(C2(CCC1O)C)C(=O)C=C4C3(CCC5(C4CC(CC5)(C)C(=O)O)C)C)C)C |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 3g/kg (orl rat) |
| Indicazioni di sicurezza | |
Indicazioni
modificaTrova impiego nel trattamento dell'ulcera peptica, come espettorante (antitussivo) e cicatrizzante. Ha, inoltre, altre proprietà farmacologiche: antivirale, antifungina, antiprotozoica, antibatterica, eupeptica, emolliente, antiflogistica e citoprotettiva. Inoltre, l'acido glicirretinico, assieme all'acido glicirrizico, ha azione epatoprotettiva, ha effetti positivi sui danni cerebrali dovuti a ischemia e risulta avere un effetto sinergico con i farmaci antitumorali.[2]
Inoltre la glicirrizina (in particolare l'aglicone), da cui si estrae l'acido glicirretico, viene utilizzata anche come dolcificante, essendo più dolce del saccarosio.[3]
Meccanismo d'azione
modificaL'acido glicirretico inibisce gli enzimi 15-idrossiprostaglandina deidrogenasi e δ-13-prostaglandina deidrogenasi che metabolizzano le prostaglandine PGE-2 PGF2α nei loro rispettivi 15-cheto-13,14-diidro metaboliti, che sono inattivi. Questo causa un aumento del livello delle prostaglandine nel sistema digerente, le quali inibiscono le secrezioni gastriche, mentre stimolano la secrezione pancreatica e la secrezione mucosa intestinale, causando un notevole incremento della motilità intestinale. L'inibizione della secrezione gastrica, la promozione della secrezione mucosa e, inoltre, l'aumento della proliferazione cellulare nello stomaco e la sua efficacia, come antibatterico, nei confronti di H. pylori, uno dei principali responsabili di ulcera peptica, mostrano il perché la liquirizia abbia effetti benefici nel trattamento di tale patologia[4].
L'accumulo di PGF2α, dovuto all'inibizione di questi due enzimi, stimola anche l'attività dell'utero durante la gravidanza, portando anche all'aborto: per questo l'assunzione di liquirizia è sconsigliata durante la gravidanza.[5]
La struttura dell'acido glicirretico è simile a quella del cortisone nelle posizioni 3 e 11 ed entrambe le molecole sono piane, motivo per cui la liquirizia ha attività antinfiammatoria. L'acido 3-β-D-(monoglucuronil)-18-β-glicirretinico è un metabolita dell'acido glicirretico che inibisce la conversione del cortisolo, attivo, in cortisone, inattivo, nei reni e questo si verifica attraverso l'inibizione dell'enzima 11-β-idrossisteroidedeidrogenasi. Tale inibizione non mostra effetti collaterali dovuti ad accumulo di corticosteroidi, come ad esempio l'osteoporosi. In modelli animali l'inibizione o l'induzione della 11-β-HSD-1 si correla rispettivamente con la prevenzione o all'aumento dell'incidenza di obesità e diabete. Studi condotti sull'uomo hanno dimostrato un incremento dell'espressione dell'RNA che codifica 11-β-HSD-1 nel tessuto adiposo dei soggetti obesi. Questa inibizione porta ad un aumento dei livelli di cortisolo nel dotto collettore del rene, il quale ha proprietà mineralcorticoidi intrinseche: si comporta come l'aldosterone, aumentando il riassorbimento del sodio. L'aldosterone è un ormone steroideo che, attraverso l'attivazione di una cascata di fosforilazione e di fattori trascrizionali, porta alla sintesi di proteine che a loro volta aumentano l'assorbimento di sodio e acqua dal filtrato, incentivando così l'escrezione, nel filtrato, di potassio. Ciò comporta ipokaliemia e ipernatriemia, a quest'ultima, inoltre, consegue un aumento del volume plasmatico e della pressione arteriosa media. Le persone spesso hanno un'alta pressione sanguigna con livelli bassi di renina e aldosterone. L'aumentata quantità di cortisolo si lega ai recettori non specifici mineralcorticoidi, portando a inibizione del sistema regina-angiotensina-aldosterone. Per questo motivo la liquirizia non dovrebbe essere data a pazienti con problemi di ipertensione in dosi sufficienti da inibire l'enzima 11-β-idrossisteroide deidrogenasi[4][6].
L'acido glicirretinico, inoltre influenza i processi biologici di formazione del cancro non solo inducendo l'apoptosi cellulare ma anche coadiuvando l'attività tossica dei chemioterapici. Molte cellule risultano sensibili a tale acido e ai suoi derivati come, ad esempio, la linea cellulare del carcinoma ovarico, del tumore alla prostata, del tumore polmonare e alla vescica. Risulta, inoltre, attivo contro il tumore epatico indotto da epatite grazie alla sua attività antivirale, che lo vede inibire la proliferazione e l'infezione, non solo, del virus dell'epatite A (HAV), dell'epatite B (HBV), dell'epatite C (HCV), del virus della SARS, HIV, del virus della varicella zoster (VZV), del cytomegalovirus (CMV)[4].
CYP3A è uno delle isoforme più importanti di citocromi, ovvero enzimi coinvolti nel metabolismo di xenobiotici nel corpo umano. Vari studi hanno dimostrato che la glicirrizina e l'acido glicirretico inducono l'attività del CYP3A4. Anche l'attività di altri citocromi è influenzata da queste due molecole, come per esempio il CYP1A2 e il CYP2B1, la quale attività aumenta considerevolmente dopo l'interazione con acido glicirretico e glicirrizina.[7]
Gli studiosi hanno inoltre dimostrato che la glicirrizina e l'acido glicirretico modulano anche l'attività della P-gp, una glicoproteina di efflusso espressa in diversi tessuti. L'acido glicirretico, infatti, è un potente inibitore di questa glicoproteina, inibendo di conseguenza il metabolismo di farmaci che verrebbero altrimenti eliminati molto più velocemente.[7]
Effetti collaterali
modificaLa liquirizia contiene glicirrizina, un glicoside che ha un’azione antinfiammatoria e che contiene due molecole di acido glucuronico connesse al gruppo idrossilico dell’acido glicirretinico in C-3. Quando la liquirizia viene assunta oralmente, la glicirrizina penetra attraverso l’epitelio gastrointestinale dove gli enterobatteri ne idrolizzano la parte zuccherina e la trasformano in acido glicirretico, il quale si ritiene sia responsabile della maggior parte dell’attività farmacologica della liquirizia. Uno degli effetti collaterali più comuni dovuti al consumo eccessivo di liquirizia, secondo gli studiosi, è lo pseudoaldosteronismo causato dalla liquirizia. La glicirrizina, il principale costituente della liquirizia, viene assorbita come acido glicirretico, che è un metabolita della glicirrizina, prodotto dagli enterobatteri prima del suo rilascio nella circolazione. L'acido circolante viene metabolizzato nel fegato per diventare acido 3-monoglucuronil-glicirretico (3MGA), che viene escreto nella bile attraverso la proteina Mrp2. Se la funzione Mrp2 è danneggiata, 3MGA è secreto dal fegato nella circolazione ed espulso nelle urine tramite trasportatori di anioni organici (OAT), espressi sulla membrana basolaterale delle cellule epiteliali tubulari. L'acido glicirretico circolante non può essere eliminato nelle urine poiché si lega in grande quantità all'albumina sierica e quindi non viene filtrato a livello glomerulare e non è un substrato di trasportatori espressi sulle cellule epiteliali tubulari. Lo pseudoaldosteronismo indotto dalla liquirizia si sviluppa a causa dell'inibizione dell'11-idrosteroide deidrogenasi di tipo 2 (11β-HSD2) che si traduce in accumulo di cortisolo nelle cellule epiteliali tubulari che attivano i recettori mineralcorticoidi stimolando l'escrezione di potassio, che provoca ipopotassiemia. L'acido glicirretico, a differenza di 3MGA, non può passare attraverso le cellule epiteliali tubolari e non può inibire l’enzima nelle cellule. Pertanto, 3MGA può essere un vero agente causale del pseudoaldosteronismo indotto dalla liquirizia. Quando si utilizza la liquirizia, quindi, 3MGA nel plasma o nelle urine potrebbe funzionare come un composto marcatore per prevenirne l'effetto avverso.[8]
Derivati
modificaDerivati: il gruppo funzionale (R) dell'acido glicirretinico è un gruppo idrossilico. Una ricerca del 2005 ha dimostrato che con un appropriato gruppo funzionale si può ottenere un effettivo glicirretinico artificiale più dolce. Quando R è una catena laterale anionica l'effetto dolcificante trovato è 1200 volte quello dello zucchero. Una catena più corta o più lunga riduce l'effetto dolcificante. Una spiegazione è che le papille gustative hanno 1.3 nanometri disponibili per legarsi a queste molecole dolci. Inoltre queste molecole dolcificanti necessitano di tre posizioni donatrici di protoni, due delle quali si trovano alle estremità per essere capaci per interagire efficacemente con il sito recettoriale. Un analogo sintetico, il carbenoxolone, venne sviluppato in Gran Bretagna. Sia l'acido glicirretinico che il carbenoxolone hanno un effetto modulatorio sulle trasmissioni nervose attraverso i canali sinaptici. L'acetoxolone, il derivato acetilico dell'acido glicirretinico, è un farmaco usato nel trattamento dell'ulcera peptica e del reflusso gastroesofageo.[9]
Note
modifica- ^ Glycyrrhiza glabra L., su dryades.units.it. URL consultato l'8 gennaio 2019.
- ^ Foye's. Principi di chimica farmaceutica (2014).
- ^ Francesco Capasso, Farmacognosia. Botanica, chimica e farmacologia delle piante medicinali. (2011).
- ^ a b c Tzu-Chien Kao, Chi-Hao Wu, Gow-Chin Yen, Bioactivity and Potential Health Benefits of Licorice, in Journal of Agricultural and Food Chemistry.
- ^ Enoxolone, su pubchem.ncbi.nlm.nih.gov. URL consultato l'8 gennaio 2019.
- ^ Enoxolone, su etatpur.it. URL consultato l'8 gennaio 2019 (archiviato dall'url originale il 29 dicembre 2018).
- ^ a b Xinchi Feng, Liqin Ding & Feng Qiu, Potential drug interaction associated with glycyrrhizin and glycyrrhetinic acid, in Drug Metabolism Reviews, 2015.
- ^ Toshiaki Makino, 3-Monoglucuronyl Glycyrrhretinic Acid Is a Possible Marker Compound Related to Licorice-Induced Pseudoaldosteronism, in Biol. Pharm. Bull. 37(6) 898–902 (2014), vol. 37, n. 6.
- ^ Enoxolone, su etatpur.it. URL consultato l'8 gennaio 2019 (archiviato dall'url originale il 29 dicembre 2018).
Bibliografia
modifica- William O. Foye (2014). "Foye's. Principi di chimica farmaceutica". Piccin.
- Lauralee Sherwood (2012) " Fondamenti di fisiologia umana". Piccin.
- O. (EN) Chandler, RF (1985). "Liquorice, more than just a flavour". Canadian Pharmaceutical Journal (118): 420-4.
- (EN) Badam, L.; Amagaya, S.; Pollard, B. (1997). "In vitro activity of liquorice and glycyrrhetinic acid on Japanese encephalitis virus". J. Community Dis. 29: 91-99.
- (JP) Fuji, H. Y.; Tian, J.; Luka, C. (1986). "Effect of glycyrrhetinic acid on influenza virus and pathogenic bacteria". Bull. Chin. Mater. Med. 11:238-241.
- (JP) Kato, H.; Kanaoka, M.; Yano, S.; Kobayashi, M.(1995-06-01). "3-monoglucuronyl-glycyrrhetinic acid is a major metabolite that causes licorice-induced pseudoaldosteronism". The Journal of Clinical Endocrinology and Metabolism. 80 (6):1929-1933.
- (EN) van Uum, SH (April 2005). "Liquorice and Hypertension". Neth J Med. 63 (4): 119-20.
- (JP) Ijichi, So; Seizo Tamagaki (2005). "Molecular Design of Sweet Tasting Compounds Based On 3-beta-amino-3-beta-deoxy-18-beta-glycyrrhetinic acid: Amido Functionality Eliciting Tremendous Sweetness". Chemistry Letters. 34(3):356.
- (EN) G. A. Tolstikov, L. A. Baltina, N. G. Serdyuk, Glycyrrhetic acid (a review), in Pharmaceutical Chemistry Journal, vol. 32, nº 8, 1998, pp. p. 402-412, DOI:10.1007/BF02465768.
- (EN) K.K. Tangri, P.K. Seth, Surendra S. Parmar, K.P. Bhargava, Biochemical study of anti-inflammatory and anti-arthritic properties of glycyrrhetic acid, in Biochemical Pharmacology, vol. 14, nº 8, settembre 1965, pp. pp. 1277-1281, DOI:10.1016/0006-2952(65)90305-9.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su acido glicirretico