Anestesia subaracnoidea
L'anestesia subaracnoidea o spinale è una tecnica di anestesia regionale nella quale l'anestetico viene iniettato nel liquido cefalorachidiano dello spazio subaracnoideo che circonda il midollo spinale, inibendo la conduzione nervosa e provocando la perdita reversibile della sensibilità, accompagnata o meno da paralisi motoria. Ciò consente di eseguire procedure chirurgiche senza alcuna sensazione dolorosa per la persona sottoposta alla procedura.
| Anestesia subaracnoidea | |
|---|---|
Procedura medica 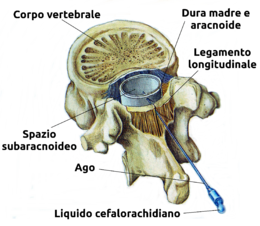 Un flusso di liquido cefalorachidiano fuoriesce, attraverso un ago 25 Gauge, dopo la puntura della aracnoide. | |
| Tipo | Anestesiologica |
| Classificazione e risorse esterne | |
| ICD-9 | 03.90 |
| MeSH | D000775 |
| Sinonimi | |
| Spinale | |
È utilizzata per interventi sugli arti inferiori e parte bassa dell'addome (es. appendicectomia, ernioplastica, taglio cesareo, ecc); è più comunemente usata per interventi chirurgici sotto l'ombelico, tuttavia recentemente i suoi usi si sono estesi ad alcuni interventi chirurgici sopra l'ombelico e per l'analgesia intra- (realizzando la cosiddetta anestesia integrata o blended) o postoperatoria. L'anestesia spinale evita le potenziali conseguenze respiratorie dell'intubazione e della ventilazione artificiale; può anche essere utile nei pazienti con una difficile intubazione o gestione delle vie aeree. A volte viene fornita una certa sedazione per aiutare il paziente a rilassarsi e passare il tempo durante la procedura, ma con un'anestesia spinale efficace, l'intervento può essere eseguito con il paziente completamente sveglio.
Indipendentemente dall'agente anestetico utilizzato, l'effetto desiderato è quello di bloccare la trasmissione dei segnali nervosi afferenti dai nocicettori periferici: i segnali sensoriali dal sito chirurgico vengono bloccati, eliminando così il dolore. Il risultato desiderato è l'intorpidimento totale dell'area. L'anestetico locale si può associare a farmaci adiuvanti quali oppioidi o α2-agonisti.
Storia
modificaLa prima anestesia spinale fu somministrata nel 1885 da James Leonard Corning (1855-1923), un neurologo di New York; stava sperimentando la cocaina sui nervi spinali di un cane quando ha perforato accidentalmente la dura madre.[1]
La prima anestesia spinale pianificata per un intervento chirurgico su un essere umano fu somministrata da August Bier (1861-1949) il 16 agosto 1898, a Kiel: iniettò 3 ml di soluzione di cocaina allo 0,5% in un operaio di 34 anni. Dopo averlo usato su 6 pazienti, lui e il suo assistente si iniettarono cocaina intratecale l'un l'altro[2]. Lo raccomandavano per gli interventi chirurgici alle gambe, ma lo abbandonarono a causa della tossicità della cocaina.[3]
Presupposti anatomici
modificaNell'anestesia spinale, l'ago viene posizionato fino oltre la dura madre, nello spazio subaracnoideo passando tra le vertebre.
Per raggiungere questo spazio, l'ago deve perforare diversi strati di tessuto e legamenti che includono il legamento sopraspinoso, il legamento interspinoso e il legamento giallo.
Poiché il cono midollare si trova tipicamente a livello L1 o L2 della colonna vertebrale, l'ago deve essere inserito al di sotto di questi, nello spazio tra L2 e L3, o L3 e L4, o tra L4 e L5, per evitare lesioni al midollo spinale. Somministrare un anestetico locale a livelli più alti può influire sulla capacità di respirare paralizzando i muscoli respiratori intercostali, o anche il diaframma in casi estremi (procedure di "spinale alta", o "spinale totale"), così come la capacità di controllare la frequenza cardiaca attraverso le fibre autonomiche.
Esecuzione
modificaPrima di poter effettuare l'operazione è necessario accertarsi della corretta identificazione del paziente.
La posizione del paziente è essenziale per il successo della procedura e può influenzare il modo in cui l'anestetico si diffonde dopo la somministrazione. Sono possibili 3 diverse posizioni: seduto, in decubito laterale e prono. Le posizioni seduta e in decubito laterale sono le più comuni; queste posizioni permettono di mantenere il rachide flesso ed esporre al meglio l'area da pungere. La posizione seduta inoltre presenta il vantaggio di essere tecnicamente più semplice in quanto i punti di repere anatomici appaiono meno ambigui.
- Seduto: il paziente siede sul bordo del lettino con la schiena rivolta verso l'operatore, le gambe che pendono dall'estremità del lettino e i piedi appoggiati su uno sgabello. I pazienti devono piegarsi con le spalle e la parte superiore della schiena in avanti.
- Decubito laterale: il paziente giace su un fianco, con la schiena sul bordo del letto e di fronte all'operatore. Il paziente dovrebbe racchiudere le spalle e le gambe e far sporgere la parte bassa della schiena (posizione fetale).
- Prono: il paziente è posizionato a faccia in giù e la schiena rivolta verso l'alto in posizione di coltello a serramanico.
Si crea un campo sterile (telo e guanti sterili, disinfettante) e si utilizzare un anestetico per privare di sensibilità la parte interessata. Si procede con l'ago mantenendovi una costante pressione per permettere di superare la resistenza meccanica dei diversi strati.
L'uscita del liquido, descritto come “acqua di roccia”, deve avvenire senza aspirazione ma per caduta spontanea, così da non sottoporre lo spazio subaracnoideo a pressione negativa, evitando nausea e cefalea, ed è segno del corretto posizionamento dell'ago, senza necessità di procedere ulteriormente.
Farmaci
modificaLa bupivacaina (nome commerciale Marcaina) è l'anestetico locale più comunemente usato, sebbene si possano usare anche lidocaina, tetracaina, procaina, ropivacaina, levobupivicaina o prilocaina.
Possono essere aggiunti oppioidi per prolungare il blocco o fornire sollievo dal dolore post-operatorio (ad esempio morfina, fentanil, sufentanil, diamorfina e buprenorfina). Possono anche essere aggiunti farmaci non oppioidi come la clonidina o l'epinefrina per prolungare la durata dell'analgesia. Nel Regno Unito, dal 2004 il National Institute for Health and Care Excellence raccomanda che l'anestesia spinale per taglio cesareo sia integrata con diamorfina intratecale e questa combinazione è ora la forma routinaria di anestesia per questa indicazione in quel paese. Negli Stati Uniti la morfina viene utilizzata per i tagli cesarei per lo stesso scopo poiché la diamorfina non viene utilizzata nella pratica clinica negli Stati Uniti.
Il grado di blocco neuronale dipende dalla quantità e dalla concentrazione di anestetico locale utilizzato e dalle proprietà dell'assone. Le sottili fibre C non mielinizzate, responsabili del dolore, vengono bloccate per prime, mentre i motoneuroni (fibre Aα) spessi e fortemente mielinizzati vengono bloccati moderatamente. Le piccole fibre simpatiche pregangliari, fortemente mielinizzate, sono bloccate per ultime. Le sensazioni di tatto e pressione sono possibili e spesso si verificano a causa del blocco incompleto dei meccanorecettori Aβ, più spessi.
Baricità del farmaco
modificaLa baricità del farmaco (la densità rispetto al liquido cerebrospinale umano) viene sfruttata per determinare il modo in cui un particolare farmaco si diffonderà nello spazio intratecale: con la formulazione iperbarica (resa più dense aggiungendo glucosio alla miscela), la diffusione può essere controllata in modo efficace e prevedibile dall'anestesista, inclinando il paziente.
La baricità determina anche la solvatazione o dissoluzione (l'effetto dell'aggiunta di un soluto a un solvente), che ha un effetto sulla diffusione dell'anestetico. Nell'anestesia spinale con tetracaina, è stato scoperto che la velocità di insorgenza dell'analgesia era più rapida e il livello massimo di analgesia era più alto con una soluzione di glucosio al 10% rispetto a una soluzione di anestetico spinale con glucosio al 5%;[4] inoltre, la quantità di efedrina richiesta era inferiore nei pazienti che avevano ricevuto la soluzione di glucosio al 5%. In un altro studio, questa volta con bupivacaina allo 0,5%, l'estensione massima media del blocco sensoriale era significativamente più alta con glucosio all'8% che con glucosio allo 0,83% o allo 0,33%. Anche il tasso di insorgenza del blocco sensoriale a T12 è stato più rapido con soluzioni contenenti l'8% di glucosio.[5]
Complicanze
modificaLe complicanze dell'anestesia spinale possono derivare dagli effetti fisiologici sul sistema nervoso e possono anche essere correlate alla tecnica di posizionamento. La maggior parte degli effetti collaterali comuni sono minori e si risolvono da soli o sono facilmente curabili, mentre le complicanze maggiori possono provocare danni neurologici più gravi e permanenti e raramente la morte; questi sintomi possono manifestarsi immediatamente dopo la somministrazione dell'anestetico o essere ritardati.
Le complicanze comuni e minori includono:[6]
- Lieve ipotensione
- Bradicardia
- Nausea e vomito[7]
- Sintomi neurologici transitori:[8] dolore lombare, dolore alle gambe, cefalea[9][10]
Le complicanze gravi e permanenti sono rare, ma di solito sono correlate a effetti fisiologici sul sistema cardiovascolare e sul sistema neurologico o quando l'iniezione è stata involontariamente nel sito sbagliato:[6]
- Lesioni nervose, sindrome della cauda equina, radicolopatie
- Infarto miocardico
- Ipotensione severa
- Ematoma epidurale spinale, con o senza sequele neurologiche dovute alla compressione dei nervi spinali.
- Ascesso epidurale spinale
- Infezioni, meningite settica
Controindicazioni
modifica- Infezione locale nel sito di iniezione
- Disturbi della coagulazione, trombocitopenia o anticoagulanti sistemici (aumentato rischio di ematoma epidurale)
- Stenosi aortica grave
- Aumento della pressione intracranica, lesioni encefaliche occupanti spazio
- Ipovolemia
- Allergie ad anestetici locali
Note
modifica- ^ Corning J. L., N.Y. Med. J. 1885, 42, 483.
- ^ Silvia Bencivelli, August Bier, in Eroica, folle e visionaria - Storie di medicina spericolata, Bollati Boringhieri, 2023, p. 101, ISBN 9788833941745.
- ^ Bier A. Versuche über Cocainisirung des Rückenmarkes. Deutsch Zeitschrift für Chirurgie, 1899; 51:361
- ^ Yoshihiro Hirabayashi, Reiju Shimizu e Kazuhiko Saitoh, Effect of glucose concentration on the subarachnoid spread of tetracaine in the parturient, in Journal of Anesthesia, vol. 9, n. 3, 1995-09, pp. 211–213, DOI:10.1007/BF02479865. URL consultato il 16 novembre 2022.
- ^ archive.is, su archive.is. URL consultato il 16 novembre 2022 (archiviato dall'url originale il 5 settembre 2013).
- ^ a b Jason Cwik, Postoperative considerations of neuraxial anesthesia, in Anesthesiology Clinics, vol. 30, n. 3, 2012-09, pp. 433–443, DOI:10.1016/j.anclin.2012.07.005. URL consultato il 16 novembre 2022.
- ^ (EN) M. Balki e J.C.A. Carvalho, Intraoperative nausea and vomiting during cesarean section under regional anesthesia, in International Journal of Obstetric Anesthesia, vol. 14, n. 3, 2005-07, pp. 230–241, DOI:10.1016/j.ijoa.2004.12.004. URL consultato il 16 novembre 2022.
- ^ S. S. Liu e S. B. McDonald, Current issues in spinal anesthesia, in Anesthesiology, vol. 94, n. 5, 2001-05, pp. 888–906, DOI:10.1097/00000542-200105000-00030. URL consultato il 16 novembre 2022.
- ^ Hannu Kokki, Spinal blocks, in Paediatric Anaesthesia, vol. 22, n. 1, 2012-01, pp. 56–64, DOI:10.1111/j.1460-9592.2011.03693.x. URL consultato il 16 novembre 2022.
- ^ (EN) B. Maranhao, M. Liu e A. Palanisamy, The association between post‐dural puncture headache and needle type during spinal anaesthesia: a systematic review and network meta‐analysis, in Anaesthesia, vol. 76, n. 8, 2021-08, pp. 1098–1110, DOI:10.1111/anae.15320. URL consultato il 16 novembre 2022.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Anestesia subaracnoidea
Collegamenti esterni
modifica- (EN) spinal anesthesia, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4137116-1 |
|---|