Dicloruro di zirconocene
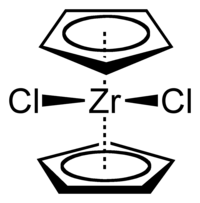
Il dicloruro di zirconocene è un composto organometallico con formula (C5H5)2ZrCl2, scritta in forma abbreviata come Cp2ZrCl2. Il complesso è costituito da un atomo centrale di zirconio coordinato da due leganti ciclopentadienile e due leganti cloro. È un solido incolore diamagnetico relativamente stabile a contatto con l'aria, solubile in benzene, cloroformio e 1,2-dimetossietano. In acqua è solubile ma si decompone lentamente.[2]
| Dicloruro di zirconocene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| bis-π-ciclopentadienildiclorozirconio | |
| Nomi alternativi | |
| dicloruro di bis(ciclopentadienil)zirconio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H10Cl2Zr |
| Massa molecolare (u) | 292,31 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 215-066-8 |
| PubChem | 10891641 e 101920956 |
| SMILES | [cH-]1cccc1.[cH-]1cccc1.[Cl-].[Cl-].[Zr+4] |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | idrolizza |
| Temperatura di fusione | 242–245 °C (515–518 K)[1] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 30 intraperitoneale, ratto[1] |
| Indicazioni di sicurezza | |
| Frasi H | 315 - 319 - 335 [1] |
| Consigli P | 261 - 305+351+338 [1] |
Sintesi
modificaIl composto si può ottenere facendo reagire il complesso ZrCl4–THF con ciclopentadienuro di sodio:
- ZrCl4(THF)2 + 2 NaCp → Cp2ZrCl2 + 2 NaCl + 2 THF
L'analogo composto Cp2ZrBr2 fu ottenuto per la prima volta nel 1953.[3][4]
Struttura
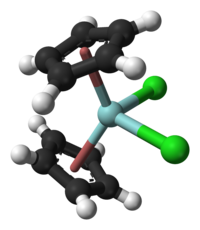
modificaLa molecola Cp2ZrCl2 ha la struttura tipo metallocene piegato, cioè dove i due anelli ciclopentadienile non sono paralleli. L'angolo Cp–Zr–Cp (considerando il centro degli anelli) è 128°. L'angolo Cl–Zr–Cl è 97,1°. Il composto cristallizza nel sistema triclino, gruppo spaziale P1, con costanti di reticolo a = 1406 pm, b = 809 pm, c = 1315 pm, α = 113,7°, β = 117,9°, γ = 99,5°.[5]
Reattività
modificaReattivo di Schwartz
modificaIl dicloruro di zirconocene reagisce con il tetraidroalluminato di litio per formare il reattivo di Schwartz, Cp2ZrHCl:
- (C5H5)2ZrCl2 + 1/4 LiAlH4 → (C5H5)2ZrHCl + 1/4 LiAlCl4
Il tetraidroalluminato di litio è un forte riducente, e quindi si può avere simultanea riduzione a formare il complesso diidruro Cp2ZrH2; trattando la miscela di prodotti con diclorometano si ha conversione al reattivo di Schwartz.[6]
Reattivo di Negishi
modificaIl dicloruro di zirconocene può servire a preparare anche il reattivo di Negishi, Cp2Zr(η2-butene), usato come fonte di Cp2Zr in reazioni di ciclizzazione ossidativa. Il reattivo si ottiene trattando il dicloruro di zirconocene con n-butillitio, in modo da sostituire i due leganti cloro con due gruppi butile. In seguito si ha un riarrangiamento per formare un legante η2-butene, mentre il secondo butile viene eliminato come butano.[7]
Reazioni di polimerizzazione
modificaIl dicloruro di zirconocene viene anche usato come catalizzatore o precatalizzatore nelle reazioni di polimerizzazione per ottenere polimeri non accessibili tramite i normali catalizzatori di Ziegler-Natta.[8]
Tossicità / Indicazioni di sicurezza
modificaIl composto è disponibile in commercio. È classificato come irritante per la pelle, gli occhi e le vie respiratorie. Non risultano rischi di cancerogenicità.[1]
Note
modificaBibliografia
modifica- (EN) H. B. Bradley e L. G. Dowell, Crystallographic Data. 168. Bis(cyclopentadienyl)Zirconium Dichloride, in Anal. Chem., vol. 30, n. 4, 1958, pp. 548-548, DOI:10.1021/ac60136a601.
- (EN) S. L. Buchwald, S. J. LaMaire, R. B. Nielsen, B. T. Watson e S. M. King, Schwartz's Reagent, in Organic Syntheses, vol. 71, 1993, p. 77, DOI:10.15227/orgsyn.071.0077.
- (DE) J. Buddrus e B. Schmidt, Metallorganische Verbindungen, in Grundlagen der Organischen Chemie, 5ª ed., Walter de Gruyter, 2015, ISBN 9783110331059.
- (EN) E.-I. Negishi e T. Takahashi, Patterns of Stoichiometric and Catalytic Reactions of Organozirconium and Related Complexes of Synthetic Interest, in Acc. Chem. Res., vol. 27, n. 5, 1994, pp. 124-130, DOI:10.1021/ar00041a002.
- (EN) K. Prout, T. S. Cameron, R. A. Forder e altri, The crystal and molecular structures of bent bis-π-cyclopentadienyl-metal complexes: (a) bis-π-cyclopentadienyldibromorhenium(V) tetrafluoroborate, (b) bis-π-cyclopentadienyldichloromolybdenum(IV), (c) bis-π-cyclopentadienylhydroxomethylaminomolybdenum(IV) hexafluorophosphate, (d) bis-π-cyclopentadienylethylchloromolybdenum(IV), (e) bis-π-cyclopentadienyldichloroniobium(IV), (f) bis-π-cyclopentadienyldichloromolybdenum(V) tetrafluoroborate, (g) μ-oxo-bis[bis-π-cyclopentadienylchloroniobium(IV)] tetrafluoroborate, (h) bis-π-cyclopentadienyldichlorozirconium, in Acta Cryst., B30, 1974, pp. 2290-2304, DOI:10.1107/S0567740874007011.
- Sigma-Aldrich, Scheda di dati di sicurezza del bis(cyclopentadienyl)zirconium(IV) dichloride, su sigmaaldrich.com, 2014.
- (EN) G. Wilkinson, P. L. Pauson, J. M. Birmingham e F. A. Cotton, Bis-cyclopentadienyl derivatives of some transition elements, in J. Am. Chem. Soc., vol. 75, n. 4, 1953, pp. 1011-1012, DOI:10.1021/ja01100a527.
- (EN) G. Wilkinson e J. M. Birmingham, Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta, in J. Am. Chem. Soc., vol. 76, n. 17, 1954, pp. 4281-4284, DOI:10.1021/ja01646a008.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su dicloruro di zirconocene