Brivudina
La brivudina (chiamata anche brivudin) è un farmaco antivirale che viene utilizzato nel trattamento delle infezioni acute causate dal virus herpes zoster.[1][2]
| Brivudina | |
|---|---|
 | |
| Nome IUPAC | |
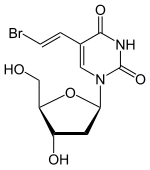
| 5-[(E)-2-bromoethenyl]-1-[(2R,4S,5R)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,2,3,4-tetrahydropyrimidine-2,4-dione | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C11H13BrN2O5 |
| Massa molecolare (u) | 333.135 g/mol |
| Numero CAS | |
| Codice ATC | J05 |
| PubChem | 446727 CID 446727 |
| DrugBank | DBDB03312 |
| SMILES | C1C(C(OC1N2C=C(C(=O)NC2=O)C=CBr)CO)O |
| Dati farmacocinetici | |
| Biodisponibilità | 30% |
| Legame proteico | 95% |
| Metabolismo | Epatico |
| Emivita | 16 ore |
| Indicazioni di sicurezza | |
Storia
modificaLa brivudina fu sintetizzata dai ricercatori della Università di Birmingham, nel Regno Unito, negli anni 70. Maudgal e De Clercq dell'Istituto Rega per la ricerca medica del Belgio, dimostrarono che si trattava di un potente inibitore del virus herpes simplex tipo 1 (HSV-1) e del virus della varicella zoster (VZV).[3] Il farmaco è stato commercializzato in Germania a partire dagli anni 80 da parte della società farmaceutica Berlin-Chemie, successivamente acquistata dal gruppo farmaceutico italiano Menarini. In Italia è stata autorizzata alla immissione in commercio a partire dal luglio 2000, in confezioni da 7 compresse di 125 mg.
Meccanismo d'azione
modificaLa brivudina è un analogo della timidina[4] che esercita la sua attività antivirale come virostatico[5] attraverso la inibizione della DNA polimerasi virale. Tuttavia la sostanza ha dimostrato di inibire anche in modo irreversibile l'enzima diidropirimidina deidrogenasi (DPD), fondamentale nella regolazione del metabolismo dei nucleosidi naturali e dei farmaci a base di pirimidina. La contemporanea assunzione di brivudina aumenta in modo marcato i livelli plasmatici di 5-fluorouracile con conseguente aumento di tossicità dello stesso.[6][7]
Farmacocinetica
modificaDopo somministrazione orale la brivudina viene assorbita rapidamente dal tratto gastrointestinale. Il farmaco subisce un elevato metabolismo di primo passaggio epatico, che ne riduce la biodisponibilità a circa il 30% della dose orale somministrata. Il picco della concentrazione plasmatica viene raggiunto dopo circa 1 ora dalla somministrazione orale di 125 mg.
La brivudina si distribuisce con facilità nei tessuti. Il legame alle proteine plasmatiche è del 95%. L'emivita plasmatica è di circa 16 ore.
L'eliminazione avviene principalmente attraverso le urine (circa il 65% della dose assunta) principalmente sotto forma di acido urilacetico.
Farmacodinamica
modificaLa brivudina è un analogo nucleosidico. All'interno delle cellule infettate da virus Varicella Zoster, grazie ad alcuni enzimi codificati dal virus ed in particolare alla timidina chinasi, la brivudina viene fosforilata fino alla formazione di brivudina trifosfato.
L'interazione tra la brivudina trifosfato e la DNA polimerasi virale porta al blocco della replicazione del virus.
L'inibizione della replicazione del virus comporta una accelerata risoluzione delle manifestazioni cutanee (in alcuni studi clinici il periodo di tempo intercorrente dall'inizio del trattamento fino all'ultima eruzione vescicolare è stato di 13,5 ore nei soggetti trattati con brivudina contro 18 ore nei soggetti trattati con aciclovir).[8]
Anche il rischio di sviluppo di nevralgia posterpetica si riduce nei soggetti trattati con brivudina rispetto a quelli trattati con aciclovir (rispettivamente il 33% contro il 43%).[9]
Usi clinici
modificaLa brivudina viene utilizzata per il trattamento precoce delle infezioni acute sostenute da herpes zoster in soggetti adulti immunocompetenti.
In letteratura sono riportati utilizzi del farmaco come alternativa all'aciclovir od al ganciclovir, nella sindrome da necrosi retinica acuta da herpes zoster[10]
Tossicologia
modificaControindicazioni
modificaIl farmaco è controindicato in caso di ipersensibilità nota al principio attivo e nei pazienti gravemente immunocompromessi.
La brivudina è controindicata in tutti i soggetti che sono trattati con chemioterapia antineoplastica, specialmente se con 5-fluorouracile,[6] sia per via sistemica che topica.[11]
Le stesse controindicazioni valgono anche per l'utilizzo di farmaci 5-fluoropirimidinici (ad esempio floxuridina, tegafur, o capecitabina[12]) e le associazioni di farmaci contenenti i già citati principi attivi od altre sostanze 5-fluoropirimidiniche (ad esempio la flucitosina).
Si raccomanda di lasciar trascorrere almeno 4 settimane dalla ultima assunzione di brivudina prima di intraprendere un trattamento con sostanze 5-fluoropirimidiniche o loro associazioni.
Nei pazienti recentemente trattati con brivudina il monitoraggio dell'attività dell'enzima diidropirimidina-deidrogenasi prima di iniziare un trattamento con farmaci 5-fluoropirimidinici è una importante ulteriore precauzione.
Nel caso di somministrazione accidentale di farmaci 5-fluoropirimidinici in soggetti in trattamento con brivudina impone l'ospedalizzazione del paziente e la messa in atto di tutte le misure opportune per ridurre la tossicità da fluoropirimidina ed in particolare quelle che hanno come obiettivo la prevenzione delle infezioni sistemiche e la disidratazione.
I comuni sintomi associati a tossicità da fluoropirimidina sono la nausea, il vomito e la diarrea.
In casi particolarmente gravi sono state segnalate stomatiti, mucositi, necrosi epidermica tossica, neutropenia e depressione midollare.
La sicurezza d'uso della brivudina nel corso della gravidanza non è stata accertata, pertanto il farmaco è controindicato nelle gravide.
Poiché la brivudina ed il suo principale metabolita (il bromoviniluracile) viene escreto nel latte il farmaco è controindicato in tutte le donne che allattano.
Effetti collaterali ed indesiderati
modificaL'effetto collaterale più frequente in corso di trattamento è la nausea.[4]
Meno comuni e frequenti il vomito, la diarrea, i dolori addominali, la cefalea, le vertigini la sonnolenza.
Sono stati segnalati disturbi a carico del sistema emolinfopoietico ed in particolare granulocitopenia, eosinofilia, anemia, linfocitosi e monocitosi.
Effetti epatotossici non comuni consistono in epatite colestatica o citolitica, ittero colestatico ed aumento degli enzimi epatici. La maggior parte di questi effetti ha inizio a distanza di pochi giorni fino a 4 settimane dal termine del trattamento.
Gli studi clinici hanno dimostrato che il rischio di epatite acuta è aumentato notevolmente dal prolungamento del trattamento oltre i 7 giorni consigliati. Tale atteggiamento terapeutico pertanto deve essere assolutamente evitato.[13]
Molto raramente sono stati segnalati trombocitopenia, allucinazioni e stato confusionale, disgeusia e tremore, ipotensione arteriosa e dolori ossei.
Dosi terapeutiche
modificaIl farmaco deve essere assunto per os, al dosaggio di 125 mg, una volta al giorno e per un periodo di trattamento di una settimana. Dopo il primo ciclo di terapia non sono necessari ulteriori cicli.
È bene che il trattamento abbia inizio precocemente, meglio se entro 72 ore dalle prime manifestazioni cutanee.
I soggetti anziani ed i soggetti affetti da insufficienza epatica o renale non richiedono alcun aggiustamento del dosaggio.
Gravidanza e allattamento
modificaIn studi sperimentali su animali non sono stati dimostrati effetti embriotossici o teratogeni. Tuttavia il profilo di sicurezza di brivudina nella donna in gravidanza non è stato ancora stabilito e perciò il composto è controindicato nelle donne in stato di gravidanza.
Altri studi condotti su animali hanno evidenziato che sia il farmaco che bromoviniluracile (BVU), il suo principale metabolita, vengono escreti nel latte. Pertanto l'allattamento al seno è controindicato durante l'assunzione di brivudina.
Avvertenze
modificaAnche se non sono stati segnalati effetti della brivudina sulla capacità di guidare veicoli od usare macchinari che richiedono un elevato livello di attenzione, è necessario tenere in considerazione che, tra gli effetti collaterali non comuni, sono stati segnalati casi di vertigine e sonnolenza.
Interazioni
modificaLa principale interazione del farmaco, potenzialmente fatale, è quella inerente all'eventuale contemporanea assunzione di 5-fluorouracile od altre 5-fluoropirimidine. La brivudina inibisce infatti irreversibilmente l'enzima diidropiridina-deidrogenasi che è fondamentale nel processo di eliminazione dei citati farmaci citostatici. Di conseguenza, la concentrazione di essi aumenta notevolmente fino a raggiungere limiti tossici che possono causare la morte del paziente.
La brivudina presenta inoltre interazione con alcuni farmaci dopaminergici utilizzati per il trattamento della malattia di Parkinson, tale da rendere probabile la precipitazione della corea.
Note
modifica- ^ Snoeck R, Andrei G, De Clercq E, Current pharmacological approaches to the therapy of varicella zoster virus infections: a guide to treatment, in Drugs, vol. 57, febbraio 1999, pp. 187–206, PMID 10188760.
- ^ De Clercq E, (E)-5-(2-bromovinyl)-2'-deoxyuridine (BVDU), in Med Res Rev, vol. 25, gennaio 2005, pp. 1–20, DOI:10.1002/med.20011, PMID 15389733.
- ^ Maudgal PC, De Clercq E, Descamps J, Missotten L, Comparative evaluation of BVDU ((E)-5-(2-bromovinyl)-2'-deoxyuridine) in the treatment of experimental herpes simplex keratitis in rabbits, in Bull Soc Belge Ophtalmol, vol. 186, 1979, pp. 109–18, PMID 554711.
- ^ a b Keam SJ, Chapman TM, Figgitt DP, Brivudin (bromovinyl deoxyuridine), in Drugs, vol. 64, 2004, pp. 2091–7; discussion 2098–9, PMID 15341504.
- ^ Rabasseda X, Brivudine: a herpes virostatic with rapid antiviral activity and once-daily dosing, in Drugs Today, vol. 39, maggio 2003, pp. 359–71, PMID 12861349.
- ^ a b Keizer HJ, De Bruijn EA, Tjaden UR, De Clercq E, Inhibition of fluorouracil catabolism in cancer patients by the antiviral agent (E)-5-(2-bromovinyl)-2'-deoxyuridine, in J. Cancer Res. Clin. Oncol., vol. 120, 1994, pp. 545–9, PMID 8045919.
- ^ Ben-Efraim S, Shoval S, de Clercq E, Enhancing effect of bromovinyldeoxyuridine on antitumour activity of 5-fluorouracil in mice bearing MOPC-315 plasmacytomas, in Br. J. Cancer, vol. 54, novembre 1986, pp. 847–51, PMC 2001541, PMID 3801279.
- ^ Wassilew SW, Wutzler P, Oral brivudin in comparison with acyclovir for improved therapy of herpes zoster in immunocompetent patients: results of a randomized, double-blind, multicentered study, in Antiviral Res., vol. 59, giugno 2003, pp. 49–56, PMID 12834860.
- ^ Wassilew SW, Wutzler P, Oral brivudin in comparison with acyclovir for herpes zoster: a survey study on postherpetic neuralgia, in Antiviral Res., vol. 59, giugno 2003, pp. 57–60, PMID 12834861.
- ^ (DE) Vij O, Bornfeld N, Roggendorf M, Fiedler M, Schilling H, [Brivudine as an alternative systemic therapy to aciclovir and ganciclovir in acute retinal necrosis syndrome due to varicella-zoster virus], in Klin Monbl Augenheilkd, vol. 220, ottobre 2003, pp. 710–5, DOI:10.1055/s-2003-43138, PMID 14577039.
- ^ De Clercq E, Discovery and development of BVDU (brivudin) as a therapeutic for the treatment of herpes zoster, in Biochem. Pharmacol., vol. 68, dicembre 2004, pp. 2301–15, DOI:10.1016/j.bcp.2004.07.039, PMID 15548377.
- ^ Rätz Bravo AE, Hofer S, Krähenbühl S, Ludwig C, Fatal drug-drug interaction of brivudine and capecitabine, in Acta Oncol, vol. 48, 2009, pp. 631–3, DOI:10.1080/02841860802660502, PMID 19165642.
- ^ Mottu A, Rubbia-Brandt L, Bihl F, Hadengue A, Spahr L, Acute hepatitis due to brivudin: a case report, in J. Hepatol., vol. 51, novembre 2009, pp. 967–9, DOI:10.1016/j.jhep.2009.06.017, PMID 19692139.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su brivudina