Bromato
Lo ione bromato è un anione di formula BrO3− e numero CAS , con il bromo in stato di ossidazione +5. Un bromato è un composto che contiene questo ione. Alcuni esempi di bromati sono il bromato di sodio, NaBrO3, e il bromato di potassio, KBrO3.
| Ione bromato | |
|---|---|
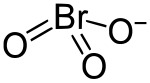 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HBrO3 |
| Numero CAS | |
| PubChem | 84979 |
| SMILES | OBr(=O)=O |
| Indicazioni di sicurezza | |
Formazione
modificaLo ione bromato viene formato quando l'ozono e lo ione bromuro vengono a contatto secondo la seguente reazione:
- Br− + O3 → BrO3–
In natura
modificaQuesta reazione ha luogo in sistemi acquatici quando il bromuro viene dissolto in acqua e l'ozono è utilizzato per disinfettare l'acqua, specialmente ad alte pressioni. Questa reazione è indesiderabile, perché i bromati sono cancerogeni. La presenza dei bromati nell'acqua imbottigliata Dasani ha richiesto un richiamo di tutte le bottiglie in distribuzione in Inghilterra. Per ridurre la formazione dei bromati è necessario abbassare il pH dell'acqua per farlo rientrare tra l'intervallo 5,9 e 6,3, e moderare la dose di ozono.
In laboratorio
modificaIn laboratorio i bromati possono essere prodotti dissolvendo il bromo in una soluzione dell'idrossido del metallo che si vuole formare, ad esempio, per il bromato di sodio è necessario del bromo e dell'idrossido di sodio:
- Br2 + 2OH– → Br– + BrO– + H2O
- 3BrO– → BrO3– + 2Br–
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Bromato