Cloruro di nitrosile
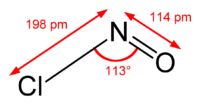
Il cloruro di nitrosile è un composto inorganico di formula NOCl o anche Cl–N=O. Esso è un gas giallognolo tossico. Costituisce parte dei fumi che fuoriescono da soluzioni di acqua regia.
| Cloruro di nitrosile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ossido cloruro di azoto(III) | |
| Nomi alternativi | |
| Cloruro di nitrosile Ossicloruro di azoto | |
| Caratteristiche generali | |
| Formula bruta o molecolare | NOCl |
| Massa molecolare (u) | 65,459 g/mol |
| Aspetto | gas giallo |
| Numero CAS | |
| Numero EINECS | 220-273-1 |
| PubChem | 17601 |
| SMILES | N(=O)Cl |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | -59,4 °C |
| Temperatura di ebollizione | -5,55 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
Sintesi
modificaIl cloruro di nitrosile viene prodotto su scala industriale per reazione fra acido cloridrico ed acido nitrosilsolforico.[1]
Un altro metodo di produzione del cloruro di nitrosile è far reagire direttamente i suoi elementi costituenti a circa 400 °C.
Un metodo facilmente applicabile in laboratorio è la disidratazione dell'acido nitroso tramite HCl.[2]
Michael Faraday preparò NOCl per reazione tra palladio ed acqua regia.
Il cloruro di nitrosile viene prodotto per lenta reazione fra l'acido nitrico e l'acido cloridrico che compongono l'acqua regia.
HNO3 + 3 HCl -> Cl2 + 2 H2O + NOCl
Questa reazione venne studiata da Edmund Davy nel 1831.[3]
Tuttavia in presenza di acido nitrico NOCl si ossida istantaneamente in diossido di azoto, fornendo all'acqua regia il caratteristico colore aranciato.
Reazioni
modificaIl cloruro di nitrosile è un elettrofilo e reagisce con gli epossidi per dare α-cloronitriti di alchile:
Reagisce inoltre con i cheteni per dare nitrosil-derivati e con le ammine cicliche per dare alcheni.
Impieghi
modificaIl cloruro di nitrosile reagisce fotochimicamente con il cicloesano per dare il cloridrato di cicloesanonossima, precursore del caprolattame, a sua volta usato per produrre il nylon-6.[1]
Note
modifica- ^ a b Josef Ritz, Hugo Fuchs, Heinz Kieczka, William C. Moran "Caprolactam" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. DOI: 10.1002/14356007.a05_031
- ^ J. R. Morton, H. W. Wilcox "Nitrosyl Chloride" Inorganic Syntheses 1953, vol. 48-52. DOI: 10.1002/9780470132357.ch16
- ^ Edmund Davy, Abstracts of the Papers Printed in the Philosophical Transactions of the Royal Society of London, Vol. 3., JSTOR, 1830 - 1837, pp. 27–29, JSTOR 110250.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su cloruro di nitrosile