Cloruro di vanadio(III)
Il cloruro di vanadio(III) o tricloruro di vanadio è il composto inorganico binario con formula VCl3. In condizioni normali è un solido di colore viola scuro, molto igroscopico e sensibile all'ossidazione.[3] VCl3 è disponibile in commercio. Viene usato industrialmente come catalizzatore per produrre gomme e polietilene, e come precursore per la sintesi di altri composti di vanadio.[4]
| Cloruro di vanadio(III) | |
|---|---|
 | |
| Nome IUPAC | |
| Cloruro di vanadio(III), tricloruro di vanadio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | VCl3 |
| Massa molecolare (u) | 157,30 |
| Aspetto | solido viola scuro |
| Numero CAS | |
| Numero EINECS | 231-744-6 |
| PubChem | 62647 |
| SMILES | Cl[V](Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3[1] |
| Solubilità in acqua | decomposizione |
| Temperatura di fusione | >300 °C (dec)[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -581[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 350 (ratto, orale)[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 314 |
| Consigli P | 280 - 305+351+338 - 310 |
Storia
modificaIl composto VCl3 fu ottenuto per la prima volta nel 1869 da Henry Enfield Roscoe, per decomposizione termica di VCl4.[5][6]
Struttura molecolare e configurazione elettronica
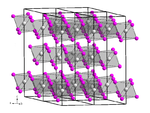
modificaVCl3 è un solido polimerico. Allo stato solido possiede una struttura cristallina esagonale analoga a quella dello ioduro di bismuto, gruppo spaziale R3 con costanti di reticolo a = 601 pm e c = 1734 pm, sei unità di formula per cella elementare.[7] Gli atomi di vanadio risultano esacoordinati. La struttura può essere descritta come un impacchettamento compatto esagonale di anioni cloruro, mentre i cationi V3+ sono situati in uno strato sì e uno no, occupando i due terzi degli interstizi ottaedrici.[8][9] Lo ione V3+ ha configurazione elettronica d 2, e i due elettroni spaiati rendono paramagnetico il composto.[3]
Sintesi
modificaVCl3 si può preparare in vari modi.[10][11]
Una possibilità è riscaldare VCl4 a 160-170 °C usando un flusso di gas inerte per allontanare il cloro:
- 2 VCl4 → 2 VCl3 + Cl2
Si può ottenere anche per sintesi diretta facendo reagire in un tubo sigillato cloro liquido con vanadio metallico:
- 2 V + 3 Cl2 → 2 VCl3
Alcune altre possibilità sono:
Reattività
modificaVCl3 è un composto molto igroscopico e molto sensibile all'ossidazione. È anche molto sensibile alla presenza di ossigeno, che provoca la formazione di ossicloruri come VOCl, VOCl2 e VOCl3.[9][12]
Sciolto in acqua forma lo ione esaaquo [V(H2O)6]3+.[3] Da queste soluzioni si può ottenere il sale idrato VCl3•6H2O che in realtà ha struttura trans-[V(H2O)4Cl2]Cl•2H2O.[2][13]
In soluzione in presenza di altri leganti si formano complessi paramagnetici, vista la configurazione elettronica d2 dello ione V3+. In genere si formano complessi ottaedrici tipo [VL6]3+, [VCl2L4]+, [VCl3L3] o [VCl6]3–, ma sono possibili anche altre geometrie, come ad esempio [VCl4]– (tetraedrico) e [V(CN)7]4– (bipiramide pentagonale).[2]
Tossicità / Indicazioni di sicurezza
modificaVCl3 è disponibile in commercio. Il composto provoca gravi ustioni cutanee e gravi lesioni oculari. È nocivo per ingestione. Non ci sono evidenze di effetti cancerogeni. Non sono disponibili dati su effetti ambientali.[1]
Note
modificaBibliografia
modifica- (EN) G. Bauer, V. Güther, H. Hess, A. Otto, O. Roidl, H. Roller e S. Sattelberger, Vanadium and vanadium compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a27_367.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 2, 2ª ed., New York, Academic Press, 1965.
- W. F. Donovan e P. W. Smith, Crystal and molecular structures of aquahalogenovanadium(III) complexes. Part I. X-Ray crystal structure of trans-tetrakisaquadibromo-vanadium(III) bromide dihydrate and the isomorphous chloro-compound, in J. Chem. Soc., Dalton Trans., 1975, pp. 894-896, DOI:10.1039/DT9750000894. URL consultato il 18 marzo 2014.
- P. Ehrlich e H.-J. Seifert, Über Vanadinchloride, in Z. anorg. allg. Chem., vol. 301, n. 5-6, 1959, pp. 282-287, DOI:10.1002/zaac.19593010508. URL consultato il 18 marzo 2014.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- W. Klemm e E. Krose, Die Kristallstrukturen von ScCl3, TiCl3 und VCl3, in Z. anorg. Chem., vol. 253, n. 3-4, 1947, pp. 218-225, DOI:10.1002/zaac.19472530313. URL consultato il 18 marzo 2014.
- (EN) U. Müller, Inorganic Structural Chemistry, 2ª ed., Wiley, 2006, ISBN 978-0-470-01864-4.
- (EN) R. L. Richards, Vanadium: Inorganic & Coordination Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia253, ISBN 978-0-470-86210-0.
- H. E. Roscoe, Researches on vanadium. Part II. On the chlorides of vanadium and metallic vanadium, in Chemical News, vol. 20, n. 504, 1869, pp. 37-38. URL consultato il 18 marzo 2014.
- H. E. Roscoe, XXVI.—Researches on vanadium. Part II. On the chlorides of vanadium and metallic vanadium, in J. Chem. Soc., vol. 23, 1870, pp. 344-358, DOI:10.1039/JS8702300344. URL consultato il 18 marzo 2014.
- Sigma-Aldrich, Vanadium(III) chloride, su sigmaaldrich.com. URL consultato il 18 marzo 2014.
- R. C. Young e M. E. Smith, Vanadium(II) chloride (TXT), in Inorg. Synth., vol. 4, 1953, pp. 128-130. URL consultato il 18 marzo 2014.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Cloruro di vanadi