Dermorfina
La dermorfina è un epta-peptide isolato per la prima volta dalla pelle delle rane sudamericane appartenenti alla famiglia della Phyllomedusa.[1]. Questo peptide è un oppioide naturale che agisce come un agonista grazie alla sua potente ed elevata affinità coi μ-recettori degli oppioidi, una classe di recettori con alta affinità per le encefaline e per le beta-endorfine, e bassa invece per le dinorfine.
| Dermorfina | |
|---|---|
 | |
 | |
| Nomi alternativi | |
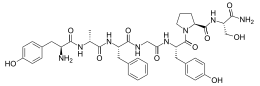
| Tirosil-alanil-fenilalanil-glicil-tirosil-prolil-serinamide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C40H50N8O10 |
| Massa molecolare (u) | 802.89 g/mol |
| Numero CAS | |
| PubChem | 5485199 |
| SMILES | CC(C(=O)NC(CC1=CC=CC=C1)C(=O)NCC(=O)NC(CC2=CC=C(C=C2)O)C(=O)N3CCCC3C(=O)NC(CO)C(=O)N)NC(=O)C(CC4=CC=C(C=C4)O)N |
| Indicazioni di sicurezza | |
La dermorfina è come analgesico circa 30-40 volte più potente della morfina, e proprio grazie alla sua alta potenza è meno probabile che induca tolleranza e dipendenza.[2].
La sequenza di amminoacidi della dermorfina è: H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2.
La dermorfina non è presente nell'organismo umano e degli altri mammiferi, e peptidi costituiti da altri D-aminoacidi simili sono stati rinvenuti solamente in alcune specie di batteri, anfibi e molluschi.[3] In questi organismi, sembra che la dermorfina sia sintetizzata a seguito di una Modificazione post traduzionale di alcuni aminoacidi eseguita da alcuni enzimi isomerasi.[4]. Questo raro processo chimico si rende necessario poiché la D-alanina (presente nella sequenza della dermorfina) non è tra i 20 aminoacidi codificati nel DNA umano, e pertanto il peptide non può essere codificato come gli altri a partire dal genoma.
La dermorfina è stata utilizzata illegalmente nelle corse di cavalli.[5]
Note
modifica- ^ Melchiorri P, Negri L, The dermorphin peptide family, in Gen. Pharmacol., vol. 27, n. 7, 1996, pp. 1099–107, DOI:10.1016/0306-3623(95)02149-3, PMID 8981054.
- ^ Broccardo M, Erspamer V, Falconieri Erspamer G, Pharmacological data on dermorphins, a new class of potent opioid peptides from amphibian skin, in Br. J. Pharmacol., vol. 73, n. 3, 1981, pp. 625–31, DOI:10.1111/j.1476-5381.1981.tb16797.x, PMC 2071698, PMID 7195758.
- ^ Kreil G, Peptides containing a D-amino acid from frogs and molluscs, in J. Biol. Chem., vol. 269, n. 15, 15 aprile 1994, pp. 10967–70, PMID 8157620.
- ^ Heck SD, Faraci WS, Kelbaugh PR, Saccomano NA, Thadeio PF, Volkmann RA, Posttranslational amino acid epimerization: enzyme-catalyzed isomerization of amino acid residues in peptide chains, in Proc. Natl. Acad. Sci. U.S.A., vol. 93, n. 9, 1996, pp. 4036–9, DOI:10.1073/pnas.93.9.4036, PMC 39482, PMID 8633012.
- ^ Bogdanich W, Turning to Frogs for Illegal Aid in Horse Races, in New York Times, 19 giugno 2012. URL consultato il 19 giugno 2012.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su dermorfina