Ebolavirus
Il genere Ebolavirus, secondo la definizione dell'International Committee on Taxonomy of Viruses, è un raggruppamento di organismi che fa parte della famiglia Filoviridae, a sua volta parte dell'ordine dei Mononegavirales.[1][2] Gli Ebolavirus sono stati descritti per la prima volta dopo l'epidemia di febbre emorragica scoppiata nel sud del Sudan nel giugno 1976 e nello Zaire nell'agosto 1976.[3] Il genere è stato introdotto nel 1998 come "genere dei virus che somigliano al virus Ebola".[4][5]
| Ebolavirus | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Riboviria |
| Regno | Orthornavirae |
| Phylum | Negarnaviricota |
| Subphylum | Haploviricotina |
| Classe | Monjiviricetes |
| Ordine | Mononegavirales |
| Famiglia | Filoviridae |
| Genere | Ebolavirus |
| Serie tipo | |
| Zaire ebolavirus | |
| Specie | |
| Zaire ebolavirus Reston ebolavirus | |
Si conoscono sei specie appartenenti a questo genere (oltre ad alcune non classificate) e quattro di queste sono responsabili della malattia da virus Ebola (in inglese "ebola virus disease" o "EVD") che colpisce gli umani con una febbre emorragica con un tasso di letalità molto alto. Le cinque specie di virus riconosciute dall'International Committee on Taxonomy of Viruses prendono il nome dalle regioni dove sono state individuate per la prima volta.
Virologia
modificaMorfologia
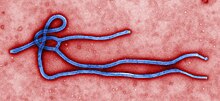
modificaL'indagine al microscopio elettronico delle specie appartenenti al genere Ebolavirus mostra la caratteristica struttura filamentosa dei filovirus.[6][7][8] La specie virus Ebola EBOV VP30 è costituita da una catena di 288 amminoacidi.[8] I virioni generalmente hanno una struttura tubolare variabile: possono assumere la forma di bastone pastorale, di occhiello, di U o di 6, arrotolata, circolare o ramificata.[7] Tuttavia le tecniche di laboratorio di purificazione come la centrifugazione potrebbero influenzarne l'aspetto morfologico.[8] I virioni misurano generalmente 80 nm di diametro.[6][7][8] Hanno misure variabili, tipicamente attorno ai 1000 nm, ma possono arrivare a 14000 nm di lunghezza.[6][7] Nel centro del virione è presente il nucleocapside, una struttura elicoidale[6] costituita dalla proteina del nucleocapside virale 30 (VP30), il quale contiene la proteina virale 35 (VP35), una molecola di RNA genomico virale legato alla nucleoproteina (NP) e infine la RNA polimerasi-RNA dipendente virale (L).[7] Il virione ha un diametro di 40-50 nm e un canale centrale di 20–30 nm di diametro. Una glicoproteina (GP) virale è presente sulla membrana virale, derivata dalla membrana cellulare ospite, ed è responsabile del riconoscimento della cellula bersaglio.[7] Tra la membrana e il nucleocapside a questa ancorata, all'interno della cosiddetta matrice, sono allocate le proteine virali VP40 e VP24.[7]
Genoma
modificaCiascun virione contiene una molecola lineare anti-senso di RNA, di circa 18.959 nucleotidi di lunghezza fino anche a 18.961, dal peso molecolare di 4,5 x 106 Da[6]. L'estremità 3′ non è poliadenilata, e 5′ è priva di cappuccio. È stato accertato che 472 nucleotidi a partire dal 3' UTR, e 731 nucleotidi dal 5' UTR sono sufficienti per la replicazione.[8] È in grado di codificare sette proteine strutturali ed una non strutturale. La regione codificante è 3′ - leader - NP - VP35 - VP40 - GP/sGP - VP30 - VP24 - L - trailer - 5′; leader e trailer essendo regioni non trascritte trasportano segnali importanti per il controllo della trascrizione, replicazione e assemblaggio del genoma virale nel nuovo virione. Il materiale genomico in sé non è infettivo a causa delle proteine virali, ma all'RNA polimerasi RNA dipendente, sono necessarie per la trascrizione del genoma virale nel mRNA, così come per la replicazione del genoma virale.
Ciclo vitale
modifica- I virus attaccano i recettori dell'ospite mediante il peplomero glicoproteico veicolandosi in vescicole per endocitosi nella cellula ospite.
- Fusione della membrana virale con la membrana vescicolare; il nucleocapside è rilasciato nel citoplasma.
- L'ssRNA anti-senso incapsidato è usato come stampo per la sintesi (3' - 5') di mRNA poliadenilato, monocistronico.
- Traduzione dell'mRNA nelle proteine virali utilizzando forse le strutture della cellula ospite.
- Processamento post-traduzionale delle proteine virali. Dal clivaggio di GP0 (precursore glicoproteico) derivano GP1 e GP2, che vengono abbondantemente glicosilate. L'assemblaggio di queste due molecole, prima in eterodimeri, e poi in trimeri costituisce la superficie del peplomero. Un precursore glicoproteico di secrezione subisce un clivaggio in SGP e delta peptide, entrambi i quali rilasciati dalla cellula.
- Con l'aumento del livello proteico virale, dalla traduzione si passa alla replicazione. Usando l'RNA anti-senso come stampo, è sintetizzato un +ssRNA complementare, usato come stampo ulteriore per la sintesi del nuovo (-) ssRNA genomico, rapidamente incapsidato.
- Il nucleocapside neoformato e le proteine envelope si associano alla membrana plasmatica della cellula ospite; il rilascio dei virioni avviene per gemmazione.
Riserve virali
modificaNonostante numerosi studi, la riserva naturale di Ebolavirus non è ancora stata identificata. Tra il 1976 e il 1998, nessun ebolavirus è stato riscontrato nelle 30.000 specie fra mammiferi, uccelli, rettili, anfibi ed artropodi prelevate nelle regioni colpite,[9] fatta eccezione per del materiale genetico ritrovato in sei roditori (Mus setulosus e specie Praomys) e in un toporagno (Sylvisorex ollula) reperito nella Repubblica Centrafricana nel 1998.[10] Ebolavirus furono scoperti in carcasse di gorilla, scimpanzé e gazzelle durante l'epidemia del 2001 e del 2003 (le carcasse erano la fonte dell'epidemia umana iniziale), ma l'elevata mortalità dell'infezione preclude a queste specie la possibilità di tramutarsi in riserva.[9]
Anche piante e uccelli sono stati considerati riserve virali; tuttavia, i pipistrelli sono considerati i candidati migliori.[11] Taluni pipistrelli erano noti per risiedere nella fabbrica di cotone nella quale i pazienti indiziati per le epidemie del 1976 e del 1979 lavoravano e che furono inoltre implicati nelle epidemie di Marburg nel 1975 e nel 1980.[9] Tra le 24 specie di piante e le 19 specie di vertebrati inoculati sperimentalmente con ebolavirus, solo nei pipistrelli si è verificata l'infezione.[12] L'assenza di segni clinici in questi pipistrelli è caratteristica delle specie-riserva. Nel 2002-03, un'indagine su 1.030 animali provenienti dal Gabon e dalla Repubblica del Congo che includeva 679 pipistrelli ha identificato RNA proveniente da ebolavirus in 13 di questi (Hypsignathus monstrosus, Epomops franqueti e Myonycteris torquata).[13] I pipistrelli sono anche noti per essere la riserva virale di numerosi virus come quello che causa il COVID-19 nipahvirus, hendravirus e lyssavirus. Di recente[quando?] è stato identificato[senza fonte] uno dei recettori sfruttato dal virus, TIM-1, che sarebbe importante per l'attacco ad alcune cellule epiteliali (possibili via d'ingresso del virus). Sembra che ebolavirus si siano sviluppati in alcune caverne del Kenya.[14].
Nel 2012 è stato scoperto in Cina il primo isolamento da pipistrelli del filovirus specie Reston a seguito di esami sierologici condotti in una popolazione di pipistrelli cinesi. La specie Reston ebolavirus, scoperta nelle Filippine, è l'unica specie di ebolavirus identificata in Asia fino ad oggi.[15] Inoltre, in 353 oranghi sani Borneo (Pongo pygmaeus) nell'isola Kalimantan in Indonesia, nel periodo dal dicembre 2005 al dicembre 2006, si è trovata una positività sierologica pari al 18,4% (65/353) e al 1,7% (6/353) dei campioni esaminati rispettivamente per EBOV (virus Ebola) e MARV (Marburg). La maggior parte dei sieri EBOV-positivi ha mostrato una somiglianza sierologica per le specie trovate in Zaire, Sudan, Costa d'Avorio, o per i virus Bundibugyo, che sono stati trovati finora solo in Africa. Gli autori della ricerca suggeriscono l'esistenza di molteplici specie di filovirus, o di virus sconosciuti correlati ai filovirus, in Indonesia, alcuni dei quali sono sierologicamente simili ai virus EBOV africani, indicando così una possibile presenza di serbatoi di virus non ancora identificati tra le popolazioni di orango indonesiane.[16]
La ricercatrice berlinese Gretchen Vogel, dello staff editoriale della rivista Science, pubblica sulla stessa l'11 aprile 2014 un editoriale dal titolo Are Bats Spreading Ebola Across Sub-Saharan Africa? (Sono i pipistrelli che diffondono il virus di Ebola in tutta l'Africa sub-sahariana?), suggerendo, con questo articolo, come la diffusione del virus metta a rischio le persone che vivono nelle aree boschive di tutta l'Africa sub-sahariana.[17]
Note tassonomiche
modificaIn base alle norme per la nomenclatura dei taxon definite dall'International Committee on Taxonomy of Viruses (ICTV) il nome del genere Ebolavirus va scritto sempre con iniziale maiuscola e in corsivo. Non va mai abbreviato e deve essere preceduto dalla parola "genere".
Nella terminologia inglese internazionale, quando si richiamano collettivamente i membri del genere, non si usa il maiuscolo, il corsivo e l'articolo (ebolaviruses).[2]
Il nome Ebolavirus deriva dal fiume Ebola nello Zaire (oggi Repubblica Democratica del Congo)[6], un tributario del fiume Congo dove avvenne l'epidemia del 1976, mentre il suffisso tassonomico -virus indica trattarsi di un genere virale.[2]
Nel 2002 il nome del genere venne cambiato in Ebolavirus[18][19] e nel 2010, il genere venne emendato di alcuni appartenenti.[2]
Classificazione
modificaLe specie sono:[1]
- Bombali ebolavirus (BOMV)
- Bundibugyo ebolavirus (BDBV)
- Reston ebolavirus (RESTV o REBOV)
- Sudan ebolavirus (SUDV o SEBOV)
- Tai Forest ebolavirus (TAFV) (originariamente Côte d'Ivoire ebolavirus)
- Zaire ebolavirus (EBOV o ZEBOV).
Criteri di inclusione
modificaUn virus della famiglia Filoviridae è un membro del genere Ebolavirus se:[2]
- il suo genoma ha svariate sovrapposizioni di geni
- il suo quarto gene (GP) codifica quattro proteine (sGP, ssGP, Δ-peptide e GP1,2) utilizzando un taglio co-trascrizionale per ottenere ssGP e GP1,2 e clivaggio proteolitico per ottenere sGP e Δ-peptide
- il picco di infettività dei suoi virioni è associato con particelle di ≈805 nm di lunghezza
- il suo genoma differisce da quello del Marburg virus per una quantità ≥50% e da quello del virus Ebola di una quantità <50% a livello nucleotide
- i suoi virioni non mostrano quasi resistenza incrociata antigenica con i virioni Marburg.
Specie comprese nel genere
modificaI microbiologi hanno descritto diverse specie di appartenenti al genere Ebolavirus.
Zaire ebolavirus (ZEBOV o EBOV)
modificaZaire ebolavirus è la specie di riferimento per il genere Ebolavirus ed è costituita da un solo ceppo noto, semplicemente chiamato "virus Ebola", ed una variante chiamata Zaire Ebolavirus Makona.[1]
Zaire ebolavirus è caratterizzato dal più alto tasso di letalità degli Ebolavirus ed è anche responsabile per il maggior numero di epidemie di Ebola attribuibili al genere, comprese l'epidemia di febbre emorragica di Ebola in Zaire del 1976 e l'epidemia di febbre emorragica di Ebola in Africa occidentale del 2014, che è quella che ha causato finora il maggior numero di vittime.
Questa specie ha il tasso più elevato di mortalità: oltre il 90%, con una media approssimativa dell'83% in 27 anni. Gli indici di mortalità erano dell'88% nel 1976, 100% nel 1977, 59% nel 1994, 81% nel 1995, 73% nel 1996, 80% nel 2001-2002 e 90% nel 2003.
La prima epidemia A è avvenuta il 26 agosto, 1976, a Yambuku, una città a nord dello Zaire. Il primo caso registrato fu un insegnante di 44 anni, Mabalo Lokela, che era di ritorno da un viaggio nel nord dello stato. La sua febbre era altissima e gli fu inizialmente diagnosticata la malaria, quindi gli fu somministrato del chinino. Lokela si recava in ospedale ogni giorno; una settimana dopo i suoi sintomi comprendevano vomito incontrollabile, feci diarroiche miste a sangue, cefalea, vertigini, problemi respiratori. Più tardi cominciò a sanguinare dal naso, dalla bocca e dall'ano. Lokela morì l'8 settembre del 1976, circa 14 giorni dopo la comparsa dei sintomi. Successivamente, numerosi pazienti mostrarono sintomi analoghi come febbre, cefalea, dolori muscolo-scheletrici, stanchezza, nausea e vertigini fino a mostrare i sintomi finali del primo paziente colpito. Inizialmente si pensò che la diffusione virale fosse dovuta all'uso ripetuto degli aghi non sterili utilizzati per Lokela. Successivamente si pensò anche allo scarso rispetto dei protocolli di sicurezza nell'assistenza dei pazienti colpiti da malattie infettive e ai riti funebri tradizionali che prevedono, prima della sepoltura, il lavaggio del tratto gastrointestinale. Due infermiere che lavoravano a Yambuku morirono nella medesima epidemia.[20] Tale variante del virus sembra quella che ha scatenato nella primavera 2014 la nuova epidemia in Guinea[21].
Sudan ebolavirus (SEBOV o SUDV)
modificaLa specie Sudan ebolavirus fu la seconda ad essere scoperta, evento accaduto nel corso dell'anno 1976. Apparentemente sembrava originarsi tra i lavoratori del cotone della città di Nzara, in Sudan. Il primo caso riportato fu quello di un lavoratore esposto probabilmente ad una riserva virale naturale nell'azienda cotoniera. I ricercatori testarono ogni animale ed insetto per comprovare l'ipotesi, tuttavia nessuno risultò positivo al virus. Il portatore è tuttora sconosciuto. Il secondo caso coinvolse il proprietario di un nightclub a Nzara, Sudan. L'ospedale locale, Maridi, sperimentò un tentativo per curare il paziente che risultò inutile. L'ospedale, comunque, non sostenne alcuna procedura di sicurezza nella disinfezione e sterilizzazione dello strumentario utilizzato sul paziente, facilitando il contagio nel nosocomio. L'epidemia più recente di Sudan ebolavirus è stata nel maggio del 2004. 20 casi di Sudan ebolavirus furono registrati a Yambio, nel Sudan, con cinque decessi. Il Centro per il controllo e prevenzione delle malattie confermò la presenza del virus qualche giorno dopo. I paesi confinanti come l'Uganda e la Repubblica Democratica del Congo hanno incrementato la sorveglianza dei confini per il controllo dell'epidemia. Il tasso di mortalità per il Sudan ebolavirus è stato del 54% nel 1976, 68% nel 1979 e 53% nel 2000/2001. La media si aggira intorno al 54%.
Reston ebolavirus
modificaLa specie Reston ebolavirus è sospettata di essere sia una specie del genere Ebolavirus, che un nuovo tipo di filovirus di origine asiatica. Fu scoperta in una specie di macaco nei Laboratori Hazleton (ora Covance) nel 1989. Questa scoperta attirò l'attenzione dei media e portò alla pubblicazione del libro The Hot Zone (Area di contagio di Richard Preston). Nonostante lo stato di pericolosità biologica (livello 4), la specie Reston ebolavirus non è patologica per gli esseri umani ed è solo mediamente mortale per le scimmie;[22] la percezione della mortalità del virus fu alterata da una coinfezione di scimmie con il Simian virus(SHFV).[23]
Nel corso della scoperta, sei tecnici che maneggiavano gli animali divennero sieropositivi - uno di loro si tagliò mentre stava praticando una necroscopia sul fegato di una scimmia infetta. Il tecnico non si ammalò di febbre emorragica e gli studiosi conclusero che il virus avesse una bassa patogenicità negli uomini.[24] Altre scimmie colpite dalla specie Reston ebolavirus furono spedite nuovamente a Reston e ad Alice, nel Texas, nel febbraio 1990. Altri casi di Reston ebolavirus presente in scimmie infette furono scoperti a Siena, nel 1992 e ancora in Texas nel marzo 1996.
Tai ebolavirus o (Costa d'Avorio ebolavirus)
modificaQuesta specie del genere Ebolavirus fu inizialmente scoperta tra gli scimpanzé della foresta Tai in Costa d'Avorio. Il 1º novembre 1994, i cadaveri di due scimpanzé furono trovati nella foresta. L'autopsia mostrò che nel cuore vi era del sangue fluido e marrone, nessun segno evidente sugli organi e, inoltre, anche i polmoni erano ripieni di sangue molto fluido. Studi sui tessuti mostrarono risultati simili ai casi umani riportati durante l'epidemia di virus Ebola nel 1976 avvenuta in Zaïre e in Sudan. Successivamente nel 1994, furono scoperti altri cadaveri di scimpanzé positivi al virus Ebola esaminati mediante tecniche molecolari. Si suppose che la fonte del contagio fosse la carne infetta di scimmie del tipo Red Colobus, che venivano predate dagli scimpanzé.[25]
Una degli scienziati che effettuò l'autopsia sugli scimpanzé infetti contrasse la malattia da virus Ebola e sviluppò sintomi simili alla febbre dengue, approssimativamente una settimana dopo l'autopsia; fu trasportata in Svizzera per una terapia. Dopo due settimane fu dimessa dall'ospedale e si riprese completamente a distanza di sei settimane dall'infezione.
Bundibugyo ebolavirus
modificaIl 24 novembre, 2007, il Ministero Ugandese per la Sanità confermò un'epidemia di ebola nel distretto di Bundibugyo. In seguito, tramite l'esame di campioni effettuati da laboratori statunitensi, dal Centro di Controllo per le Malattie e dall'Organizzazione mondiale della sanità (OMS), si ebbe la conferma della presenza di una nuova specie del genere Ebolavirus. Il 20 febbraio 2008, il Ministero ugandese ufficialmente annunciò la fine dell'epidemia di Bundibugyo con l'ultima persona infettata dimessa l'8 gennaio 2008.[26] Funzionari ugandesi confermarono un totale di 149 casi di questo nuova specie di ebolavirus, responsabile di 37 decessi.[27]
Patologie da Ebolavirus
modificaI virus di questo genere si trasmettono attraverso il contatto con i fluidi biologici di un infettato, umano o primate,[7] anche durante il suo periodo di incubazione (30 giorni prima dei sintomi); sarebbe quindi teoricamente possibile contrarre uno di questi virus toccando il sudore, anche depositato, di una persona malata, anche se è una probabilità piuttosto remota.
Malattia da virus Ebola
modificaL'infezione da virus Ebola porta a sviluppare una febbre emorragica. I sintomi di questa condizione sono variabili e compaiono improvvisamente. La sintomatologia iniziale comprende febbre alta (almeno 38,8 °C), cefalea, mialgia, artralgia, dolori addominali, astenia, faringite, nausea e vertigini.[28] Il virus progressivamente causa sintomi di più grave entità, come diarrea, feci scure o sanguinolente, vomito scuro dall'aspetto a "fondo di caffè", occhi rossi dilatati con presenza di aree emorragiche sulla sclera, petecchie, rash maculopapulare e porpora. Altri sintomi secondari includono ipotensione, ipovolemia, tachicardia, danni agli organi (soprattutto a reni, milza e fegato) come risultato di una necrosi sistemica disseminata e proteinuria. L'emorragia interna è causata da una reazione tra il virus e le piastrine che dà luogo a varie rotture nelle pareti dei vasi capillari. Occasionalmente si presentano sanguinamenti interni o emorragie esterne orali e nasali.
La malattia da virus Ebola è di difficile diagnosi nei primi giorni a causa dei sintomi non specifici, e generalmente una diagnosticata clinica deve essere confermata tramite test ELISA (Enzyme-Linked ImmunoSorbent Assay) per la ricerca di antigeni virali,[7] che tuttavia fornisce risultati ambigui durante le fasi non epidemiche. Vengono anche utilizzati saggi di RT-PCR, per amplificare l'RNA virale e ridurre la manipolazione dei campioni,[6] e saggi di rilevazione di anticorpi specifici IgG e IgM[7], tramite test ELISA o immunofluorescenza[6]. Può essere necessaria, per isolare il virus, l'inoculazione in animali.[6] L'intervallo tra insorgenza dei sintomi e morte è intorno ai 7-14 giorni. A partire dalla seconda settimana di infezione si assiste ad una riduzione dell'iperpiressia o all'innescarsi di una sindrome da disfunzione multiorgano. Il tasso di mortalità è alto, tra il 50 e il 90%.[28] Le cause principali di morte sono lo shock ipovolemico e la sindrome da disfunzione multiorgano.[29]
Tra gli esseri umani, il virus viene trasmesso mediante il contatto diretto con i fluidi corporei infetti (anche il sudore naturalmente sempre presente sulla pelle), oppure, in minor proporzione, per via epidermica o per contatto con le membrane mucose. Il periodo di incubazione può variare dai 2 ai 21 giorni, ma generalmente è di una settimana[7].
Le infezioni di ebolavirus su pazienti umani sono state documentate in casi di contatto con scimpanzé infetti, gorilla e antilopi della foresta, avvenuti in Costa d'Avorio, nella repubblica congolese e in Gabon. Anche la trasmissione virale del tipo Reston ebolavirus è stata registrata a causa del contatto con scimmie cynomolgus (Macaca fascicularis).[28] I pipistrelli sono considerati il serbatoio naturale più probabile dei virus appartenenti al genere Ebolavirus.[30] In passato sono state prese in considerazione anche piante, artropodi e uccelli. I pipistrelli erano noti occupanti della fabbrica di cotone in cui sono stati riscontrati i primi casi nei focolai epidemici del 1976 e 1979, e sono stati anche implicati nelle infezioni da virus Marburg nel 1975 e nel 1980.[31]
È piuttosto improbabile che gli appartenenti al genere Ebolavirus possano svilupparsi con caratteristiche pandemiche a livello mondiale, per via della loro difficoltà a diffondersi per via aerea e a causa del lasso di tempo in cui questi virus assumono caratteristiche contagiose atte alla diffusione, in confronto ad altre malattie infettive. Inoltre, l'instaurarsi di sintomi precoci dal momento in cui la malattia diviene contagiosa rende remota l'eventualità che un individuo colpito sia in grado di effettuare viaggi permettendo lo spostamento del contagio. Poiché i cadaveri sono infetti, alcuni medici adottano misure preventive affinché le sepolture avvengano in sicurezza contrariamente ai rituali funebri tradizionali diffusi in quelle aree.[32]
Al 2014 non esiste un protocollo standardizzato di trattamento per la malattia da virus Ebola. La terapia primaria è unicamente di supporto e comprende procedure invasive ridotte al minimo: bilancio degli elettroliti, poiché i pazienti sono frequentemente disidratati, ripristino dei fattori di coagulazione per arrestare il sanguinamento, mantenimento dei parametri ematici e di ossigenazione, trattamento delle complicanze infettive. La Ribavirina è inefficace. Anche l'Interferone non pare dare risultati. Nelle scimmie, la somministrazione di un inibitore dell'emocoagulazione (rNAPc2) ha mostrato qualche beneficio, preservando il 33% degli animali infettati da una infezione al 100% letale per le scimmie (sfortunatamente, questa terapia è inefficace sugli umani). Agli inizi del 2006, studiosi dell'Istituto di ricerca medica sulle malattie infettive dell'esercito degli Stati Uniti annunciarono il 75% delle guarigioni in scimmie rhesus infettate con ebolavirus a cui era stata somministrata terapia antisenso.[33]
Bioterrorismo
modificaPotenzialmente questi virus potrebbero essere utilizzati come arma biologica: come agenti di bioterrorismo, per l'alta mortalità e la mancanza di terapie adeguate, questi virus sono classificati di categoria A, agente di rischio biologico di livello 4.[34][35]
L'efficacia come agente di guerra biologica dei virus di questo genere è tuttavia compromessa proprio dall'elevata mortalità e dal livello di contagio: un'epidemia tipica potrebbe diffondersi attraverso un piccolo villaggio o ospedale, contagiando l'intera comunità senza poter trovare altri ospiti potenziali, morendo quindi prima di raggiungere una comunità più ampia. Inoltre il 12 Novembre 2019, l'OMS ha approvato il primo vaccino contro il virus Ebola: il vaccino VSV-ZEBOV.
Gli ebolavirus sono stati presi in considerazione dai membri della setta giapponese Aum Shinrikyō, il cui leader Shōkō Asahara inviò circa 40 membri in Zaire nel 1992, i quali si finsero desiderosi di fornire supporto medico alle vittime dell'ebola, presumibilmente nel tentativo di acquisire un campione virale con finalità terroristiche.[36]
Nella cultura di massa
modificaI virus di Ebola e Marburg sono stati una generosa fonte di idee e soggetti per spettacoli e opere di vario genere della cultura di massa e nella narrativa di genere.
Cinema
modifica- Virus letale (Outbreak) (1995)
- Contagio (Virus) (1995) Film TV
- Yi boh laai beng duk (1996)
- Plague Fighters (1996) Film TV
- E-bola (2015)
Nel film Virus letale, il virus descritto, dal nome fittizio "Motaba", è strettamente ispirato ai virus africani, tanto più che Motaba è il nome di un tratto di fiume che alimenta il fiume Ebola.[37] Anche i sintomi e l'area dell'infezione sono pertinenti.
Videogiochi
modifica- Nel videogioco Resident Evil, il Virus T è una versione modificata del Virus Progenitore, creato modificando geneticamente il virus ebola.[38] Nel 2009, con l'uscita del videogioco Resident Evil 5 parte della storia di Resident Evil è stata modificata e il Virus Progenitore è diventato un virus trovato all'interno di alcuni fiori e quindi non più un virus creato modificando geneticamente il virus ebola (il progenitor deriva da un fiore, incrociando il progenitor con Ebolavirus si ottiene il T-virus).
- In Tomb Raider - La culla della vita rappresenta un'arma biologica[39] che consiste in una forma di ebola molto potenziata, capace di provocare la morte in pochi minuti.
- Nel videogioco Trauma Team si manifesta un'epidemia di un virus chiamato "Rosalia", i cui effetti sono molto simili a quelli del virus ebola.
Narrativa di genere
modifica- Nel romanzo Contagio di Robin Cook, il virus ebola è usato come una possibile arma, con intento criminale.
- Nel romanzo Nel bianco di Ken Follett, una variante del virus ebola, dal nome Madoba-2, viene rubata, con intento criminale, da un laboratorio di ricerca in Scozia.
- La guerra biologica con virus di ebola modificati, trasportati per via aerea, è stata un tema centrale nei romanzi di Tom Clancy Potere esecutivo e Rainbow Six. In quest'ultimo l'autore inserisce una variante più aggressiva del virus ebola denominato "Shiva" creato artificialmente in laboratorio ed in grado di diffondersi per via aerea.
- Il virus Reston è il soggetto del libro di Richard Preston, The Hot Zone: Area di contagio. Ha anche portato allo sviluppo del film Virus letale (1995). Nel 2019 il National Geographic ha realizzato la miniserie televisiva "The Hot Zone - Area di contagio" basata sull'omonimo romanzo di Richard Preston.
Musica
modifica- Ebola(la la) di Rucka Rucka Ali.
Note
modifica- ^ a b c Taxonomy browser (Ebolavirus), su ncbi.nlm.nih.gov. URL consultato il 17 marzo 2020.
- ^ a b c d e DOI: 10.1007/s00705-010-0814-x
- ^ Copia archiviata (PDF), su whqlibdoc.who.int. URL consultato l'11 febbraio 2015 (archiviato dall'url originale il 13 ottobre 2014).
- ^ S. V. Netesov, H. Feldmann, P. B. Jahrling, H. D. Klenk e A. Sanchez, Family Filoviridae, in van Regenmortel M. H. V., Fauquet C. M., Bishop D. H. L., Carstens E. B., Estes M. K., Lemon S. M., Maniloff J., Mayo M. A., McGeoch D. J., Pringle C. R. e Wickner R. B. (a cura di), Virus Taxonomy—Seventh Report of the International Committee on Taxonomy of Viruses, San Diego, USA, Academic Press, 2000, pp. 539–48, ISBN 0-12-370200-3.
- ^ C. R. Pringle, Virus taxonomy-San Diego 1998, in Archives of Virology, vol. 143, n. 7, 1998, pp. 1449–59, DOI:10.1007/s007050050389, ISSN 0304-8608.
- ^ a b c d e f g h i Murray, Rosenthal, Pfaller.
- ^ a b c d e f g h i j k Antonelli et al.
- ^ a b c d e Hans-Dieter Klenk e Heinz Feldmann, Ebola and Marburg Viruses, Molecular and Cellular Biology, Wymondham, Norfolk, Horizon Bioscience, 2004, ISBN 0-9545232-3-7.
- ^ a b c Pourrut X et al., The natural history of Ebola virus in Africa, in Microbes Infect., vol. 7, n. 7-8, 2005, pp. 1005–14, DOI:10.1016/j.micinf.2005.04.006, PMID 16002313.
- ^ Morvan JM et al., Identification of Ebola virus sequences present as RNA or DNA in organs of terrestrial small mammals of the Central African Republic, in Microbes Infect., vol. 1, n. 14, 1999, pp. 1193–201, DOI:10.1016/S1286-4579(99)00242-7, PMID 10580275.
- ^ Fruit bats may carry Ebola virus, in BBC News, 11 dicembre 2005. URL consultato il 25 febbraio 2008.
- ^ Swanepoel R et al., Experimental inoculation of plants and animals with Ebola virus, in Emerging Infect. Dis., vol. 2, n. 4, 1996, pp. 321–5, PMID 8969248.
- ^ Leroy EM et al., Fruit bats as reservoirs of Ebola virus, in Nature, vol. 438, n. 7068, 2005, pp. 575–6, DOI:10.1038/438575a, PMID 16319873.
- ^ Focus n.223, maggio 2011, p.116
- ^ J. Yuan, Y. Zhang, J. Li, Y. Zhang, LF. Wang e Z. Shi, Serological evidence of ebolavirus infection in bats, China., in Virol J, vol. 9, 2012, p. 236, DOI:10.1186/1743-422X-9-236, PMID 23062147.
- ^ CA. Nidom, E. Nakayama; RV. Nidom; MY. Alamudi; S. Daulay; IN. Dharmayanti; YP. Dachlan; M. Amin; M. Igarashi; H. Miyamoto; R. Yoshida, Serological evidence of Ebola virus infection in Indonesian orangutans., in PLoS One, vol. 7, n. 7, 2012, pp. e40740, DOI:10.1371/journal.pone.0040740, PMID 22815803.
- ^ Are Bats Spreading Ebola Across Sub-Saharan Africa?, su sciencemag.org. URL consultato il 13 aprile 2014.
- ^ H. Feldmann, T. W. Geisbert, P. B. Jahrling, H.-D. Klenk, S. V. Netesov, C. J. Peters, A. Sanchez, R. Swanepoel e V. E. Volchkov, Family Filoviridae, in Fauquet C. M., Mayo M. A., Maniloff J., Desselberger U. e Ball L. A. (a cura di), Virus Taxonomy—Eighth Report of the International Committee on Taxonomy of Viruses, San Diego, USA, Elsevier/Academic Press, 2005, pp. 645–653, ISBN 0-12-370200-3.
- ^ M. A. Mayo, ICTV at the Paris ICV: results of the plenary session and the binomial ballot, in Archives of Virology, vol. 147, n. 11, 2002, pp. 2254–60, DOI:10.1007/s007050200052.
- ^ Margaretha Isaacson et al., Two Belgian nurses died of Ebola (archiviato dall'url originale l'11 dicembre 2008).
- ^ Outbreak of Ebola in Guinea | Ebola | CDC
- ^ Level 4: Virus Hunters of the CDC (1999), p.300. citazione: "Mentre è vero che dovremmo essere molto confortati dal fatto che il virus di Reston non è patologico per l'uomo - non fa ammalare nessuno - c'è ancora la minaccia di un'ulteriore specie nelle scimmie importato da chissà dove, che potrebbe essere dannosa per l'uomo."
- ^ Level 4: Virus Hunters of the CDC (1999), ppgs.307-309.
- ^ Level 4: Virus Hunters of the CDC (1999), ppgs.298-299.
- ^ Ebola Cote d'Ivoire Outbreaks, su virus.stanford.edu. URL consultato l'8 ottobre 2008 (archiviato dall'url originale il 16 febbraio 2008).
- ^ End of Ebola outbreak in Uganda, su who.int, Organizzazione mondiale della sanità, 20 febbraio 2008.
- ^ Tim Cocks, Uganda confirms 113 suspected Ebola cases, Reuters, 11 dicembre 2007. URL consultato il 25 febbraio 2008 (archiviato dall'url originale il 23 febbraio 2008).
- ^ a b c WHO Fact Sheet Ebola haemorrhagic fever
- ^ Bray M e Geisbert TW, Ebola virus: the role of macrophages and dendritic cells in the pathogenesis of Ebola hemorrhagic fever, in Int. J. Biochem. Cell Biol., vol. 37, n. 8, 2005, pp. 1560–6, DOI:10.1016/j.biocel.2005.02.018, PMID 15896665.
- ^ Fruit bats may carry Ebola virus, su news.bbc.co.uk, BBC News, 1º dicembre 2005. URL consultato il 20 agosto 2014.
- ^ Pourrut X, Kumulungui B, Wittmann T, Moussavou G, Délicat A, Yaba P, Nkoghe D, Gonzalez JP e Leroy EM, The natural history of Ebola virus in Africa, in Microbes Infect., vol. 7, n. 7-8, giugno 2005, pp. 1005–14, DOI:10.1016/j.micinf.2005.04.006, PMID 16002313.
- ^ Blaine Harden, Dr. Matthew's Passion, in The New York Times Magazine, 18 febbraio 2001. URL consultato il 25 febbraio 2008.
- ^ USAMRIID press release (PDF), su usamriid.army.mil (archiviato dall'url originale il 6 agosto 2012).
- ^ Borio L et al., Hemorrhagic fever viruses as biological weapons: medical and public health management, in JAMA, vol. 287, n. 18, 2002, pp. 2391–405, PMID 11988060.
- ^ Hoenen T, Groseth A, Falzarano D e Feldmann H, Ebola virus: unravelling pathogenesis to combat a deadly disease, in Trends Mol Med, vol. 12, n. 5, 2006, pp. 206–15, DOI:10.1016/j.molmed.2006.03.006, PMID 16616875.
- ^ Chronology of Aum Shinrikyo's CBW Activities (PDF), Monterey Institute for International Studies (archiviato dall'url originale il 26 novembre 2011).
- ^ Articolo su Corriere della Sera.it
- ^ Capcom.co.jp "Wesker's Report II", su www3.capcom.co.jp. URL consultato il 12 aprile 2008 (archiviato dall'url originale l'11 aprile 2008).
- ^ (EN) Lara Croft Tomb Raider: The Cradle of Life su jesusfreakhideout.com
Bibliografia
modifica- Joseph B. McCormick, Susan Fisher-Hoch e Leslie Alan Horvitz, Level 4: Virus Hunters of the CDC, 2ª ed., New York, Barnes & Noble, 1999 [1996], ISBN 978-0-7607-1208-5.
- Richard Preston, The Hot Zone, A Terrifying True Story, New York, Anchor Books (Random House), Sagebrush Education Resources, Tandem Library Books, 1994, ISBN 0-385-47956-5.
- Tara Waterman, Ebola Reston Outbreak Standford Honors Thesis, su stanford.edu, Stanford University, 1999. URL consultato il 2 agosto 2008.
- G. Antonelli, M. Clementi, G. Pozzi e G. M. Rossolini, 62, in Principi di microbiologia medica, 2ª ed., Rozzano (MI), Casa Editrice Ambrosiana, 2012 [2008], p. 326, ISBN 978-88-08-18073-5.
- Patrick R. Murray, Ken S. Rosenthal e Michael A. Pfaller, 58, in Paolo Di Francesco et al. (a cura di), Microbiologia medica, 7ª ed., Milano, Edra LSWR, 2013 [1990], pp. 549-551, ISBN 978-88-214-3714-4.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Ebolavirus
- Wikispecies contiene informazioni su Ebolavirus
Collegamenti esterni
modifica- FILOVIR Archiviato il 30 luglio 2020 in Internet Archive. - scientific resources for research on filoviruses
- Database entry on genus Ebolavirus - ICTVdB
- WHO Factsheet - retrieved 10 July 2006
- (EN) Ebola and Marburg fevers, su ecdc.europa.eu, Centro europeo per la prevenzione e il controllo delle malattie.
- Vaccine Research Center (VRC) - Informazioni relative alle ricerche per un vaccino sull'Ebola
- Biomarker Database Archiviato il 22 aprile 2008 in Internet Archive. - informazioni sull'Ebola
Contagiosità
modifica- U.S. Army Medical Research Institute of Infectious Diseases: Gene-Specific Ebola Therapies Protect Nonhuman Primates from Lethal Disease (PDF), su usamriid.army.mil. URL consultato l'8 ottobre 2008 (archiviato dall'url originale il 9 giugno 2007).
- Jaax NK et al., Lethal experimental infection of rhesus monkeys with Ebola-Zaire (Mayinga) virus by the oral and conjunctival route of exposure, in Arch. Pathol. Lab. Med., vol. 120, n. 2, 1996, pp. 140–55, PMID 8712894.
- Johnson E, Jaax N, White J e Jahrling P, Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus, in Int J Exp Pathol, vol. 76, n. 4, 1995, pp. 227–36, PMID 7547435.
- Leffel EK e Reed DS, Marburg and Ebola viruses as aerosol threats, in Biosecur Bioterror, vol. 2, n. 3, 2004, pp. 186–91, PMID 15588056.
- Salvaggio MR e Baddley JW, Other viral bioweapons: Ebola and Marburg hemorrhagic fever, in Dermatol Clin, vol. 22, n. 3, 2004, pp. 291–302, vi, DOI:10.1016/j.det.2004.03.003, PMID 15207310.
- Jaax N et al., Transmission of Ebola virus (Zaire strain) to uninfected control monkeys in a biocontainment laboratory, in Lancet, vol. 346, n. 8991-8992, 1995, pp. 1669–71, PMID 8551825.
- (EN) Brett Russel, What is the probability of a dangerous strain of Ebola mutating and becoming airborne?, su brettrussell.com. URL consultato il 10 luglio 2006 (archiviato dall'url originale il 15 aprile 2008).
| Controllo di autorità | GND (DE) 4233551-6 |
|---|
