Estere di Hagemann
L'estere di Hagemann è un estere che oltre alla funzione estere possiede anche una funzione chetonica. Il composto è usato in chimica organica per la sintesi di varie sostanze naturali, come steroli e terpeni.[3]
| Estere di Hagemann | |
|---|---|
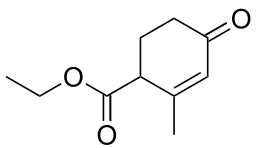 | |
| Nome IUPAC | |
| 2-metil-4-osso-2-cicloesen-1-carbossilato di etile | |
| Nomi alternativi | |
| estere di Hagemann | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H14O3 |
| Massa molecolare (u) | 182,22 |
| Aspetto | liquido limpido giallo scuro[1] |
| Numero CAS | |
| Numero EINECS | 207-657-4 |
| PubChem | 79020 |
| SMILES | CCOC(=O)C1CCC(=O)C=C1C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,078[1] |
| Temperatura di ebollizione | 268–272 °C (541–545 K)[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 113 °C[1] |
| Frasi H | -- |
| Consigli P | --[1][2] |
Storia
modificaLa sintesi del composto fu pubblicata per la prima volta nel 1893 dal chimico tedesco Carl Hagemann. La sintesi originale partiva da acetoacetato di etile e diiodometano.[4] L'anno successivo Emil Knoevenagel pubblicò una sintesi differente e chiarì la struttura del composto. In seguito furono sviluppati ulteriori metodi di sintesi e nacque la denominazione estere di Hagemann.[5]
Sintesi
modificaEsistono vari metodi per sintetizzare il composto.[3] Una descrizione schematica delle procedure è la seguente:
- Metodo di Hagemann. Due equivalenti di acetoacetato di etile 1 e un equivalente di diiodometano vengono fatti reagire in presenza di metossido di sodio per formare l'estere dietilico dell'acido 2,4-diacetilpentanoico 2. Quest'ultimo viene poi ciclizzato 3 con idrossido di sodio per arrivare infine all'estere di Hagemann 4.[4]
- Metodo di Knoevenagel. La procedura è simile al metodo di Hagemann. Due equivalenti di acetoacetato di etile 1 sono fatti condensare con un equivalente di formaldeide in presenza di quantità catalitiche di piperidina per ottenere 2. Segue ciclizzazione 3 per arrivare infine all'estere di Hagemann 4.[6]
- Metodo di Mannich e Fourneau. Viene usato lo ioduro di dietil-metil-(3-osso-butil)-ammonio come precursore del metil vinil chetone 1, da far reagire con acetoacetato di etile 2 per ottenere l'intermedio 3, che poi ciclizza con metossido di sodio per arrivare all'estere di Hagemann 4.[7]
- Metodo di Newman e Lloyd. Il 2-metossi-1,3-butadiene 1 e il 2-butinoato di etile 2 vengono fatti reagire in una reazione di Diels-Alder; il prodotto della reazione 3 viene quindi idrolizzato ottenendo l'estere di Hagemann 4.[8] Variando i sostituenti sul butinoato di partenza si possono ottenere derivati dell'estere di Hagemann con differenti sostituenti alchilici sull'anello.[3]
Usi
modificaL'estere di Hagemann è stato usato come building block in molte sintesi.[3] Alcuni esempi sono i seguenti:
- L'estere di Hagemann è stato alchilato per ottenere un intermedio chiave per la sintesi dell'acido trisporico, un feromone terpenoide presente in alcune specie di funghi.[9]
- È stato usato in reazioni di Diels-Alder inverse electron demand per ottenere dimeri di sesquiterpeni.[10]
- Derivati dell'estere di Hagemann sono stati usati per la sintesi di triazoli[11][12] e fenoli.[13]
Note
modifica- ^ a b c d e Sigma-Aldrich 2024
- ^ Sostanza non pericolosa secondo la regolamentazione (CE) N. 1272/2008.
- ^ a b c d Pollini et al. 2010
- ^ a b Hagemann 1893
- ^ Eiden 2007
- ^ Knoevenagel 1894
- ^ Mannich e Fourneau 1938
- ^ Newman e Lloyd 1952
- ^ White e Sung 1974
- ^ Yang et al. 2014
- ^ Lima et al. 2015
- ^ John et al. 2015
- ^ Ramachary e Jain 2011
Bibliografia
modifica- (DE) F. Eiden, Carl Hagemann ...ein Mensch von großer Güte, ein richtiger Chemiker...., in Chemie in unserer Zeit, vol. 41, n. 4, 2007, pp. 316-323, DOI:10.1002/ciuz.200700411.
- (DE) C. Th. L. Hagemann, Ueber die Einwirkung von Methylenjodid auf Natracetessigäther, in Ber. dtsch. Chem. Ges., vol. 26, n. 1, 1893, pp. 876-890, DOI:10.1002/cber.189302601181.
- (EN) J. John, J. Thomas e W. Dehaen, Organocatalytic routes toward substituted 1,2,3-triazoles, in Chem. Commun., vol. 51, 2015, pp. 10797-10806, DOI:10.1039/C5CC02319J.
- (DE) E. Knoevenagel, 1,5-Diketone, in Liebigs Ann., vol. 281, n. 1, 1894, pp. 25–126, DOI:10.1002/jlac.18942810104.
- (EN) C. G. S. Lima, A. Ali, S. S. van Berkel, B. Westermann e M. W. Paixão, Emerging approaches for the synthesis of triazoles: beyond metal-catalyzed and strain-promoted azide–alkyne cycloaddition, in Chem. Commun., vol. 51, 2015, pp. 10784-10796, DOI:10.1039/C5CC04114G.
- (DE) C. Mannich e J.-P. Fourneau, Über die Bildung von Benzolderivaten aus Dimethylamino-butanon and Malonester bwz. Acetessigester, in Ber. dtsch. Chem. Ges., vol. 71, n. 10, 1938, pp. 2090–2092, DOI:10.1002/cber.19380711016.
- (EN) M. S. Newman e H. A. Lloyd, Diels-Alder Reactions of 2-Methoxy-1,3-Butadiene, in J. Org. Chem., vol. 17, n. 4, 1952, pp. 577–580, DOI:10.1021/jo01138a010.
- (EN) G.P. Pollini, S. Benetti, C. De Risi e V. Zanirato, Hagemann's ester: a timeless building block for natural product synthesis, in Tetrahedron, vol. 66, n. 15, 2010, pp. 2775-2802, DOI:10.1016/j.tet.2010.01.078.
- (EN) D. B. Ramachary e S. Jain, Sequential one-pot combination of multi-component and multi-catalysis cascade reactions: an emerging technology in organic synthesis, in Org. Biomol. Chem., vol. 9, 2011, pp. 1277-1300, DOI:10.1039/C0OB00611D.
- Sigma-Aldrich, Scheda di dati di sicurezza di Ethyl 2-methyl-4-oxo-2-cyclohexenecarboxylate, su sigmaaldrich.com, 2024. URL consultato il 28 novembre 2024.
- (EN) J. D. White e W. L. Sung, Alkylation of Hagemann's ester. Preparation of an intermediate for trisporic acid synthesis, in J. Org. Chem., vol. 39, n. 16, 1974, pp. 2323–2328, DOI:10.1021/jo00930a001.
- (EN) L. Yang, G. Yue, C. Yuan, B. Du e altri, Synthetic Studies toward Lindenane-Type Sesquiterpenoid Dimers, in Synlett, vol. 25, n. 17, 2014, pp. 2471-2474, DOI:10.1055/s-0034-1379001.