Etere diisopropilico
L'etere diisopropilico (o etere isopropilico) è un composto chimico appartenente alla classe degli eteri alifatici; è un etere simmetrico, isomero dell'etere dipropilico.
| Etere diisopropilico | |
|---|---|
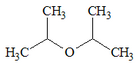 | |
| Nomi alternativi | |
| etere isopropilico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | [(CH3)2CH]2O |
| Massa molecolare (u) | 102,18 g/mol |
| Aspetto | liquido incolore dall'odore pungente simile al limone |
| Numero CAS | |
| Numero EINECS | 203-560-6 |
| PubChem | 7914 |
| SMILES | CC(C)OC(C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,72 (20 °C) |
| Solubilità in acqua | 12 g/l (20 °C) |
| Temperatura di fusione | −86 °C (187 K) |
| Temperatura di ebollizione | 67 °C (340 K) (1013 hPa) |
| Indicazioni di sicurezza | |
| Punto di fiamma | −28 °C (245 K) (c.c.) |
| Limiti di esplosione | 1,0 - 21 Vol% |
| Temperatura di autoignizione | 405 °C (678 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 225 - 336 - EUH019 - EUH066 |
| Consigli P | 210 - 233 - 204 - 241 - 242 - 243 [1][2] |
A temperatura ambiente si presenta come un liquido incolore volatile e molto infiammabile, dall'odore etereo un po' spiccato e miscibile con tutti i comuni solventi organici. In acqua è meno solubile dell'etere dietilico (0,2 g/100 mL a 20 °C contro 6,05 g/100 mL a 25 °C) e, parallelamente, ha un maggiore coefficiente di ripartizione 1-ottanolo/acqua (log Pow = 2,00[3] contro 0,87[4]) e ciò a volte è un vantaggio nelle estrazioni di miscele di reazione in mezzi acquosi o loro emulsioni. Rispetto al comune etere la molecola è leggermente meno polare (μ = 1,13 D[3] contro 1,15 D) e il liquido, di costante dielettrica similmente bassa (4,0 e 4,3), non è così tanto volatile (Teb. = 67 °C contro 34 °C). Come altri eteri, può formare perossidi esplosivi. È talvolta indicato con l'abbreviazione "DIPE".
Può essere utilizzato come solvente per l'estrazione di acido lattico in seguito alla sua produzione per via biotecnologica.
È ottenuto industrialmente come sottoprodotto nella produzione di isopropanolo mediante idratazione del propene.[5][6]
Usi
modificaMentre a 20 °C, l'etere dietilico scioglie l'1% in peso di acqua, l'etere diisopropilico ne scioglie solo lo 0,88%. È usato come solvente specializzato per rimuovere o estrarre composti organici polari da soluzioni acquose, ad es. fenoli, etanolo, acido acetico. È stato usato come agente antidetonante.
Sicurezza
modificaL'etere diisopropilico può formare perossidi esplosivi stando in aria per lunghi periodi. Questa reazione procede più facilmente rispetto all'etere etilico, a causa del carbonio secondario vicino all'atomo di ossigeno. Possono essere utilizzati antiossidanti per prevenire questo processo. Il solvente immagazzinato deve quindi essere testato per la presenza di perossidi più spesso (raccomandato una volta ogni 3 mesi rispetto a una volta ogni 12 per l'etere etilico[7]). I perossidi possono essere rimossi agitando l'etere con una soluzione acquosa di solfato ferroso o metabisolfito di sodio.[8][9] Per motivi di sicurezza, il metil ter-butil etere viene spesso utilizzato come solvente alternativo.
Note
modifica- ^ scheda della sostanza su GESTIS
- ^ Smaltire in accordo alle leggi vigenti.
- ^ a b diisopropyl ether, su stenutz.eu. URL consultato il 31 luglio 2020.
- ^ diethyl ether, su stenutz.eu. URL consultato il 31 luglio 2020.
- ^ (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.a10_023.pub2.
- ^ (EN) Michael Sakuth, Thomas Mensing e Joachim Schuler, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 15 aprile 2010, pp. a10_023.pub2, DOI:10.1002/14356007.a10_023.pub2, ISBN 978-3-527-30673-2. URL consultato il 31 luglio 2020.
- ^ http://www.ccohs.ca/oshanswers/chemicals/organic/organic_peroxide.html
- ^ Chai, Christina Li Lin e Armarego, W. L. F., Purification of laboratory chemicals, Oxford, Butterworth-Heinemann, 2003, pp. 176, ISBN 978-0-7506-7571-0.
- ^ A. C. Hamstead, Destroying Peroxides of Isopropyl Ether, in Industrial and Engineering Chemistry, vol. 56, 1964, p. 37-42, DOI:10.1021/ie50654a005.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Etere diisopropilico