Fluoruro di mercurio(I)
Il fluoruro di mercurio(I) è il composto inorganico di formula Hg2F2. In condizioni normali è un solido cristallino giallo, che diventa nero per esposizione alla luce.[1] In questo composto il mercurio è nello stato di ossidazione +1.
| Fluoruro di mercurio(I) | |
|---|---|
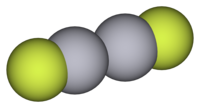 | |
 | |
| Nomi alternativi | |
| fluoruro mercuroso | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Hg2F2 |
| Massa molecolare (u) | 439,177 |
| Aspetto | solido cristallino giallo |
| Numero CAS | |
| Numero EINECS | 237-747-9 |
| PubChem | 4084556, 44717570, 6098378 e 90478886 |
| SMILES | F[Hg].F[Hg] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 8,73 |
| Solubilità in acqua | idrolizza |
| Temperatura di fusione | >570 °C (>843 K) dec |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −485 |
| ΔfG0 (kJ·mol−1) | −469 |
| S0m(J·K−1mol−1) | 161 |
| C0p,m(J·K−1mol−1) | 100,4 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 300+310+330 - 373 - 410 |
| Consigli P | 260 - 264 - 273 - 280 - 284 - 310+310 |
Struttura
modificaCome tutti gli altri alogenuri di Hg(I), anche Hg2F2 contiene lo ione Hg22+ ed è composto da unità lineari F–Hg–Hg–F. La distanza di legame Hg–Hg risulta di 251 pm, più corta della distanza Hg–Hg di 300 pm che si riscontra nel mercurio metallico. La distanza F–Hg è di 214 pm.[2]
Sintesi
modificaHg2F2 si prepara facendo reagire il carbonato di mercurio(I), Hg2CO3 con acido fluoridrico acquoso:[3]
Reattività
modificaIn acqua il fluoruro di mercurio(I) è solubile, ma si idrolizza rapidamente e disproporziona formando mercurio elementare, ossido mercurico (HgO) e acido fluoridrico (HF). Gli altri alogenuri di mercurio(I) sono invece insolubili in acqua. Per riscaldamento il fluoruro di mercurio(I) disproporziona formando mercurio metallico e fluoruro di mercurio(II) (HgF2).[4]
Usi
modificaIl fluoruro di mercurio(I) non ha applicazioni significative. Si può usare nella reazione di Swarts per convertire gli alogenuri alchilici in fluoruri alchilici:[5]
Indicazioni di sicurezza
modificaIl fluoruro di mercurio(I) è disponibile in commercio. Il composto è fortemente tossico per inalazione, per ingestione e per contatto con la pelle. È fortemente tossico anche per gli organismi acquatici, con effetti negativi a lungo termine per l'ambiente acquatico.[6]
Note
modifica- ^ Perry e Sidney 1995
- ^ Wells 1984
- ^ Brauer 1965, p. 243.
- ^ Greenwood e Earnshaw (1997), p. 1212.
- ^ Beyer et al. 1997
- ^ Scheda di dati di sicurezza Sigma-Aldrich
Bibliografia
modifica- (EN) H. Beyer, W. Walter e D. Lloyd, Organic Chemistry, Horwood Publishing, 1997, ISBN 1-898563-37-3.
- (EN) G. Brauer (a cura di), Handbook of Preparative Inorganic Chemistry, vol. 1, New York, Academic Press, 1965.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) D.L. Perry e L. Sidney, Handbook of Inorganic Compounds, Boca Raton, CRC Press, 1995, ISBN 0-8493-8671-3.
- (EN) A.F. Wells, Structural Inorganic Chemistry, 5ª ed., Oxford, Oxford Science Publications, 1984, ISBN 0-19-855370-6.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Fluoruro di mercurio(I)