IC50
IC50 o concentrazione inibente è la concentrazione di un inibitore enzimatico (farmaco, tossina o veleno, ecc.) necessaria per inibire in vitro il 50% del bersaglio in esame (processo o componente biologico: enzima, cellula, recettore o microrganismo).[1] I valori dell'IC50 sono tipicamente espressi con la concentrazione molare.
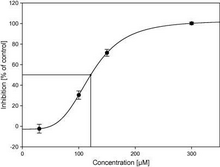
L'IC50 è perciò un parametro utilizzato per valutare l'efficacia di una sostanza nell'inibire il target ed è uno dei metodi comunemente usati nella ricerca farmacologica per misurare la potenza di un antagonista.
Nella ricerca farmacologica, l'IC50 (concentrazione inibitoria del 50%) è comunemente usato come misura della potenza di un farmaco antagonista. L'IC50 è paragonabile ad altre misure di potenza, come l'EC50 (concentrazione efficace del 50%) per i farmaci eccitatori. Infatti, l'EC50 rappresenta la dose o la concentrazione plasmatica necessaria per ottenere il 50% di un effetto massimo in vivo.[1]
L'IC50 non è un indicatore diretto dell'affinità chimica, sebbene i due possano essere correlati almeno per quanto concerne i ligandi agonisti e antagonisti di tipo competitivo, mediante l'equazione di Cheng-Prusoff.[2]
A volte, i valori dell'IC50 sono convertiti nella scala pIC50:
A causa del segno meno, valori più alti di pIC 50 indicano inibitori esponenzialmente più potenti. Il pIC 50 è solitamente espresso in termini di concentrazione molare (mol/L o M), e quindi richiede che l'IC50 sia espresso in unità di M.[3]
L'IC50 è utilizzato anche per alcune misure comportamentali in vivo.[4]
L'IC50 è espresso secondo la seguente formula (1):
dove:
- Ki è l'affinita di legame dell'inibitore
- Km è la costante di Michaelis-Menten
L'IC50 di un farmaco può essere determinato costruendo una curva dose-risposta ed esaminando l'effetto di diverse concentrazioni di antagonista sull'inversione dell'attività dell'agonista. Per un dato antagonista, i valori di IC50 possono essere calcolati determinando la concentrazione necessaria per inibire la metà della risposta biologica massima dell'agonista.[5] I valori di IC50 possono essere utilizzati per confrontare la potenza di due antagonisti.
I valori di IC50 dipendono molto dalle condizioni in cui vengono misurati. In generale, una maggiore concentrazione di inibitore porta a una minore attività dell'agonista. Il valore di IC50 aumenta all'aumentare della concentrazione dell'agonista. Inoltre, a seconda del tipo di inibizione, altri fattori possono influenzare il valore della misura; per gli enzimi dipendenti dall'ATP, il valore di IC50 ha un'interdipendenza con la concentrazione di ATP, soprattutto se l'inibizione è di tipo competitivo.[senza fonte]
IC50 e affinità
modificaEquazione di Cheng-Prusoff
modificaIn termini equivalenti e più formali della formula (1), l'equazione di Cheng-Prusoff per le reazioni enzimatiche è:
- dove:
- Ki è l'affinità chimica dell'inibitore;
- IC50 è la resistenza funzionale dell'inibitore;
- [S] è la concentrazione fissa di substrato;
- Km è la costante di Michelis-Menten, cioè la concentrazione di substrato alla quale l'attività enzimatica è pari a metà del massimo (ma è spesso confusa con l'affinità del substrato per l'enzima, che è cosa differente).
In alternativa, per le costanti di inibizione ai recettori cellulari:[6]
- dove:
- [A] è la concentrazione fissa dell'agonista;
- EC50 è la concentrazione dell'agonista che si traduce in un'attivazione del recettore al 50%. Mentre il valore IC50 di un composto può variare tra un esperimento e l'altro a seconda delle condizioni sperimentali (ad esempio, concentrazione del substrato e dell'enzima), il Ki è un valore assoluto. Il Ki è la costante di inibizione di un farmaco, ovvero, in un test competitivo, la concentrazione del ligando concorrente che occuperebbe il 50% dei recettori se non fosse presente alcun ligando.[7]
L'equazione di Cheng-Prusoff produce buone stime ad alte concentrazioni di agonisti, mentre non è una buona approssimazione (sovrastima o sottostima) Ki per basse concentrazioni di agonisti. In queste condizioni, sono state raccomandate altre analisi.[6]
Affinità competitiva
modificaIn questo tipo di analisi, in ogni provetta viene utilizzata una singola concentrazione di radioligando (di solito un agonista). Il ligando viene utilizzato a bassa concentrazione, di solito pari o inferiore al suo valore Kd. Il livello di legame specifico del radioligando viene quindi determinato in presenza di una serie di concentrazioni di altri composti non radioattivi concorrenti (solitamente antagonisti), al fine di misurare la potenza con cui competono per il legame del radioligando. Le curve di competizione possono anche essere adattate al computer a una funzione logistica come descritto nel fitting diretto.
In questo caso, l'IC50 è la concentrazione del ligando concorrente che sposta il 50% del legame specifico del radioligando. Il valore IC50 viene convertito in una costante di inibizione assoluta Ki utilizzando l'equazione di Cheng-Prusoff formulata da Yung-Chi Cheng e William Prusoff (vedi Ki).[5][7]
Note
modifica- ^ a b IC50 versus EC50, su fda.gov, Slotervaart Hospital.
- ^ Cheng Y, Prusoff WH, Relationship between the inhibition constant (K1) and the concentration of inhibitor which causes 50 per cent inhibition (I50) of an enzymatic reaction, in Biochemical Pharmacology, vol. 22, n. 23, dicembre 1973, pp. 3099–108, DOI:10.1016/0006-2952(73)90196-2.
- ^ Stewart MJ, Watson ID, Standard units for expressing drug concentrations in biological fluids, in British Journal of Clinical Pharmacology, vol. 16, n. 1, luglio 1983, pp. 3–7, DOI:10.1111/j.1365-2125.1983.tb02136.x.
- ^ Robinson SF, Marks MJ, Collins AC, Inbred mouse strains vary in oral self-selection of nicotine, in Psychopharmacology, vol. 124, n. 4, aprile 1996, pp. 332–9, DOI:10.1007/bf02247438.
- ^ a b Assay Operations for SAR Support, in Assay Guidance Manual, Eli Lilly & Company and the National Center for Advancing Translational Sciences, novembre 2017.
- ^ a b Lazareno S, Birdsall NJ, Estimation of competitive antagonist affinity from functional inhibition curves using the Gaddum, Schild and Cheng-Prusoff equations, in British Journal of Pharmacology, vol. 109, n. 4, agosto 1993, pp. 1110–9, DOI:10.1111/j.1476-5381.1993.tb13737.x.
- ^ a b Receptor binding techniques: competition (inhibition or displacement) assays, in Pharmacology Guide, Glaxo Wellcome.

![{\displaystyle {\mathit {IC}}_{50}=\left[1+{\frac {[\mathrm {Substrato} ]}{K_{\mathrm {m} }}}\right]\times K_{\mathrm {i} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b07a9f2ec4f0740a63d4263a99863ab02f11f171)