Legame a tre centri e due elettroni
Il legame a tre centri e due elettroni, o legame 3c-2e, è un legame chimico dove tre atomi sono legati unicamente da un orbitale molecolare delocalizzato su questi tre atomi, contenente due elettroni. Questo legame è interpretabile solo utilizzando la teoria degli orbitali molecolari. Semplificando, si considera che l'interazione di tre orbitali atomici (uno per ciascuno degli atomi partecipanti) formi tre orbitali molecolari: uno legante, uno non legante e uno antilegante. I due elettroni occupano l'orbitale legante, producendo il legame chimico tra i tre atomi. Il concetto di legame a tre centri e due elettroni è stato introdotto nel 1949 da Christopher Longuet-Higgins e successivamente sviluppato da William Lipscomb.[1] Dal punto di vista geometrico, il legame 3c-2e non è lineare (salvo eccezioni); per confronto il legame a tre centri e quattro elettroni (3c-4e) è invece lineare.[2]
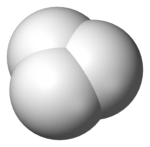
Il caso più semplice di specie contenente un legame 3c-2e è rappresentato dal catione idrogenonio (H3+), che ha la forma di un triangolo equilatero.
Legami 3c-2e sono molto comuni soprattutto nei borani, dove si osservano sia legami con un idrogeno a ponte tra due atomi di boro (indicati come B–H–B) sia legami centrali fra tre atomi di boro (indicati come BBB).
-
Schema di legame a ponte B–H–B
-
Schema di legame centrale BBB
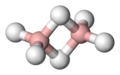
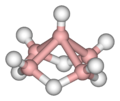
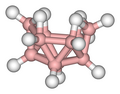
Alcuni esempi sono illustrati nella successiva galleria. Il B2H6 contiene due legami B–H–B; il B5H9 e il B10H14 sono esempi di borani contenenti legami sia B–H–B che BBB. Altri casi ben noti di legami 3c-2e si riscontrano nel trimetilalluminio e nel trietilalluminio, che hanno struttura e legami simili a quelli del diborano.
-
B2H6
-
B5H9
-
B10H14
-
Trimetilalluminio
La denominazione di legame a tre centri e due elettroni è per lo più utilizzata nei campi della chimica inorganica e della chimica organometallica. Legami simili esistono anche nella chimica organica, ma i composti organici che contengono questo tipo di legami sono in genere piuttosto instabili.[3] Ad esempio, i carbocationi danno luogo a riarrangiamenti che passano attraverso stati di transizione a tre centri.
Note
modificaBibliografia
modifica- R. L. DeKock e W. B. Bosma, The three-center, two-electron chemical bond, in J. Chem. Educ., vol. 65, n. 3, 1988, pp. 194-197, DOI:10.1021/ed065p194. URL consultato il 23 gennaio 2012.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- J. E. McMurry e T. Lectka, Three-Center,Two-Electron C-H-C Bonds in Organic Chemistry, in Acc. Chem. Res., vol. 25, n. 1, 1992, pp. 47-53, DOI:10.1021/ar00013a007. URL consultato il 23 gennaio 2012.
Collegamenti esterni
modifica- (EN) two-electron bond three-centre / three-centre bond, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.