Tubercolosi
La tubercolosi (in sigla TBC) è una malattia infettiva causata da vari ceppi di micobatteri, soprattutto dal Mycobacterium tuberculosis, chiamato anche bacillo di Koch.[1]
| Tubercolosi | |
|---|---|
 | |
| Specialità | infettivologia e pneumologia |
| Eziologia | Mycobacterium tuberculosis |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 010 e 018 |
| ICD-10 | A15-A19 |
| OMIM | 607948 |
| MeSH | D014376 |
| MedlinePlus | 000077 e 000624 |
| eMedicine | 230802 |
| Sinonimi | |
| TBC Poriformalicosi Tisi | |
Considerata fino alla metà del XX secolo una grave malattia, invalidante e alla lunga mortale se non tempestivamente diagnosticata e curata, divenuta oggi nei paesi occidentali più facilmente diagnosticabile e curabile, la tubercolosi attacca solitamente i polmoni (tubercolosi polmonare), ma può colpire anche altre parti del corpo (tubercolosi extrapolmonare). Si trasmette per via aerea attraverso goccioline di saliva emesse con la tosse secca.[2] La maggior parte delle infezioni che colpiscono gli esseri umani risulta essere asintomatica, cioè si ha un'infezione latente. Circa 1/10 delle infezioni latenti alla fine progredisce in malattia attiva che, se non trattata, uccide più del 50% delle persone infette.
I sintomi classici sono una tosse cronica con espettorato striato di sangue, febbre di rado elevata, sudorazione notturna e perdita di peso. L'infezione di altri organi provoca una vasta gamma di sintomi. La diagnosi si basa sull'esame radiologico (comunemente una radiografia del torace), un test cutaneo alla tubercolina, esami del sangue e l'esame microscopico e coltura microbiologica dei fluidi corporei. Il trattamento può essere talvolta difficile e richiedere l'assunzione di antibiotici multipli per qualche tempo. La resistenza agli antibiotici è un problema crescente nell'affrontare la malattia. La prevenzione si basa su programmi di screening e di vaccinazione con il bacillo di Calmette-Guérin.
Si ritiene che un terzo della popolazione mondiale sia stata infettata con M. tuberculosis,[3][4] e nuove infezioni avvengono ad un ritmo di circa una al secondo.[3] Nel 2007 vi erano circa 13,7 milioni di casi cronici attivi[5] e nel 2010 8,8 milioni di nuovi casi e 1,45 milioni di decessi, soprattutto nei paesi in via di sviluppo.[6] Il numero assoluto di casi di tubercolosi è in calo dal 2006 e di nuovi casi dal 2002.[6] Inoltre, le popolazioni dei paesi in via di sviluppo contraggono la tubercolosi più facilmente, poiché hanno spesso un sistema immunitario più compromesso a causa degli alti tassi di AIDS.[7] La distribuzione della tubercolosi non è uniforme in tutto il mondo: circa l'80% della popolazione residente in molti paesi asiatici e africani risulta positiva nei test alla tubercolina, mentre solo il 5-10% della popolazione degli Stati Uniti ne è affetta.[1]
Storia
modificaLa tubercolosi è stata presente negli umani sin dall'antichità. La prima scoperta certa del Mycobacterium tuberculosis è nei resti di un bisonte di circa 18.000 anni fa.[8] Tuttavia se la tubercolosi abbia avuto origine nel bestiame e sia mutato trasmettendosi agli umani, o se sia derivato da un antenato comune non è ancora chiaro.[9] Resti scheletrici mostrano che gli uomini preistorici avevano la tubercolosi già nel 4000 a.C., e tracce di decadimento dovuto alla tubercolosi sono state ritrovate nella spina dorsale di alcune mummie del 3000-2400 a.C.[10] Phthisis è un termine greco per indicare la tubercolosi, dal quale sarebbe poi derivato il termine odierno tisi; attorno al 460 a.C., Ippocrate aveva identificato la tisi come la più diffusa malattia di tutti i tempi, causa di febbre ed emottisi, quasi sempre fatale.[11] Studi genetici suggeriscono che la tubercolosi fosse presente in Sudamerica da circa 2000 anni.[12] In Sudamerica, la prima prova della presenza di tubercolosi è associata alla cultura Paracas (dal 750 a.C. al 100 d.C. circa).[13]
Lo studio della tubercolosi risale a Il canone della medicina scritto da Avicenna nel X secolo. Fu il primo medico a identificare la tubercolosi polmonare come una malattia infettiva, il primo a riconoscerne l'associazione col diabete ed il primo a suggerire che si potesse diffondere attraverso il contatto con il suolo e l'acqua.[14][15] Sviluppò inoltre il metodo della quarantena per limitare la diffusione della tubercolosi.[16]
Nonostante fosse già stabilito dal dottor Richard Morton nel 1689 che la forma polmonare era associata con dei tubercoli,[17][18] a causa della varietà dei suoi sintomi, la tubercolosi non venne identificata come una singola malattia fino al 1820 circa, e non venne chiamata tubercolosi fino al 1839 da Johann Lukas Schönlein[19] Durante gli anni 1838-1845, il dottor John Croghan, proprietario della Mammoth Cave, portò un gruppo di infetti di tubercolosi nella caverna sperando di curarli dalla malattia con la sua temperatura costante e la purezza dell'aria; morirono tutti nel giro di un anno.[20] Il primo sanatorio per la tubercolosi aprì nel 1859 a Görbersdorf, all'epoca in Germania (oggi Sokołowsko e compresa nel territorio polacco), di proprietà di Hermann Brehmer.[21]
Riguardo a questa dichiarazione, il Times del 15 gennaio 1859 mise a pagina 5 una pubblicità in cui si cercavano fondi per il Bournemouth Sanatorium per la consunzione, facendo riferimento al bilancio dell'anno precedente e offrendo un resoconto annuale ai possibili donatori, implicando che l'esistenza di questo sanatorio risalirebbe perlomeno al 1858.
Il batterio che causa la tubercolosi, Mycobacterium tuberculosis, venne identificato e descritto il 24 marzo 1882 da Robert Koch. Questi ricevette il Premio Nobel per la medicina nel 1905 per la scoperta.[22] Koch non credeva che la tubercolosi bovina (del bestiame) e quella umana fossero simili, il che ritardò il riconoscimento del latte infetto come fonte di infezione. Più tardi questa fonte venne eliminata dal processo di pastorizzazione. Koch annunciò un estratto in glicerina del batterio della tubercolosi come "rimedio" per la tubercolosi nel 1890, chiamandolo tubercolina. Non era efficace, ma venne adottato in seguito come test per la tubercolosi pre-sintomatica.[23]
Il primo vero successo nell'immunizzazione contro la tubercolosi venne sviluppato da un ceppo attenuato di tubercolosi bovina da Albert Calmette e Camille Guérin ottenuto attraverso una serie di passaggi in terreno di coltura durati molti anni a partire dal 1908[24]. Era chiamato "BCG" (Bacillo Calmette-Guérin). Il vaccino BCG venne utilizzato per la prima volta sugli umani nel 1921 in Francia,[25] ma solo dopo la seconda guerra mondiale ricevette un ampio consenso negli Stati Uniti, nel Regno Unito e in Germania.[26]
La tubercolosi, o "consunzione" come veniva comunemente chiamata, causò la maggior preoccupazione pubblica nel XIX e inizi del XX secolo come malattia endemica del ceto povero. Nel 1815, una morte su quattro in Inghilterra era causata dalla consunzione; entro il 1918 una morte su sei in Francia era ancora causata dalla tubercolosi. Nel XX secolo la tubercolosi ha ucciso circa 100 milioni di persone.[27] Dopo la certezza nel 1880 che la malattia era contagiosa, la tubercolosi venne resa in Gran Bretagna una malattia "con obbligo di notifica", cioè una malattia che deve essere portata a conoscenza delle autorità competenti; vennero diffuse campagne contro lo sputare in luoghi pubblici, e gli infetti vennero "incoraggiati" a entrare in sanatori che ricordavano prigioni; i sanatori per le classi medio-alte offrivano eccellenti cure e una costante osservazione medica.[21] Qualunque fossero i supposti benefici dell'aria fresca e del lavoro manuale nei sanatori, persino sotto le migliori condizioni, il 50% delle persone entrate morirono entro cinque anni (1916).[21]
La promozione di francobolli natalizi iniziò in Danimarca durante il 1904 come mezzo per raccogliere fondi per programmi contro la tubercolosi. Essa si estese agli Stati Uniti e al Canada nel 1907-1908 per aiutare l'Associazione Nazionale della Tubercolosi (rinominata in seguito Associazione Americana dei Polmoni).
Negli Stati Uniti la preoccupazione della diffusione della tubercolosi giocò un ruolo nel movimento per proibire lo sputare in pubblico, salvo usare le sputacchiere.
In Europa le morti da tubercolosi crollarono da 500 ogni 100.000 casi nel 1850 a 50 ogni 100.000 casi nel 1950. Miglioramenti nella salute pubblica ridussero la tubercolosi ancor prima dell'arrivo degli antibiotici, anche se la malattia rimase una considerevole minaccia alla salute pubblica, tanto che quando il Medical Research Council (consiglio medico della ricerca) venne formato nel Regno Unito nel 1913, il suo scopo principale era la ricerca sulla tubercolosi.[28]
Non fu che dopo il 1946, con lo sviluppo dell'antibiotico streptomicina, che un trattamento efficace e una cura divennero possibili. Prima dell'introduzione di questa medicina, l'unico trattamento oltre ai sanatori erano gli interventi chirurgici, compreso la tecnica dello pneumotorace, in cui si faceva collassare un polmone infetto per farlo "riposare" e permettere la guarigione delle lesioni, e che risultò di minimo beneficio, tanto che venne interrotta a partire dal 1950.[29] L'emergere di tubercolosi multiresistente ha introdotto di nuovo l'operazione chirurgica come parte del trattamento per queste infezioni. La rimozione delle cavità del torace riduce il numero di batteri nei polmoni, e incrementa l'esposizione dei restanti batteri al flusso sanguigno, provocando in teoria un incremento dell'efficacia della chemioterapia.[30]
La speranza che la malattia potesse essere definitivamente sconfitta è stata schiacciata dall'insorgenza di ceppi resistenti agli antibiotici negli anni ottanta. Per esempio, i casi nella Gran Bretagna di tubercolosi, attorno ai 117.000 nel 1913, erano crollati a circa 5.000 nel 1987, ma sono risaliti, raggiungendo i 6.300 casi nel 2000 e i 7.600 casi nel 2005.[31] A causa dell'eliminazione delle strutture di salute pubblica a New York e all'emergere dell'HIV, un ritorno della malattia è avvenuto negli anni ottanta.[32] Il numero di coloro che non riescono a completare il ciclo di farmaci è elevato. New York ha avuto a che fare con più di 20.000 pazienti tubercolosi "non necessari" con ceppi multiresistenti (resistenti, perlomeno, a Rifampicina e Isoniazide). Il risorgere della tubercolosi ha causato la dichiarazione dello stato di emergenza globale della salute pubblica da parte della Organizzazione Mondiale della Sanità nel 1993.[33]
Epidemiologia
modificaSecondo l'Organizzazione Mondiale della Sanità, circa due miliardi di persone, cioè un terzo della popolazione mondiale, sono stati esposti al patogeno della tubercolosi.[35] Annualmente 8 milioni di persone si ammalano di tubercolosi, e 2 milioni muoiono a causa della malattia in tutto il mondo.[36] Nel 2004, circa 14,6 milioni di persone avevano la tubercolosi attiva, con 9 milioni di nuovi casi. Il tasso di incidenza annuale varia da 356 ogni 100.000 abitanti in Africa a 41 ogni 100.000 abitanti in America.[3] La tubercolosi è l'infezione più grave del mondo per numero di morti di donne in età riproduttiva e la causa di morte principale nelle persone affette da HIV o AIDS.[37]
Nel 2005, il paese con l'incidenza più elevata di tubercolosi era lo Swaziland, con 1262 casi ogni 100.000 persone. L'India ha il più elevato numero di infezioni, con oltre 1,8 milioni di casi.[38] Nei paesi sviluppati la tubercolosi è molto meno diffusa, ed è principalmente una malattia urbana. Nel Regno Unito, l'incidenza di tubercolosi varia da 40 persone infette ogni 100.000 abitanti a Londra a meno di 5 ogni 100.000 abitanti nel Sudovest rurale dell'Inghilterra;[39] la media nazionale è 13 ogni 100.000 abitanti. Il tasso più alto nell'Europa occidentale è in Portogallo (42 ogni 100.000) e Spagna (20 ogni 100.000). Queste incidenze vanno confrontate con i 113 abitanti infetti ogni 100.000 in Cina e i 64 ogni 100.000 in Brasile. Negli Stati Uniti l'incidenza media era di 4,9 abitanti ogni 100.000 nel 2004.[36]
Nel 2011, nei 27 Stati membri dell'Unione europea e dell'SSE vi sono stati 72.334 casi di tubercolosi (14,2 per 100.000 abitanti), il 4% in meno rispetto al 2010. L'80% di questi casi sono state nuove diagnosi, mentre il 23% era di origine straniera. In Italia, nel 2008, si sono registrati 4418 casi, con una diminuzione del 2,4% dall'anno precedente.[41]
L'incidenza della tubercolosi varia con l'età. in Africa, la tubercolosi colpisce prevalentemente gli adolescenti e i giovani adulti.[42] Tuttavia, nei paesi dove la tubercolosi è passata da alta a bassa incidenza, come negli Stati Uniti, la tubercolosi è prevalentemente una malattia delle persone anziane.[43]
Ci sono vari fattori noti che rendono le persone più suscettibili all'infezione tubercolare: nel mondo la causa maggiore è l'HIV. La co-infezione con l'HIV della tubercolosi è un problema soprattutto nell'Africa subsahariana, a causa dell'alto numero di persone infette da HIV di queste nazioni.[34][44] Fumare oltre 20 sigarette al giorno incrementa il rischio di tubercolosi da due a quattro volte.[45][46] Il diabete mellito è anch'esso un fattore di rischio importante e in costante crescita di importanza nei paesi sviluppati.[47]
Nel 2004 le statistiche di mortalità e morbosità mostravano 14,6 milioni di casi attivi, 8,9 milioni di casi nuovi e 1,6 milioni di morti, concentrati soprattutto nei paesi in via di sviluppo.[3] Inoltre, un sempre crescente numero di persone nei paesi sviluppati contraggono la tubercolosi poiché il loro sistema immunitario è compromesso da sostanze immunosuppressive, abuso di droga o HIV/AIDS.
L'aumento delle infezioni di HIV e la mancanza di programmi di controllo della tubercolosi hanno permesso la ricomparsa della tubercolosi.[48] L'emergere di ceppi resistenti agli antibiotici ha a sua volta contribuito a questa nuova epidemia, con il 20% dei casi di tubercolosi resistenti ai trattamenti standard e il 2% resistenti a farmaci di seconda linea.[49] L'incidenza di tubercolosi varia notevolmente anche tra stati confinanti, apparentemente a causa delle differenze tra le varie assistenze sanitarie.[50] L'Organizzazione mondiale della sanità ha dichiarato la tubercolosi un'emergenza sanitaria globale nel 1993, e la Stop TB Partnership ha sviluppato un "Piano mondiale di lotta alla Tubercolosi" che prevede di salvare 14 milioni di vite tra il 2006 e il 2015.[51]
Eziologia
modificaL'agente eziologico principale della tubercolosi, il Mycobacterium tuberculosis (MTB), è un batterio aerobiotico che si divide ogni 16-20 ore, una velocità estremamente lenta in confronto ad altri batteri, che solitamente si dividono in meno di un'ora (uno dei più veloci batteri a replicarsi è un ceppo del batterio Escherichia coli, che si divide circa ogni 20 minuti).[52] Poiché l'MTB ha una parete cellulare, ma non una membrana esterna, viene classificato come un batterio Gram-positivo. Tuttavia, se viene applicata una colorazione di Gram, l'MTB risulta o Gram-positivo in modo estremamente debole, o non mantiene la colorazione, a causa dell'elevato contenuto di lipidi e acido micolico della sua parete cellulare.[53] L'MTB è un piccolo bacillus a forma di bastoncello, che può resistere a deboli disinfettanti e sopravvivere in uno stato disidratato per settimane. In natura, il batterio può crescere solo all'interno delle cellule di un organismo ospite, ma l'MTB può essere coltivato in vitro.[54]
Usando pigmenti istologici su campioni di espettorato, gli scienziati possono identificare l'MTB con un normale microscopio. Poiché l'MTB conserva certi pigmenti dopo essere stato trattato con soluzioni acide, viene classificato come un bacillus acido-alcolico.[53] La tecnica di pigmentazione più comune, la colorazione di Ziehl-Neelsen, tinge i bacilli acido-alcolici di un rosso acceso che risalta chiaramente su sfondo blu. Altri metodi per evidenziare questi bacilli sono la colorazione con auramina-rodamina e l'osservazione mediante microscopio a fluorescenza.
Il complesso MTB include tre micobatteri causa di tubercolosi: Mycobacterium bovis, Mycobacterium africanum e Mycobacterium microti. I primi due causano la malattia in persone immunocompetenti solo in casi rarissimi. Tuttavia, nonostante il M. microti non sia normalmente patogenico, è possibile che la prevalenza di infezioni da esso causate sia stata sottovalutata.[55]
Altri micobatteri patogenici conosciuti comprendono Mycobacterium leprae, Mycobacterium avium complex e Mycobacterium kansasii. Gli ultimi due fanno parte del gruppo di micobatteri non tubercolari (MOTT, mycobacteria other than tuberculosis). I micobatteri non tubercolari non causano tubercolosi o lebbra, ma provocano malattie polmonari simili alla tubercolosi.[56]
Patogenesi
modificaCirca il 90% delle persone infette dal Mycobacterium tuberculosis ha un'infezione tubercolosi asintomatica (chiamata anche LTBI, da latent tuberculsis infection), e solamente il 10% di possibilità nella vita che un'infezione latente si sviluppi in tubercolosi. Tuttavia, se non trattata, il tasso di mortalità dei casi attivi di tubercolosi è superiore al 50%.[57]
L'infezione tubercolare inizia quando i micobatteri raggiungono gli alveoli polmonari, dove attaccano e si replicano all'interno dei macrofagi alveolari.[58] Il sito primario di infezione nei polmoni è chiamato focolaio di Ghon. I batteri vengono raccolti dalle cellule dendritiche, che non permettono la loro replicazione ma che possono trasportare i bacilli ai linfonodi mediastinici locali. L'ulteriore diffusione attraverso il flusso sanguigno si dirige verso i tessuti e gli organi più distanti, dove lesioni secondarie di tubercolosi si possono sviluppare negli apici polmonari, nei linfonodi periferici, nei reni, nel cervello e nelle ossa.[59] Ogni parte del corpo può essere influenzata dalla malattia, che tuttavia molto raramente colpisce il cuore, i muscoli scheletrici, il pancreas e la tiroide.[60]
La tubercolosi è classificata come una delle condizioni infiammatorie granulomatose. Macrofagi, linfociti T, linfociti B e fibroblasti sono le cellule aggredite che formano il granuloma, con i linfociti che circondano i macrofagi infetti. Il granuloma non solo impedisce la diffusione dei micobatteri, ma fornisce un ambiente locale per la comunicazione delle cellule del sistema immunitario. Dentro al granuloma, i linfociti T (CD4+) producono citochine come l'interferone gamma, che provoca un tentativo di distruzione da parte dei macrofagi dei batteri fagocitati, senza però riscontri significativi, dal momento che i Mycobacterium tuberculosis sono batteri Catalasi positivi (resistenti quindi agli enzimi killer dei polimorfonucleati)[61] I linfociti T (CD8+) possono anche uccidere direttamente le cellule infette.[58] L'intera infezione tubercolare ruota attorno a questo delicato bilancio immunitario: una maggiore risposta Th1 riuscirà a contenere il batterio nei granulomi, mentre una preponderanza della risposta Th2 produrrà più noduli batterici multiplici e ne consentirà la diffusione in tutto l'organismo. L'innata cronicità della malattia fa sì che questo spesso non si verifichi subito, bensì aspetti particolari momenti di stress immunitario o di immunodepressione per riattivarsi ed evolversi, dato che nei granulomi i batteri rimangono comunque latenti.[62]
Un'altra caratteristica dei granulomi della tubercolosi umana è lo sviluppo di necrosi, cioè della morte delle cellule, al centro dei tubercoloma. A occhio nudo la necrosi ha l'aspetto di formaggio bianco, ed è stata quindi chiamata necrosi caseosa.[63]
Come accennato prima, se i batteri della tubercolosi riescono ad accedere al flusso sanguigno da un'area di tessuto danneggiato, si diffondono nell'organismo e creano molti focolai di infezione, tutti con l'aspetto di piccoli tubercoli bianchi nei tessuti. Questa grave forma di tubercolosi è molto diffusa nei bambini e negli anziani (per l'immaturità del sistema immunitario o, nel secondo caso, per il suo decadimento), ed è chiamata tubercolosi miliare. I pazienti con la tubercolosi disseminata hanno una mortalità del 20% circa, persino con un trattamento intensivo.[64]
In molti pazienti l'infezione ha decorso remittente-recidivante anche se non trattata, dando periodi di relativo benessere: questo in ragione del grande adatammento del micobatterio all'uomo, con cui praticamente si è evoluto insieme. La distruzione dei tessuti e la necrosi è bilanciata dalla guarigione e dalla fibrosi,[63] con i tessuti affetti che vengono rimpiazzati da cicatrici e le cavità riempite di materiale necrotico bianco. Nella malattia attiva parte del materiale necrotico si unisce all'aria passante per i bronchi, e questo viene espulso con la tosse: queste goccioline di Flügge contengono micobatteri, e quindi possono diffondere l'infezione. Un trattamento con antibiotici appropriati non solo consente la guarigione, ma riesce anche a ridurre le possibilità di trasmissione. Durante la convalescenza, le aree affette vengono lentamente rimpiazzate da tessuto cicatriziale.
Clinica
modificaLa tubercolosi può infettare molte parti del corpo, ma più comunemente colpisce i polmoni, prendendo il nome di tubercolosi polmonare.[65] La tubercolosi extrapolmonare si verifica quando vi è un'infezione all'esterno dei polmoni. La tubercolosi extrapolmonare può coesistere con la tubercolosi polmonare.[65] Sintomi sistemici includono febbre, brividi, sudorazione notturna, perdita di appetito, perdita di peso, pallore, e una tendenza ad affaticarsi molto facilmente (astenia).[3]
In caso di infezioni ai reni è possibile che si verifichi anemia normocitica e normocromica per carenza di produzione di eritropoietina da parte dei reni.[2]
Nelle infezioni tonsillari si riscontra linfoadenopatia cervicale con periadenite permanente. La mucosa tonsillare si presenta ipertrofica, iperemica, ciclicamente ulcerata con necrosi caseose benigne che si risolvono senza esiti evidenti.[66]
Negli stati avanzati di malattia questa può portare pressione bassa, frequenza cardiaca accelerata e dita ippocratiche dette anche a "bacchetta di tamburo".[67]
Nonostante la tubercolosi extrapolmonare non sia affatto contagiosa può coesistere con la tubercolosi polmonare che invece lo potrebbe essere se è in una fase attiva e se la saliva del soggetto è bacillifera.[68]
Tubercolosi polmonare
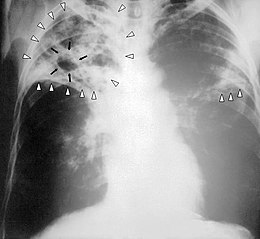
modificaSe una infezione tubercolare diventa attiva, molto probabilmente coinvolge i polmoni (in circa il 90% dei casi).[7][69] I sintomi possono includere dolore al petto e una tosse prolungata con produzione di espettorato. Circa il 25% delle persone può non avvertire alcun sintomo (cioè rimanere "asintomatica").[7] Di tanto in tanto, le persone possono tossire sangue (emottisi) in piccole quantità, e in casi molto rari, l'infezione può erodere l'arteria polmonare, con conseguente emorragia massiva (aneurisma di Rasmussen).[70][71]
La tubercolosi può diventare una malattia cronica e causare cicatrici estese nei lobi superiori dei polmoni. I lobi polmonari superiori sono, infatti, più frequentemente colpiti rispetto a quelli inferiori.[65] La ragione di questa differenza non è del tutto chiara[1] ma potrebbe essere spiegata dalla presenza di un maggior flusso d'aria migliore,[1] o dallo scarso drenaggio linfatico presente nei lobi superiori.[65]
Tubercolosi extrapolmonare
modificaNel 15-20% dei casi attivi, l'infezione si diffonde al di fuori delle vie respiratorie, causando altri tipi di tubercolosi.[72] Questi sono comunemente indicate come "tubercolosi extrapolmonare".[73] La tubercolosi extrapolmonare si verifica più comunemente nei soggetti immunocompromessi e nei bambini piccoli. Negli individui affetti da HIV, ciò si verifica in più del 50% dei casi.[73]
Le infezioni extrapolmonari da Mycobacterium tuberculosis possono interessare tutto l'organismo anche se, essendo micobatteri aerobi, colpiscono maggiormente organi concavo cavernosi. Siti più frequenti di infezione extrapolmonare includono la pleura (pleurite tubercolare), sistema nervoso centrale (meningite tubercolare), sistema linfatico (adenite tubercolare), apparato genito-urinario (tubercolosi urogenitale) e nelle ossa e articolazioni (Malattia di Pott). Quando vi è un coinvolgimento dell'apparato scheletrico, la malattia prende il nome di "tubercolosi ossea",[74] una forma di osteomielite.[1] A volte, lo scoppio di un ascesso tubercolare attraverso la pelle dà origine ad una ulcera tubercolare.[75]
I sintomi della tubercolosi extrapolmonare sono vari e di varia entità in relazione all'organo colpito, al tipo o ai tipi di micobatterio e al modo in cui reagisce il sistema immunitario.[76] In caso di infezioni intestinali si possono avere: ernia iatale, reflusso gastro esofageo, stenosi intestiale, megacolon, stipsi. Questa forma è spesso confusa e trattata per malattia di Crohn, celiachia o intolleranze alimentari.[77][78][79]
Nelle infezioni tonsillari si riscontrano linfoadenopatie cervicali satelliti con evidenti periadeniti permanenti. La mucosa tonsillare si presenta ipertrofica e iperemica e ciclicamente si ulcera con necrosi caseose tendenti alla guarigione senza lasciare traccia. Nella tubercolosi esofagea, a causa della atonia causata dai patogeni infiltrati, si riscontra disfagia spesso dolorosa.[80][81][82]
Potenzialmente più grave vi è una forma di tubercolosi diffusa, comunemente nota come tubercolosi miliare.[65][83][84] Questa forma costituisce circa il 10% dei casi extrapolmonari della malattia.[85]
Trasmissione
modificaQuando persone che soffrono di tubercolosi polmonare attiva tossiscono, starnutiscono, parlano o sputano, espellono goccioline di aerosol da 0,5 a 5 µm di diametro. Un singolo starnuto, per esempio, può rilasciare fino a 40.000 particelle.[86] Ognuna di queste gocce può trasmettere la malattia, poiché la dose infettiva di tubercolosi è molto piccola e l'inalazione di un singolo batterio può creare una nuova infezione.[87] In caso di tubercolosi renale il batterio può trasmettersi attraverso le urine.[88] Prolungati contatti con persone affette da tale malattia sono a particolare rischio di infezione, con una percentuale del 22% circa di contagio. Una persona con tubercolosi attiva, ma non trattata può infettare 10-15 persone all'anno.[3] Altri soggetti a rischio includono persone che vivono in aree in cui la tubercolosi è molto diffusa, persone che si iniettano sostanze utilizzando aghi non disinfettati, residenti e impiegati in luoghi di raduno ad alto rischio, pazienti immunocompromessi da malattie come l'AIDS, persone che prendono farmaci immunosoppressori e personale di assistenza sanitaria che trattano pazienti di questo tipo.[89]
La trasmissione può avvenire solamente (da alcuni anni ricercatori considerano anche la T. "latente" contagiosa, sia in soggetti ordinari e specialmente in vaccinati BCG spesso senza sintomi e possibili portatori transitori e temporanei) da persone (vista la resistenza del batterio in ambiente la trasmissione può avvenire indirettamente per molteplici vie transitorie, nonché acqua e terreno, nonché animali domestici e selvatici infetti/vi) con tubercolosi attiva. La possibilità di infezione tra due soggetti dipende dal numero di particelle infette emesse dal portatore, dall'efficacia del sistema di ventilazione, dalla durata di esposizione e dalla virulenza del ceppo di MTB.[68] La catena di trasmissione può quindi essere interrotta isolando pazienti con la malattia attiva e iniziando un'efficace cura anti-tubercolare. Dopo due settimane di trattamento, le persone con tubercolosi attiva non resistente cessano di essere contagiosi. Se qualcuno viene infettato, saranno necessari almeno 21 giorni, o 3-4 settimane prima che questo possa trasmettere la propria malattia agli altri.( il batterio a crescita lenta di 15-20 ore per replicazione pertanto trasmissione, 3-4 settimane è il tempo necessario per l'ottenimento di colonie consistenti di facile visibilità ad occhio nudo ed ottico, in quanto pochi laboratori dispongono di microscopi elettronici) [90] La tubercolosi può essere trasmessa anche dall'ingestione di carne o latte bovino se il bestiame è infetto da tubercolosi. Il responsabile di questa infezione è il Mycobacterium bovis.[91]
Antonio D'Azevedo Maia ha sviluppato alcune teorie circa la predisposizione per l'insorgenza della tubercolosi negli esseri umani, sottolineando che potesse essere ereditaria o acquisita.[senza fonte]
Diagnosi
modificaLa tubercolosi può essere una malattia difficile da diagnosticare, soprattutto a causa della difficoltà di coltivare questo organismo a lenta crescita in laboratorio (4-12 settimane in coltura arricchita). Una completa valutazione medica della tubercolosi deve comprendere anche la storia medica del paziente, una radiografia del torace, e un esame medico. Oltre alle indagini cliniche e radiologiche vi sono anche possibili esami di laboratorio. Questi possono includere test cutanei alla tubercolina, test sierologici, strisci microbiologici e colture di batteri. L'interpretazione dei test cutanei alla tubercolina dipendono dai fattori di rischio della persona per l'infezione e la progressione della tubercolosi, come l'esposizione ad altri casi di tubercolosi e l'immunosoppressione.[68]
Attualmente l'infezione latente viene diagnosticata in una persona non immunizzata con il test cutaneo, che provoca una reazione ritardata di tipo ipersensitivo a un estratto di M. tuberculosis oppure con i test ematici "Elispot tubercolosi" e "Quantiferon tubercolosi Gold". Gli immunizzati alla tubercolosi o quelli con una infezione terminata in precedenza risponderanno al test cutaneo con una ipersensibilità ritardata identica a coloro che hanno attualmente l'infezione attiva, quindi il test deve essere utilizzato con cautela, specialmente sulle persone provenienti da paesi dove l'immunizzazione alla tubercolosi è diffusa.[92] Nuovi test per la tubercolosi vengono sviluppati alla ricerca di metodi più economici, veloci e accurati. Questi test utilizzano il rilevamento della reazione a catena della polimerasi di DNA batterico e campioni di anticorpi per rilevare il rilascio di interferone gamma in risposta ai micobatteri.[93] Tali metodiche non sono condizionate dall'immunizzazione, e quindi generano meno falsi positivi.[94]
Diagnosi sempre più rapide ed economiche sono particolarmente importanti nei paesi in via di sviluppo, dove la possibilità di test costosi limita la diagnosi, e quindi la possibile cura, a un numero estremamente limitato di persone. In alcuni Paesi africani, per diagnosticare la tubercolosi vengono impiegati i ratti giganti del Gambia addestrati dalla ONG APOPO, con sede in Belgio e in Tanzania. Lo straordinario olfatto di questi roditori ha permesso di diagnosticare con discreto successo la malattia analizzando campioni di saliva di soggetti a rischio.[95][96]
Progressione
modificaLa progressione dall'infezione tubercolosa alla malattia avviene quando i bacilli della tubercolosi prevalgono sulle difese del sistema immunitario e iniziano a moltiplicarsi. Nella tubercolosi primaria (1-5% dei casi) questo avviene poco dopo l'infezione. Tuttavia, nella maggior parte dei casi, si verifica un'infezione latente che non ha sintomi chiari. Questi batteri dormienti possono produrre tubercolosi nel 2-23% dei casi latenti, spesso diversi anni dopo l'infezione.[97] Il rischio di riattivazione aumenta con l'immunosoppressione, causata da fattori come l'HIV. In pazienti infettati sia da M. tuberculosis che da HIV, il rischio di riattivazione aumenta del 10% all'anno.[57]
Altre condizioni che aumentano il rischio comprendono l'assunzione di droghe, in particolare quelle intravenose; una recente infezione di tubercolosi o una storia medica di tubercolosi inadeguatamente trattata; diabete mellito; silicosi; terapie prolungate di corticosteroidi e altre terapie immunosoppressive; cancro alla testa e al collo; malattie ematologiche e reticoloendoteliali come la leucemia e il linfoma di Hodgkin; malattie terminali ai reni; bypass intestinale o gastrectomia; sindromi da malassorbimento croniche; peso corporeo ridotto.[68]
Studi gemelli degli anni cinquanta mostravano che il percorso dell'infezione tubercolare era altamente dipendente dalla genetica. A quell'epoca infatti era molto raro che uno dei gemelli identici sopravvivesse e l'altro morisse: entrambi subivano lo stesso destino.[98]
Alcuni farmaci, inclusi quelli per l'artrite reumatoide che agiscono bloccando il fattore di necrosi tumorale (una citochina causa d'infiammazione sistemica), incrementano il rischio di attivare un'infezione latente a causa dell'importanza di questa citochina nella difesa immunitaria contro la tubercolosi.[99]
Trattamento
modificanella cura della tubercolosi
Il trattamento per la tubercolosi utilizza gli antibiotici per uccidere i micobatteri. Gli antibiotici più utilizzati sono la rifampicina, la pirazinamide, l'etambutolo e l'isoniazide. Sono i quattro farmaci che si usano, secondo le linee guida, nei primi due mesi di terapia, nella cosiddetta "fase d'attacco".
Gli schemi terapeutici più diffusi prevedono una terapia iniziale con isoniazide (300 mg), rifampicina (600 mg), pirazinamide (2000 mg) ed etambutolo (1200 mg), somministrati in associazione giornalmente.
Dopo i due mesi, i farmaci che si usano sono i soli isoniazide (600 mg) e rifampicina (600 mg), tre volte alla settimana per almeno altri 4 mesi. Infatti, rispetto al breve periodo di cure di antibiotici tipicamente utilizzato per altre infezioni batteriche, la tubercolosi necessita di periodi molto più lunghi (dai 6 ai 12 mesi) per eliminare completamente i micobatteri dall'organismo.[68] Il trattamento per la tubercolosi latente utilizza solitamente un singolo antibiotico (chemioprofilassi preventiva), mentre la tubercolosi attiva viene curata in modo più efficace con la combinazione di diversi antibiotici, per ridurre la possibilità che i batteri sviluppino una resistenza agli antibiotici.[100] Persone con infezioni latenti vengono curate per prevenire la possibile evoluzione della tubercolosi nella sua forma attiva.
Sebbene il trattamento antitubercolare abbia rappresentato una svolta nell'epidemiologia della malattia, una volta un vero e proprio flagello per i paesi occidentali (lo è ancora per i paesi in via di sviluppo), la terapia utilizzante la rifampicina e l'isoniazide non è senza rischi. I Centers for Disease Control and Prevention (CDC) hanno fornito agli operatori sanitari delle raccomandazioni contro l'utilizzo di rifampicina e pirazinamide per il trattamento dell'infezione tubercolosa latente, a causa dell'alto numero di ospedalizzazioni e decessi da danni al fegato associati con l'utilizzo combinato di questi due farmaci.[101]
La tubercolosi resistente ai farmaci si trasmette allo stesso modo della normale tubercolosi. La resistenza primaria avviene nelle persone che sono infette da un ceppo resistente di tubercolosi. Un paziente con tubercolosi normale sviluppa una resistenza secondaria (o resistenza acquisita) durante la terapia contro la tubercolosi a causa del trattamento inadeguato, del non mantenimento delle cure prescritte o dell'utilizzo di medicine di bassa qualità.[100] La tubercolosi resistente ai farmaci è un problema in molti paesi in via di sviluppo, poiché il trattamento è più prolungato e richiede farmaci più costosi. La tubercolosi multiresistente (MDR-TB) è definita come tubercolosi resistente ai due medicinali più efficaci di prima linea: la rifampicina e l'isoniazide.[102] La tubercolosi estensivamente resistente ai farmaci (XDR-TB) è immune anche a tre o più dei farmaci di seconda linea.[49] La tubercolosi totalmente resistente ai farmaci (TDR-TB) è resistente, come riporta la sua definizione, a tutti i farmaci, ed è ritenuta incurabile. Al 2012, questa forma è stata rilevata in sole tre nazioni: India, Iran e Italia.[103][104][105][106]
Nel caso di meningite tubercolare, si deve ricorrere a farmaci in grado di passare attraverso la barriera emato-encefalica.[107] Talvolta può essere necessario la somministrazione di tali farmaci attraverso un serbatoio di Ommaya.[108]
Nei tempi antichi i trattamenti disponibili si concentravano particolarmente sui parametri dietetici. Plinio il Vecchio descrisse diversi metodi nella sua Naturalis Historia: il fegato di lupo preso in vino povero, il lardo di una scrofa nutrita con erba, o la carne di asina con il brodo.[109] Nonostante questi metodi particolari non siano stati testati scientificamente, è stato dimostrato che topi di laboratorio nutriti con una dieta al 2% di proteine soffrivano di mortalità ben più alta di topi con una dieta al 20% di proteine a cui era stata somministrata la stessa dose di batteri, e che il progresso verso la morte delle cavie poteva essere invertito restaurando una dieta normale.[110] Inoltre, le statistiche degli immigrati di South London rivelano un incremento di 8,5 volte del rischio di tubercolosi nei latto-vegetariani, prevalentemente indiani e asiatici, cioè persone che si nutrono solamente di vegetali e derivati caseari, rispetto ai musulmani che mangiavano carne e pesce quotidianamente.[111] Pare comunque più accreditata l'ipotesi che i responsabili siano le carenze di vitamine, come la B12 o la D.
Trattamento della tubercolosi resistente ai farmaci
modificaCome detto, esistono alcune forme di tubercolosi tendenzialmente resistenti al trattamento convenzionale con antibiotici. La tubercolosi resistente viene classificata come[112][113]:
- multiresistente (MDR-TB), quando non vi è risposta ai due farmaci di prima linea (rifampicina e isoniazide)
- estensivamente resistente (XDR-TB), quando la somministrazione di tre o più dei farmaci di seconda linea non risulta efficace
- totalmente resistente ai farmaci (TDR-TB), quando non è curabile con nessun farmaco attualmente esistente
In presenza tubercolosi multiresistente, la strategia da adottare è l'estensione dei principi attivi da somministrare, quali ad esempio possono essere gli amminoglicosidi come la capreomicina e la kanamicina, o ai fluorochinoloni come l'ofloxacina, la ciprofloxacina, la moxifloxacina e la levofloxacina, il tionamidi etionamide Prothionamid e agenti batteriostatici, para-aminosalicilico acido (PAS) e cicloserina. Possono essere prescritti anche l'acido 4-amminosalicilico e la cicloserina.[114][115]
L'antibiotico linezolid è ancora oggi spesso prescritto nei casi più gravi di tubercolosi multi-resistente. Tuttavia, in un recente studio l'82% dei pazienti seguiti ha sviluppato effetti collaterali potenzialmente associati al farmaco. Le reazioni avverse più comuni sono mielosoppressione con anemia e neutropenia, neuropatia ottica e periferica.[115]
Il trattamento della MDR-TB consiste nell'assunzione di una terapia farmacologica multipla contemporanea per un periodo di almeno 21 mesi. Nei primi tre mesi, i pazienti ricevono una combinazione di cinque diversi farmaci. Le possibilità di successo del trattamento della tubercolosi multiresistente è inferiore al trattamento della tubercolosi semplice, anche se i pazienti ricevono una terapia più efficace.
In uno studio effettuato in Turchia, l'uso supplementare della resezione polmonare su pazienti con tubercolosi multiresistente, ha portato alla guarigione 12 casi su 13. Uno studio analogo è stato condotto in Sudafrica.[116][117]
Directly Observed Therapy
modificaLa terapia per la tubercolosi è lunga e complessa. Un ciclo di cure può durare da 6 mesi a 18-24 mesi a seconda dell'aderenza del paziente alla prescrizione. Perché il trattamento sia efficace e per evitare che si instauri una resistenza ai farmaci antitubercolari, l'Organizzazione Mondiale della Sanità ha proposto una strategia denominata Directly Observed Therapy (terapia osservata direttamente) o DOT, che consiste in un regime terapico in cui vi sia un sanitario che si assicuri che il paziente assuma regolarmente la sua dose di farmaci, così come previsto dalla prescrizione. Diversi studi hanno dimostrato che la strategia DOT è in grado di ridurre la durata della cura a 6-8 mesi.[76]
Prognosi
modificano dati
≤10
≥10–25
≥25–50
≥50–75
≥75–100
≥100–250
≥250–500
≥500–750
≥750–1000
≥1000–2000
≥2000–3000
≥ 3000
La progressione da infezione tubercolare a malattia tubercolosi conclamata si verifica quando i bacilli superano le difese del sistema immunitario e iniziano a moltiplicarsi. Nella malattia primaria (1-5% dei casi), questo si verifica subito dopo l'infezione iniziale.[1] Tuttavia, nella maggior parte dei casi, una infezione latente si verifica senza sintomi evidenti.[1] Questi bacilli dormienti producono tubercolosi attiva nel 5-10% dei casi latenti, spesso molti anni dopo l'infezione.[119]
Il rischio di riattivazione aumenta se vi è una situazione di immunosoppressione, come nel caso di infezione da HIV. Negli individui con coinfezione da M. tuberculosis e HIV, il rischio di riattivazione aumenta del 10% l'anno.[1] Gli studi che utilizzano il DNA fingerprinting, un metodo di comparazione del DNA, su ceppi di M. tuberculosis hanno dimostrato che le reinfezioni avvengono più frequentemente di quanto si pensasse rispetto alla riattivazione.[120][121] La possibilità di morte per un caso di tubercolosi è di circa il 4%, al 2008, in calo rispetto all'8% del 1995.[7]
Prevenzione
modificaLa prevenzione e il controllo della tubercolosi hanno due approcci paralleli. Nel primo, le persone con la tubercolosi e le persone a loro vicine vengono identificate e trattate. L'identificazione delle infezioni spesso implica l'esame dei gruppi ad alto rischio per la tubercolosi. Nel secondo approccio, i bambini vengono vaccinati per proteggerli dalla tubercolosi. Sfortunatamente nessun vaccino disponibile garantisce una protezione affidabile per gli adulti. Tuttavia, nelle aree tropicali dove i livelli di altre specie di micobatteri sono elevati, l'esposizione a micobatteri non tubercolari dà una parziale protezione alla tubercolosi.[122]
Vaccini
modificaDopo il vaccino Maragliano, sviluppato da Edoardo Maragliano e utilizzato sull'uomo fin dai primi anni del Novecento, costituito da micobatteri uccisi al calore, i primi esperimenti per ottenere un vaccino costituito da micobatteri vivi attenuati di tubercolosi di razza bovina furono sviluppati da Albert Calmette e Camille Guérin all'Istituto Pasteur in Francia tra il 1908 e il 1921.[25] Venne chiamato "BCG" (bacillo di Calmette-Guérin). Il vaccino BCG venne usato sull'uomo nel 1921 in Francia, ma non ricevette diffusione e consenso negli Stati Uniti, Gran Bretagna e Germania fino alla seconda guerra mondiale.[26]
Molte nazioni utilizzano il BCG come parte dei loro programmi di controllo della tubercolosi, specialmente per i bambini. L'efficacia protettiva del BCG per prevenire forme gravi di tubercolosi (per esempio la meningite) nei bambini è maggiore dell'80%; la sua efficacia protettiva per prevenire tubercolosi polmonare negli adolescenti e negli adulti varia dallo 0 all'80%.[123]
In Sudafrica, il paese con la più alta concentrazione di tubercolosi, il vaccino viene dato a tutti i bambini sotto i tre anni.[124] Tuttavia il BCG è meno efficace in aree dove i micobatteri sono meno prevalenti, quindi il BCG non viene distribuito all'intera popolazione di queste nazioni. Negli Stati Uniti per esempio, il vaccino BCG non è raccomandato tranne che per persone con specifiche caratteristiche:[68]
- Bambini con risultati del test cutaneo negativi che sono continuamente esposti a pazienti non trattati o trattati con inefficacia, o che saranno continuamente esposti a tubercolosi multiresistente.
- Operatori di assistenza sanitaria considerati individualmente che lavorano in luoghi in cui è stata riscontrata un'alta percentuale di pazienti con tubercolosi multiresistente, in cui la trasmissione della tubercolosi multiresistente è probabile o dove il controllo contro la tubercolosi non è risultato efficace.
Il BCG protegge parzialmente contro alcune forme gravi di tubercolosi pediatrica, ma si è dimostrato inefficace contro la tubercolosi polmonare adulta, che compone la maggior parte dei casi mondiali. Attualmente ci sono più casi di tubercolosi sul pianeta di quanti ce ne siano stati in qualunque altra epoca storica, e molti concordano nell'urgenza dello sviluppo di un nuovo vaccino più efficace, che prevenga tutte le forme di tubercolosi, compresi i ceppi resistenti, in ogni fascia d'età, e tra le persone affette da HIV.[125]
Strategie di sanità pubblica
modificaL'Organizzazione Mondiale della Sanità ha dichiarato, nel 1993, la tubercolosi una "emergenza sanitaria globale"[7] e nel 2006, la Stop TB Partnership ha sviluppato un piano globale per fermare la tubercolosi, che mira a salvare 14 milioni di vite tra il suo lancio e il 2015.[126] Tuttavia il numero prefissato non potrà essere raggiunto entro il 2015, principalmente a causa dell'aumento della tubercolosi associata all'HIV e all'emergere di molteplici tubercolosi resistenti ai farmaci (MDR-TB).[7] Un sistema di classificazione sviluppato dalla American Thoracic Society viene utilizzato comunemente nei programmi di salute pubblica.[127]
Stato della ricerca
modificaDiversi vaccini per prevenire le infezioni di tubercolosi sono in corso di sviluppo. Il primo vaccino ricombinante è entrato nella fase di studio clinico negli Stati Uniti nel 2004, sponsorizzato dal National Institute of Allergy and Infectious Diseases (NIAID).[128] Uno studio del 2005 ha mostrato che un vaccino genetico per la tubercolosi somministrato con una chemioterapia convenzionale può accelerare la scomparsa dei batteri e proteggere da una successiva infezione nei topi; potrebbero volerci 4-5 anni prima che sia disponibile per gli esseri umani.[129] Un vaccino molto promettente per la tubercolosi, l'MVA85A, è attualmente allo studio di fase II in Sudafrica da un gruppo della Oxford University,[130] ed è basato su un vaccinia virus geneticamente modificato. Molte altre strategie vengono utilizzate per sviluppare nuovi vaccini.
Per incoraggiare ulteriori ricerche, i ricercatori stanno promuovendo nuovi modelli economici di sviluppo dei vaccini, compresi premi, incentivi sulle tasse e Advanced market Commitment.[131][132]
Un certo numero di gruppi, tra cui la Stop TB Partnership,[133] del South African Tuberculosis Vaccine Initiative e l'Aeras Global TB Vaccine Foundation sono fortemente coinvolti nella ricerca.[134] Tra questi, l'Aeras ha ricevuto una donazione di più di 280 milioni di dollari statunitensi dalla Fondazione Bill & Melinda Gates per lo sviluppo e per la concessione in licenza di un vaccino contro la tubercolosi per l'uso in paesi ad alta incidenza.[135][136]
Infezione di altri animali
modificaLa tubercolosi può essere portata da altri mammiferi; specie addomesticate, come cani e gatti, sono in genere immuni dalla tubercolosi, ma gli animali selvatici possono esserne portatori. In alcuni luoghi le norme mirate a prevenire il diffondersi della tubercolosi limitano il possesso di animali esotici; per esempio, lo stato della California proibisce il possesso dei gerbilli.[137]
La tubercolosi nel bestiame è causata dal Mycobacterium bovis. Uno sforzo per eliminare la tubercolosi bovina dal bestiame e dai branchi di cervi della Nuova Zelanda è in corso. È stato scoperto infatti che le infezioni del bestiame sono più probabili nelle aree in cui le specie vettore come l'opossum volpino australiano entrano in contatto con il bestiame ai confini delle fattorie.[138] Controllare i vettori attraverso l'eradicamento dell'opossum e monitorare il livello di malattia nel bestiame attraverso una regolare sorveglianza è l'approccio a due direzioni per eliminare la malattia dalla Nuova Zelanda.
In Irlanda e nel Regno Unito, una specie vettore per la diffusione della tubercolosi è stata identificata nel tasso. Come risposta, i governi sono stati messi sotto pressione da alcune fazioni, in particolare dagli allevatori, per creare una campagna attiva di eradicazione dei tassi in alcune aree con lo scopo di ridurre l'incidenza della tubercolosi bovina. L'effettività della parziale eliminazione dell'animale sull'incidenza della tubercolosi nel bestiame è incerta, visto che sia sostenitori che detrattori citano i loro studi per supportare le loro posizioni.[139][140][141] Per esempio, uno studio di un gruppo indipendente sul parziale abbattimento ha riportato il 18 giugno 2007 che la sua efficacia era improbabile e avrebbe fatto solamente una "lieve differenza" nella diffusione della tubercolosi, e che "l'abbattimento dei tassi non può contribuire significativamente al controllo futuro della tubercolosi del bestiame"; al contrario, un altro rapporto concludeva che questa politica avrebbe avuto un significativo impatto.[142] Il 4 luglio 2008 il governo inglese ha deliberato contro una proposta per la selezione e l'abbattimento dei tassi.[143]
Fra superstizione e letteratura
modificaPrima della Rivoluzione industriale, la tubercolosi era talvolta associata al vampirismo. Quando un membro di una famiglia ne moriva, gli altri membri avrebbero iniziato ad ammalarsi lentamente. La gente credeva che questo fosse causato dalla vittima originaria, che succhiava la vita dagli altri membri della famiglia. Inoltre, persone che avevano la tubercolosi mostravano sintomi simili a quelli che le persone reputavano essere tratti vampirici. Le persone che soffrono di tubercolosi hanno spesso occhi arrossati e gonfi (che, a loro volta, causano sensibilità alla luce intensa), un colorito pallido e tossiscono sangue, il che può suggerire, quale unico metodo per ripristinare questa perdita di sangue, di succhiarlo da altri.[144] Un'altra credenza popolare asseriva che i tubercolotici fossero costretti, di notte, ad assistere alle feste delle fate, così che la vittima veniva consumata dalla mancanza di sonno; questa credenza era molto diffusa quando si trovava un grosso collegamento tra le fate e i morti.[145] Allo stesso modo, ma meno comunemente, la tubercolosi era attribuita all'essere "cavalcati dalle streghe"; trasformati in cavalli dalle streghe per portarle ai loro raduni, le vittime subivano di nuovo la mancanza di sonno.[145]
La tubercolosi venne romanticizzata nel XIX secolo. Molte persone credevano che la tubercolosi causasse sensazioni di euforia definite come spes phthisica, o "speranza del consunto". Si pensava che le vittime di tubercolosi che erano artisti avessero scoppi di creatività mentre la malattia progrediva.[146] Agli inizi del XX secolo, alcuni credevano che la tubercolosi fosse causata dalla masturbazione.[147]
Fra i numerosi letterati, artisti e musicisti morti di tisi, la maggioranza in giovane età, si ricordano Giovan Battista Pergolesi (1710-1736), Giovanni Battista Grazioli (1746-1820), Novalis (1772-1801), John Keats (1795-1821), Giuseppe Giusti (1809-1850), Fryderyk Chopin (1810-1849), Saverio Costantino Amato (1816-1837), Emily Brontë (1818-1848), Anne Brontë (1820-1849), Charlotte Brontë (1816-1855), Jens Peter Jacobsen (1847-1885), Niccolò Paganini (1782-1840), Anton Čechov (1860-1904), Guido Gozzano (1883-1916), Franz Kafka (1883-1924), Amedeo Modigliani (1884-1920), Sergio Corazzini (1886-1907), Giovanni Boine (1887-1917), Katherine Mansfield (1888-1923) e George Orwell (1903-1950).
Al contempo, la passione per le storie d'amore e morte ha portato alla celebrità personaggi di poesie, romanzi e opere, morti di tisi, quali la destinataria del componimento A Silvia, di Giacomo Leopardi, Marguerite Gautier della Signora delle camelie di Alexandre Dumas figlio, Violetta de La traviata di Giuseppe Verdi, Mimì della Bohème di Giacomo Puccini, la contessa russa (Nata) della Tigre reale di Giovanni Verga e il piccolo Ilja dei Fratelli Karamàzov di Dostoevskij. Anche opere moderne, ma ambientate a cavallo tra diciottesimo e diciannovesimo secolo, hanno incluso personaggi ammalati di tisi (ad esempio Oscar, protagonista nell'omonimo manga Lady Oscar), usando la malattia quasi come un topos di quel particolare periodo storico. In ambito cinematografico invece, si può pensare per esempio a Enrico Salvatore Rizzo (interpretato da Dustin Hoffman) in Un uomo da marciapiede di John Schlesinger e a Lucilia (impersonata da Cacilda Becker in Floradas na serra, opera prima di Luciano Salce). Inoltre, la malattia svolge un ruolo fondamentale nella trama del videogioco Red Dead Redemption II: il fuorilegge Arthur Morgan, poiché mortalmente contagiato, inseguirà la redenzione ripudiando l’avidità e l’indole violenta che lo avevano contraddistinto prima della diagnosi. Si ricorda inoltre il protagonista della telenovela brasiliana Fiore selvaggio, interpretato da Fabio Jr..
Altri nomi per la tubercolosi
modificaIn passato la tubercolosi è stata chiamata "mal sottile" o "consunzione"[148], poiché sembrava consumare le persone da dentro, con fuoriuscita di sangue dalla bocca, febbre, pallore e un lungo deperimento. Altri nomi includono "tisi" (da φθίσις phthisis[148] "consunzione" in greco) e "tisi polmonare" (da phthisis pulmonalis[148]); scrofula[148] (negli adulti), che colpiva il sistema linfatico e provocava il gonfiore delle ghiandole del collo; tabes mesenterica[148], tubercolosi dell'addome, e lupus vulgaris, tubercolosi della pelle; "malattia del deperimento"[148]; "peste bianca", poiché le vittime avevano un aspetto pallido; "male del re", perché era credenza popolare che il tocco di un re potesse curare la scrofula; e "malattia di Pott" o "gobba" per la tubercolosi ossea.[149][150] La "tubercolosi miliare"[148], conosciuta comunemente come "tubercolosi disseminata", sopraggiunge quando l'infezione invade il sistema circolatorio, provocando lesioni che hanno l'aspetto, ai raggi X, di chicchi di miglio.[149][151]
Note
modifica- ^ a b c d e f g h Kumar V, Abbas AK, Fausto N, Mitchell RN, Robbins Basic Pathology, 8th, Saunders Elsevier, 2007, pp. 516–522, ISBN 978-1-4160-2973-1.
- ^ Konstantinos A, Testing for tuberculosis, in Australian Prescriber, vol. 33, n. 1, 2010, pp. 12–18 (archiviato dall'url originale il 4 agosto 2010).
- ^ a b c d e f Tuberculosis Fact sheet N°104, su who.int, World Health Organization, novembre 2010. URL consultato il 26 luglio 2011.
- ^ Jasmer RM, Nahid P, Hopewell PC, Clinical practice. Latent tuberculosis infection (PDF), in N. Engl. J. Med., vol. 347, n. 23, 2002, pp. 1860–6, DOI:10.1056/NEJMcp021045, ISSN 0028-4793, PMID 12466511., which cites Dolin PJ, Raviglione MC, Kochi A, Global tuberculosis incidence and mortality during 1990-2000, in Bull World Health Organ, vol. 72, n. 2, 1994, pp. 213–20, PMC 2486541, PMID 8205640.
- ^ World Health Organization, Epidemiology, in Global tuberculosis control: epidemiology, strategy, financing, 2009, pp. 6–33, ISBN 978-92-4-156380-2. URL consultato il 12 novembre 2009.
- ^ a b The sixteenth global report on tuberculosis (PDF), su who.int, 2011 (archiviato dall'url originale il 6 settembre 2012).
- ^ a b c d e f SD Lawn, Zumla, AI, Tuberculosis, in Lancet, vol. 378, n. 9785, 2 luglio 2011, pp. 57–72, DOI:10.1016/S0140-6736(10)62173-3, PMID 21420161.
- ^ Rothschild B, Martin L, Lev G, Bercovier H, Bar-Gal G, Greenblatt C, Donoghue H, Spigelman M, Brittain D, Mycobacterium tuberculosis complex DNA from an extinct bison dated 17,000 years before the present, in Clin Infect Dis, vol. 33, n. 3, 2001, pp. 305–11, DOI:10.1086/321886, PMID 11438894.
- ^ Pearce-Duvet J, The origin of human pathogens: evaluating the role of agriculture and domestic animals in the evolution of human disease, in Biol Rev Camb Philos Soc, vol. 81, n. 3, 2006, pp. 369–82, DOI:10.1017/S1464793106007020, PMID 16672105.
- ^ Zink A, Sola C, Reischl U, Grabner W, Rastogi N, Wolf H, Nerlich A, Characterization of Mycobacterium tuberculosis complex DNAs from Egyptian mummies by spoligotyping, in J Clin Microbiol, vol. 41, n. 1, 2003, pp. 359–67, DOI:10.1128/JCM.41.1.359-367.2003, PMID 12517873.
- ^ Hippocrates. Aphorisms. Accessed 7 ottobre 2006.
- ^ Konomi N, Lebwohl E, Mowbray K, Tattersall I, Zhang D, Detection of mycobacterial DNA in Andean mummies, in J Clin Microbiol, vol. 40, n. 12, 2002, pp. 4738–40, DOI:10.1128/JCM.40.12.4738-4740.2002, PMID 12454182.
- ^ "South America: Prehistoric Findings". Memorias do Instituto Oswaldo Cruz, Vol. 98 (Suppl.I) gennaio 2003. Retrieved on 08-02-2007.
- ^ Y. A. Al-Sharrah (2003), "The Arab Tradition of Medical Education and its Relationship with the European Tradition", Prospects 33 (4), Springer.
- ^ George Sarton, Introduction to the History of Science.
(cf. Dr. A. Zahoor and Dr. Z. Haq (1997). Quotations From Famous Historians of Science, Cyberistan.) - ^ David W. Tschanz, MSPH, PhD (August 2003). "Arab Roots of European Medicine", Heart Views 4 (2).
- ^ (EN) Ole Daniel Enersen, Léon Charles Albert Calmette, in Who Named It?.
- ^ Trail R, Richard Morton (1637–1698), in Med Hist, vol. 14, n. 2, 1970, pp. 166–74, PMID 4914685.
- ^ Zur Pathogenie der Impetigines. Auszug aus einer brieflichen Mitteilung an den Herausgeber. [Müller's] Archiv für Anatomie, Physiologie und wissenschaftliche Medicin. 1839, page 82.
- ^ Kentucky: Mammoth Cave long on history. Archiviato il 21 settembre 2008 in Internet Archive. CNN. 27 febbraio 2004. Accessed 8 ottobre 2006.
- ^ a b c McCarthy OR, The key to the sanatoria, in J R Soc Med, vol. 94, n. 8, 2001, pp. 413–7, PMID 11461990.
- ^ Nobel Foundation. The Nobel Prize in Physiology or Medicine 1905. Accessed 7 ottobre 2006.
- ^ Waddington K, To stamp out "so terrible a malady": bovine tuberculosis and tuberculin testing in Britain, 1890–1939, in Med Hist, vol. 48, n. 1, 2004, pp. 29–48, PMID 14968644.
- ^ Rosenthal SR., BCG vaccination against tuberculosis, Boston, Litte, Brown & Co., 1957.
- ^ a b Bonah C, The 'experimental stable' of the BCG vaccine: safety, efficacy, proof, and standards, 1921–1933, in Stud Hist Philos Biol Biomed Sci, vol. 36, n. 4, 2005, pp. 696–721, DOI:10.1016/j.shpsc.2005.09.003, PMID 16337557.
- ^ a b Comstock G, The International Tuberculosis Campaign: a pioneering venture in mass vaccination and research, in Clin Infect Dis, vol. 19, n. 3, 1994, pp. 528–40, PMID 7811874.
- ^ Torrey EF and Yolken RH. 2005. Their bugs are worse than their bite. Washington Post, 3 aprile, p. B01., su birdflubook.com. URL consultato il 10 luglio 2008 (archiviato dall'url originale il 28 aprile 2013).
- ^ Medical Research Council (UK). MRC's contribution to Tuberculosis research. Archiviato il 15 dicembre 2007 in Internet Archive. Accessed 2 luglio 2007.
- ^ Wolfart W, Surgical treatment of tuberculosis and its modifications—collapse therapy and resection treatment and their present-day sequelae, in Offentl Gesundheitswes, vol. 52, 8–9, 1990, pp. 506–11, PMID 2146567.
- ^ Lalloo U, Naidoo R, Ambaram A, Recent advances in the medical and surgical treatment of multi-drug resistant tuberculosis, in Curr Opin Pulm Med, vol. 12, n. 3, 2006, pp. 179–85, DOI:10.1097/01.mcp.0000219266.27439.52, PMID 16582672.
- ^ Tuberculosis – Respiratory and Non-respiratory Notifications, England and Wales, 1913-2005, su hpa.org.uk, Health Protection Agency Centre for Infections, 21 marzo 2007. URL consultato il 1º agosto 2007.
- ^ Paolo W, Nosanchuk J, Tuberculosis in New York city: recent lessons and a look ahead, in Lancet Infect Dis, vol. 4, n. 5, 2004, pp. 287–93, DOI:10.1016/S1473-3099(04)01004-7, PMID 15120345.
- ^ World Health Organization (WHO). Frequently asked questions about TB and HIV. Retrieved 6 ottobre 2006.
- ^ a b c World Health Organization. Global tuberculosis control - surveillance, planning, financing WHO Report 2006. Retrieved on 13 ottobre 2006.
- ^ National Institute of Allergy and Infectious Diseases (NIAID). Copia archiviata, su www3.niaid.nih.gov. URL consultato il 25 febbraio 2013 (archiviato dall'url originale il 9 maggio 2008). 26 ottobre 2005. Retrieved on 3 ottobre 2006. "According to the World Health Organization (WHO), nearly 2 billion people, one-third of the world's population, have TB."
- ^ a b Centers for Disease Control. Fact Sheet: Tuberculosis in the United States. Archiviato il 23 aprile 2009 in Internet Archive. 17 marzo 2005, Retrieved on 6 ottobre 2006.
- ^ Stop TB Partnership. London tuberculosis rates now at Third World proportions. PR Newswire Europe Ltd. 4 dicembre 2002. Retrieved on 3 ottobre 2006.
- ^ Global tuberculosis control: surveillance, planning, financing.[collegamento interrotto] WHO report 2007. Geneva, World Health Organization (WHO/HTM/TB/2007.376)
- ^ Notification rates of tuberculosis: by NHS Regional Office area, 1990-2001: Regional Trends 37 Office for National Statistics Retrieved on 13 ottobre 2006.
- ^ World Health Organization, The Stop TB Strategy, case reports, treatment outcomes and estimates of TB burden, in Global tuberculosis control: epidemiology, strategy, financing, 2009, pp. 187–300, ISBN 978-92-4-156380-2. URL consultato il 14 novembre 2009 (archiviato dall'url originale il 19 novembre 2009).
- ^ Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute, Tubercolosi - Aspetti epidemiologici: dati generali, su epicentro.iss.it. URL consultato il 30 marzo 2013.
- ^ World Health Organization (WHO). Global Tuberculosis Control Report, 2006 - Annex 1 Profiles of high-burden countries. (PDF) Retrieved on 13 ottobre 2006.
- ^ Centers for Disease Control and Prevention (CDC). 2005 Surveillance Slide Set. (12 settembre, 2006) Retrieved on 13 ottobre 2006.
- ^ Chaisson RE, Martinson NA, Tuberculosis in Africa—combating an HIV-driven crisis, in N Engl J Med, vol. 358, n. 11, 2008, pp. 1089–1092, DOI:10.1056/NEJMp0800809, PMID 18337598.
- ^ Davies PDO, Yew WW, Ganguly D, et al., Smoking and tuberculosis: the epidemiological association and pathogenesis, in Trans R Soc Trop Med Hyg, vol. 100, 2006, pp. 291–8, DOI:10.1016/j.trstmh.2005.06.034, PMID 16325875.
- ^ Jha P, Jacob B, Gajalakshmi V, et al., A nationally representative case–control study of smoking and death in India, in N Engl J Med, vol. 358, n. 11, 2008, pp. 1137–1147, DOI:10.1056/NEJMsa0707719, PMID 18272886.
- ^ Restrepo BI, Convergence of the tuberculosis and diabetes epidemics: renewal of old acquaintances, in Clin Infect Dis, vol. 45, 2007, pp. 436–8, DOI:10.1086/519939.
- ^ Iademarco MF, Castro KG, Epidemiology of tuberculosis, in Seminars in respiratory infections, vol. 18, n. 4, 2003, pp. 225–40, DOI:10.1017/S0950268801005532, PMID 14679472.
- ^ a b Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs—worldwide, 2000–2004, in MMWR Morb Mortal Wkly Rep, vol. 55, n. 11, 2006, pp. 301–5, PMID 16557213.
- ^ Sobero R, Peabody J, Tuberculosis control in Bolivia, Chile, Colombia and Peru: why does incidence vary so much between neighbors?, in Int J Tuberc Lung Dis, vol. 10, n. 11, 2006, pp. 1292–5, PMID 17131791.
- ^ World Health Organization (WHO). Stop TBC Partnership. Archiviato il 31 dicembre 2006 in Internet Archive. Retrieved on 3 ottobre 2006.
- ^ Cox R, Quantitative relationships for specific growth rates and macromolecular compositions of Mycobacterium tuberculosis, Streptomyces coelicolor A3(2) and Escherichia coli B/r: an integrative theoretical approach, in Microbiology, vol. 150, Pt 5, 2004, pp. 1413–26, DOI:10.1099/mic.0.26560-0, PMID 15133103.
- ^ a b Madison B, Application of stains in clinical microbiology, in Biotech Histochem, vol. 76, n. 3, 2001, pp. 119–25, DOI:10.1080/714028138, PMID 11475314.
- ^ Parish T, Stoker N, Mycobacteria: bugs and bugbears (two steps forward and one step back), in Mol Biotechnol, vol. 13, n. 3, 1999, pp. 191–200, DOI:10.1385/MB:13:3:191, PMID 10934532.
- ^ Niemann S, Richter E, Dalügge-Tamm H, Schlesinger H, Graupner D, Königstein B, Gurath G, Greinert U, Rüsch-Gerdes S, Two cases of Mycobacterium microti derived tuberculosis in HIV-negative immunocompetent patients, in Emerg Infect Dis, vol. 6, n. 5, 2000, pp. 539–42, PMID 10998387.
- ^ Diagnosis and treatment of disease caused by nontuberculous mycobacteria. This official statement of the American Thoracic Society was approved by the Board of Directors, March 1997. Medical Section of the American Lung Association, in Am J Respir Crit Care Med, vol. 156, 2 Pt 2, 1997, pp. S1–25, PMID 9279284.
- ^ a b Onyebujoh, Phillip and Rook, Graham A. W. World Health Organization Disease Watch: Focus: Tuberculosis. dicembre 2004. Accessed 7 ottobre 2006.
- ^ a b Houben E, Nguyen L, Pieters J, Interaction of pathogenic mycobacteria with the host immune system, in Curr Opin Microbiol, vol. 9, n. 1, 2006, pp. 76–85, DOI:10.1016/j.mib.2005.12.014, PMID 16406837.
- ^ Herrmann J, Lagrange P, Dendritic cells and Mycobacterium tuberculosis: which is the Trojan horse?, in Pathol Biol (Paris), vol. 53, n. 1, 2005, pp. 35–40, PMID 15620608.
- ^ Agarwal R, Malhotra P, Awasthi A, Kakkar N, Gupta D, Tuberculous dilated cardiomyopathy: an under-recognized entity?, in BMC Infect Dis, vol. 5, n. 1, 2005, p. 29, DOI:10.1186/1471-2334-5-29, PMID 15857515.
- ^ Kaufmann S, Protection against tuberculosis: cytokines, T cells, and macrophages, in Ann Rheum Dis, 61 Suppl 2, 2002, pp. ii54–8, PMID 12379623.
- ^ Mauro Moroni, Roberto Esposito e Spinello Antinori, Malattie infettive, Edra Masson.
- ^ a b Grosset J, Mycobacterium tuberculosis in the extracellular compartment: an underestimated adversary, in Antimicrob Agents Chemother, vol. 47, n. 3, 2003, pp. 833–6, DOI:10.1128/AAC.47.3.833-836.2003, PMID 12604509.
- ^ Kim J, Park Y, Kim Y, Kang S, Shin J, Park I, Choi B, Miliary tuberculosis and acute respiratory distress syndrome, in Int J Tuberc Lung Dis, vol. 7, n. 4, 2003, pp. 359–64, PMID 12733492.
- ^ a b c d e [edited by] Gerald L. Mandell, John E. Bennett, Raphael Dolin, Mandell, Douglas, and Bennett's principles and practice of infectious diseases, 7th, Philadelphia, PA, Churchill Livingstone/Elsevier, 2010, pp. Chapter 250, ISBN 978-0-443-06839-3.
- ^ pmid Mario Raso, Trattato di anatomia patologica, in Piccin, II.
- ^ S. Abraham, N. Kamath; GS. Pai; J. Pinto, Nail changes in systemic diseases : A clinical study of 435 cases., in Indian J Dermatol Venereol Leprol, vol. 64, n. 3, pp. 144-5, PMID 20921746.
- ^ a b c d e f (EN) Centers for Disease Control and Prevention (CDC), Division of Tuberculosis Elimination, Core Curriculum on Tuberculosis: What the Clinician Should Know, su cdc.gov, 4th edition, agosto 2003. URL consultato il 30 marzo 2013.
- ^ D. Behera, Textbook of pulmonary medicine, 2nd, New Delhi, Jaypee Brothers Medical Pub., 2010, pp. 457, ISBN 978-81-8448-749-7 (archiviato dall'url originale il 18 luglio 2013).
- ^ P. Corr, Pulmonary artery aneurysm as a cause of massive hemoptysis: diagnosis and management., in Case Rep Radiol, vol. 2011, 2011, p. 141563, DOI:10.1155/2011/141563, PMID 22606538.
- ^ HY. Kim, KS. Song; JM. Goo; JS. Lee; KS. Lee; TH. Lim, Thoracic sequelae and complications of tuberculosis., in Radiographics, vol. 21, n. 4, pp. 839-58; discussion 859-60, PMID 11452057.
- ^ editor-in-chief SK Jindal, Textbook of pulmonary and critical care medicine, New Delhi, Jaypee Brothers Medical Publishers, 2011, pp. 549, ISBN 978-93-5025-073-0.
- ^ a b Golden MP, Vikram HR, Extrapulmonary tuberculosis: an overview, in American Family Physician, vol. 72, n. 9, 2005, pp. 1761–8, PMID 16300038.
- ^ [edited by] Vimlesh Seth, S.K. Kabra, Essentials of tuberculosis in children, 3rd, New Delhi, Jaypee Bros. Medical Publishers, 2006, pp. 249, ISBN 978-81-8061-709-6. URL consultato il 31 marzo 2013 (archiviato dall'url originale il 10 novembre 2014).
- ^ Manual of Surgery, Kaplan Publishing, 2008, pp. 75, ISBN 978-1-4277-9799-5.
- ^ a b JH. Hwang, PG. Choe; NH. Kim; JH. Bang; KH. Song; WB. Park; ES. Kim; SW. Park; HB. Kim; NJ. Kim; MD. Oh, Incidence and risk factors of tuberculosis in patients with human immunodeficiency virus infection., in J Korean Med Sci, vol. 28, n. 3, marzo 2013, pp. 374-7, DOI:10.3346/jkms.2013.28.3.374, PMID 23486534.
- ^ Y. Lei, FM. Yi; J. Zhao; RV. Luckheeram; S. Huang; M. Chen; MF. Huang; J. Li; R. Zhou; GF. Yang; B. Xia, Utility of in vitro interferon-γ release assay in differential diagnosis between intestinal tuberculosis and Crohn's disease., in J Dig Dis, vol. 14, n. 2, febbraio 2013, pp. 68-75, DOI:10.1111/1751-2980.12017, PMID 23176201.
- ^ F. Hoentjen, PC. Stokkers; J. Veenstra, [Ileus as a manifestation of intestinal tuberculosis]., in Ned Tijdschr Geneeskd, vol. 155, n. 32, 2011, pp. A3344, PMID 21835062.
- ^ S. Dilauro, NF. Crum-Cianflone, Ileitis: when it is not Crohn's disease., in Curr Gastroenterol Rep, vol. 12, n. 4, agosto 2010, pp. 249-58, DOI:10.1007/s11894-010-0112-5, PMID 20532706.
- ^ A. Khaliq, R. Kochhar; K. Vaiphei; R. Kochhar; S. Appasani; K. Singh, An uncommon cause of Dysphagia., in Dysphagia, vol. 27, n. 1, marzo 2012, pp. 145-7, DOI:10.1007/s00455-011-9382-9, PMID 22237721.
- ^ RN. Momin, VH. Chong, Oesophageal tuberculosis: rare but not to be forgotten., in Singapore Med J, vol. 53, n. 9, settembre 2012, pp. e192-4, PMID 23023913.
- ^ P. Mohan, S. Myilsamy; V. Leelakrishnan, Esophageal tuberculosis., in Clin Res Hepatol Gastroenterol, vol. 36, n. 4, agosto 2012, pp. 312-3, DOI:10.1016/j.clinre.2011.12.017, PMID 22521125.
- ^ S. Ray, A. Talukdar; S. Kundu; D. Khanra; N. Sonthalia, Diagnosis and management of miliary tuberculosis: current state and future perspectives., in Ther Clin Risk Manag, vol. 9, 2013, pp. 9-26, DOI:10.2147/TCRM.S29179, PMID 23326198.
- ^ T. Ziad, H. Nouri; A. Adny; Y. Rochdi; L. Aderdour; A. Raji, [Acute miliary tuberculosis or Isambert disease: a case report]., in Arch Pediatr, vol. 20, n. 1, gennaio 2013, pp. 41-3, DOI:10.1016/j.arcped.2012.10.010, PMID 23266174.
- ^ editors-in-chief, Thomas M. Habermann, Amit K. Ghosh, Mayo Clinic internal medicine : concise textbook, Rochester, MN, Mayo Clinic Scientific Press, 2008, pp. 789, ISBN 978-1-4200-6749-1.
- ^ Cole E, Cook C, Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies, in Am J Infect Control, vol. 26, n. 4, 1998, pp. 453–64, DOI:10.1016/S0196-6553(98)70046-X, PMID 9721404.
- ^ Nicas M, Nazaroff WW, Hubbard A, Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, in J Occup Environ Hyg, vol. 2, n. 3, 2005, pp. 143–54, DOI:10.1080/15459620590918466, PMID 15764538.
- ^ MR. Bacci, JJ. Namura; AT. Lera, Complicated urinary infection and extrapulmonary tuberculosis., in BMJ Case Rep, vol. 2012, 2012, DOI:10.1136/bcr-2012-007553, PMID 23257271.
- ^ Griffith D, Kerr C, Tuberculosis: disease of the past, disease of the present, in J Perianesth Nurs, vol. 11, n. 4, 1996, pp. 240–5, DOI:10.1016/S1089-9472(96)80023-2, PMID 8964016.
- ^ Causes of Tuberculosis, su mayoclinic.com, Mayo Clinic, 21 dicembre 2006. URL consultato il 19 ottobre 2007.
- ^ G. Zanella, A. Bar-Hen; ML. Boschiroli; J. Hars; F. Moutou; B. Garin-Bastuji; B. Durand, Modelling transmission of bovine tuberculosis in red deer and wild boar in normandy, france., in Zoonoses Public Health, 59 Suppl 2, settembre 2012, pp. 170-8, DOI:10.1111/j.1863-2378.2011.01453.x, PMID 22958262.
- ^ Rothel J, Andersen P, Diagnosis of latent Mycobacterium tuberculosis infection: is the demise of the Mantoux test imminent?, in Expert Rev Anti Infect Ther, vol. 3, n. 6, 2005, pp. 981–93, DOI:10.1586/14787210.3.6.981, PMID 16307510.
- ^ Nahid P, Pai M, Hopewell P, Advances in the diagnosis and treatment of tuberculosis, in Proc Am Thorac Soc, vol. 3, n. 1, 2006, pp. 103–10, DOI:10.1513/pats.200511-119JH, PMID 16493157.
- ^ Pai M, Zwerling A, Menzies D, Systematic Review: T-Cell-Based Assays for the Diagnosis of Latent Tuberculosis Infection: An Update, in Ann. Intern. Med., vol. 149, n. 3, giugno 2008, pp. 1-9, PMID 18593687.
- ^ Lisa Signorile, Il ratto sminatore, in National Geographic Italia, agosto 2015.
- ^ (EN) The rats who sniff out tuberculosis, su theguardian.com, 23 febbraio 2016.
- ^ Parrish N, Dick J, Bishai W, Mechanisms of latency in Mycobacterium tuberculosis, in Trends Microbiol, vol. 6, n. 3, 1998, pp. 107–12, DOI:10.1016/S0966-842X(98)01216-5, PMID 9582936.
- ^ New Scientist, 16 giugno 2007 [1]
- ^ Mutlu G, Mutlu E, Bellmeyer A, Rubinstein I, Pulmonary adverse events of anti-tumor necrosis factor-alpha antibody therapy, in Am J Med, vol. 119, n. 8, 2006, pp. 639–46, DOI:10.1016/j.amjmed.2006.01.015, PMID 16887405.
- ^ a b O'Brien R, Drug-resistant tuberculosis: etiology, management and prevention, in Semin Respir Infect, vol. 9, n. 2, 1994, pp. 104–12, PMID 7973169.
- ^ Update: adverse event data and revised American Thoracic Society/CDC recommendations against the use of rifampin and pyrazinamide for treatment of latent tuberculosis infection—United States, 2003, in MMWR Morb Mortal Wkly Rep, vol. 52, n. 31, 2003, pp. 735–9, PMID 12904741.
- ^ GR. Babu, R. Laxminarayan, The unsurprising story of MDR-TB resistance in India., in Tuberculosis (Edinb), vol. 92, n. 4, luglio 2012, pp. 301-6, DOI:10.1016/j.tube.2012.02.009, PMID 22504008.
- ^ Migliori GB, De Iaco G, Besozzi G, Centis R, Cirillo DM. First tuberculosis cases in Italy resistant to all tested drugs. Euro Surveill. 2007;12(20):pii=3194. Available online: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=3194
- ^ Katherine Rowland, Totally drug-resistant TB emerges in India, su nature.com, Nature, 13 gennaio 2012.
- ^ AA. Velayati, MR. Masjedi; P. Farnia; P. Tabarsi; J. Ghanavi; AH. Ziazarifi; SE. Hoffner, Emergence of new forms of totally drug-resistant tuberculosis bacilli: super extensively drug-resistant tuberculosis or totally drug-resistant strains in iran., in Chest, vol. 136, n. 2, agosto 2009, pp. 420-5, DOI:10.1378/chest.08-2427, PMID 19349380.
- ^ ZF. Udwadia, RA. Amale; KK. Ajbani; C. Rodrigues, Totally drug-resistant tuberculosis in India., in Clin Infect Dis, vol. 54, n. 4, febbraio 2012, pp. 579-81, DOI:10.1093/cid/cir889, PMID 22190562.
- ^ R. Bartzatt, Tuberculosis infections of the central nervous system., in Cent Nerv Syst Agents Med Chem, vol. 11, n. 4, dicembre 2011, pp. 321-7, PMID 22384992.
- ^ J. Lin, H. Zhou; N. Zhang; B. Yin; HS. Sheng, Effects of the implantation of Ommaya reservoir in children with tuberculous meningitis hydrocephalus: a preliminary study., in Childs Nerv Syst, vol. 28, n. 7, luglio 2012, pp. 1003-8, DOI:10.1007/s00381-012-1748-2, PMID 22526442.
- ^ Pliny the Elder, Natural History, quoted at Naphtali Lewis, Meyer Reinhold, Roman Civilization, su books.google.com.
- ^ John Chan, Yu Tian, Kathryn E. Tanakadagger, Ming S. Tsang, Keming Yu, Padmini Salgame, Dinah Carroll, Yvonne Kress, Rachel Teitelbaum, and Barry R. Bloom, Effects of protein calorie malnutrition on tuberculosis in mice, in Proc Natl Acad Sci U S A, vol. 93, n. 25, 10 dicembre 1996, pp. 14857–61, DOI:10.1073/pnas.93.25.14857, PMID 8962145.
- ^ Strachan DP, Powell KJ, Thaker A, Millard FJ, Maxwell JD, Vegetarian diet as a risk factor for tuberculosis in immigrant south London Asians, in Thorax, vol. 50, n. 2, 1995-02, pp. 175–80, PMID 7701458.
- ^ T. Sullivan, Y. Ben Amor, What's in a name? The future of drug-resistant tuberculosis classification., in Lancet Infect Dis, vol. 13, n. 4, aprile 2013, pp. 373-6, DOI:10.1016/S1473-3099(12)70318-3, PMID 23498589.
- ^ I. Abubakar, M. Zignol; D. Falzon; M. Raviglione; L. Ditiu; S. Masham; I. Adetifa; N. Ford; H. Cox; SD. Lawn; BJ. Marais, Drug-resistant tuberculosis: time for visionary political leadership., in Lancet Infect Dis, marzo 2013, DOI:10.1016/S1473-3099(13)70030-6, PMID 23531391.
- ^ M. Lee, J. Lee; MW. Carroll; H. Choi; S. Min; T. Song; LE. Via; LC. Goldfeder; E. Kang; B. Jin; H. Park, Linezolid for treatment of chronic extensively drug-resistant tuberculosis., in N Engl J Med, vol. 367, n. 16, ottobre 2012, pp. 1508-18, DOI:10.1056/NEJMoa1201964, PMID 23075177.
- ^ a b (DE) Heinzl, Susanne, Antibiotikatherapie der Tuberkulose: Linezolid bei hochresistenten Erregern, su aerzteblatt.de. URL consultato il 30 marzo 2013.
- ^ S. Yaldiz, S. Gursoy; A. Ucvet; SO. Kaya, Surgery offers high cure rates in multidrug-resistant tuberculosis., in Ann Thorac Cardiovasc Surg, vol. 17, n. 2, 2011, pp. 143-7, PMID 21597410.
- ^ R. Naidoo, A. Reddi, Lung resection for multidrug-resistant tuberculosis., in Asian Cardiovasc Thorac Ann, vol. 13, n. 2, giugno 2005, pp. 172-4, PMID 15905349.
- ^ WHO Disease and injury country estimates, su World Health Organization, 2004. URL consultato l'11 novembre 2009.
- ^ Peter G. Gibson, Michael Abramson e altri (a cura di), Evidence-based respiratory medicine, 1. publ., Oxford, Blackwell, 2005, pp. 321, ISBN 978-0-7279-1605-1.
- ^ Lambert M, Epco Hasker, Armand Van Deun, Dominique Roberfroid, Marleen Boelaert e Patrick Van Der Stuyft, Recurrence in tuberculosis: relapse or reinfection?, in Lancet Infect Dis, vol. 3, n. 5, 2003, pp. 282–7, DOI:10.1016/S1473-3099(03)00607-8, PMID 12726976.
- ^ JY Wang, Lee, LN, Lai, HC, Hsu, HL, Liaw, YS, Hsueh, PR, Yang, PC, Prediction of the tuberculosis reinfection proportion from the local incidence, in The Journal of infectious diseases, vol. 196, n. 2, 15 luglio 2007, pp. 281–8, DOI:10.1086/518898, PMID 17570116.
- ^ Fine P, Floyd S, Stanford J, Nkhosa P, Kasunga A, Chaguluka S, Warndorff D, Jenkins P, Yates M, Ponnighaus J, Environmental mycobacteria in northern Malawi: implications for the epidemiology of tuberculosis and leprosy, in Epidemiol Infect, vol. 126, n. 3, 2001, pp. 379–87, DOI:10.1017/S0950268801005532, PMID 11467795.
- ^ Bannon M, BCG and tuberculosis, in Arch Dis Child, vol. 80, n. 1, 1999, pp. 80–3, PMID 10325767.
- ^ WHO/UNICEF Review of National Immunization Coverage 1980–2005: South Africa (PDF). World Health Organization (August 2006). Retrieved on 8-6-2007.
- ^ Sadoff, Jerry. Advances in Tuberculosis Vaccine Strategies. Nature Reviews Microbiology. Vol. 4. giugno 2006.
- ^ The Global Plan to Stop TB, su stoptb.org, World Health Organization, 2011. URL consultato il 13 giugno 2011.
- ^ ed. by D. J. Weatherall ... [4. + 5. ed.] ed. by David A. Warrell, Sections 1 - 10., 4. ed., paperback., Oxford [u.a.], Oxford Univ. Press, 2005, pp. 560, ISBN 978-0-19-857014-1.
- ^ National Institute of Allergy and Infectious Diseases (NIAID).First U.S. Tuberculosis Vaccine Trial in 60 Years Begins. Archiviato il 24 settembre 2009 in Internet Archive. National Institutes of Health News 26 gennaio 2004. Retrieved on 19 ottobre 2007.
- ^ Ha S, Jeon B, Youn J, Kim S, Cho S, Sung Y, Protective effect of DNA vaccine during chemotherapy on reactivation and reinfection of Mycobacterium tuberculosis, in Gene Ther, vol. 12, n. 7, 2005, pp. 634–8, DOI:10.1038/sj.gt.3302465, PMID 15690060.
- ^ Ibanga H, Brookes R, Hill P, Owiafe P, Fletcher H, Lienhardt C, Hill A, Adegbola R, McShane H, Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis-endemic countries: issues in study design, in Lancet Infect Dis, vol. 6, n. 8, 2006, pp. 522–8, DOI:10.1016/S1473-3099(06)70552-7, PMID 16870530.
- ^ Webber, David and Kremer, Michael. Stimulating Industrial R&D for Neglected Infectious Diseases: Economic Perspectives (PDF). Bulletin of the World Health Organization 79(8), 2001, pp. 693–801.
- ^ Barder, Owen; Kremer, Michael; Williams, Heidi. "Advance Market Commitments: A Policy to Stimulate Investment in Vaccines for Neglected Diseases," Archiviato il 5 novembre 2006 in Internet Archive. The Economists' Voice, Vol. 3 (2006) Issue 3.
- ^ Department of Economic, Affairs, Social, Achieving the global public health agenda : dialogues at the Economic and Social Council, New York, United Nations, 2009, pp. 103, ISBN 978-92-1-104596-3. URL consultato il 10 agosto 2012 (archiviato dall'url originale il 10 novembre 2014).
- ^ [edited by] Jane N. Zuckerman, Elaine C. Jong, Travelers' vaccines, 2nd ed., Shelton, CT, People's Medical Pub. House, 2010, pp. 319, ISBN 978-1-60795-045-5.
- ^ Bill and Melinda Gates Foundation Announcement, Gates Foundation Commits $82.9 Million to Develop New Tuberculosis Vaccines, su globalhealth.org, 12 febbraio 2004 (archiviato dall'url originale il 10 ottobre 2009).
- ^ Katherine Nightingale, Gates foundation gives US$280 million to fight TB, su scidev.net, 19 settembre 2007.
- ^ 14 CA ADC § 671 Barclays official California code of regulations; Title 14. Natural resources; Division 1. Fish and game commission – Department of fish and game; Subdivision 3. General regulations; Chapter 3. Miscellaneous.
- ^ Tweddle N, Livingstone P, Bovine tuberculosis control and eradication programs in Australia and New Zealand, in Vet Microbiol, vol. 40, 1–2, 1994, pp. 23–39, DOI:10.1016/0378-1135(94)90044-2, PMID 8073626.
- ^ The Department of Agriculture & Food (Ireland). Disease Eradication Schemes - Bovine Tuberculosis and Brucellosis. Retrieved on 8 maggio 2006.
- ^ Cassidy, Martin. Badgers targeted over bovine TB. BBC News 2 dicembre 2004. Retrieved on 8 maggio 2006.
- ^ National Federation of Badger Groups (Ireland). Cattle blamed for massive increase in bovine TB. Archiviato il 19 agosto 2007 in Internet Archive. Retrieved on 8 maggio 2006.
- ^ Badgers and cattle TB: the final report of the Independent Scientific Group on Cattle TB (PDF), su publications.parliament.uk, House of Commons Environment, Food and Rural Affairs Committee. URL consultato il 4 luglio 2008.
- ^ Farmers' anger on cull rejection, su news.bbc.co.uk, BBC News, 4 luglio 2008. URL consultato il 4 luglio 2008.
- ^ Sledzik P, Bellantoni N, Brief communication: bioarcheological and biocultural evidence for the New England vampire folk belief, in Am J Phys Anthropol, vol. 94, n. 2, 1994, pp. 269–74, DOI:10.1002/ajpa.1330940210, PMID 8085617 (archiviato dall'url originale il 9 gennaio 2007).
- ^ a b Katharine Mary Briggs, An Encyclopedia of Fairies "Consumption" (Pantheon Books, 1976) p. 80. ISBN 0-394-73467-X
- ^ Lawlor, Clark. "Transatlantic Consumptions: Disease, Fame and Literary Nationalism in the Davidson Sisters, Southey, and Poe". Studies in the Literary Imagination, Fall 2003. Available at findarticles.com. Retrieved on 8-6-2007.
- ^ Laumann, Edward O. (1994) The Social Organization of Sexuality: Sexual Practices in the United States University of Chicago Press p 80, ISBN 0-226-47020-2
- ^ a b c d e f g Luigi Parola, Della tubercolosi in genere e della tisi in specie. (PDF), Favale, 1849, pp. 702. URL consultato il 9 luglio 2008.
- ^ a b Tuberculosis Archiviato il 10 luglio 2008 in Internet Archive. Encyclopedia Britannica, 11th ed.
- ^ Rudy's List of Archaic Medical Terms Archiviato il 9 luglio 2007 in Internet Archive. English Glossary of Archaic Medical Terms, Diseases and Causes of Death. Accessed 9 ottobre 2006
- ^ Disseminated tuberculosis NIH Medical Encyclopedia. Accessed 9 ottobre 2006
Bibliografia
modifica- Tognotti Eugenia, Il morbo lento. La tisi nell'Italia dell'Ottocento, Franco Angeli, Milano. ISBN 978-88-568-4765-9
- Blumberg HM, Leonard MK, Jasmer RM, Update on the treatment of tuberculosis and latent tuberculosis infection, in JAMA, vol. 293, n. 22, 2005, pp. 2776–84, DOI:10.1001/jama.293.22.2776, PMID 15941808.
- Thomas Dormandy, The White Death, New York, New York University Press, 2000, ISBN 0-8147-1927-9.
- Joint Tuberculosis Committee of the British Thoracic Society, Control and prevention of tuberculosis in the United Kingdom: code of practice 2000, in Thorax, vol. 55, n. 11, 2000, pp. 887–901, DOI:10.1136/thorax.55.11.887, PMID 11050256.
- Tracy Kidder, Mountains Beyond Mountains, New York, Random House Trade Paperbacks, 2004, ISBN 0-8129-7301-1.
- Clark Lawlor, Consumption and Literature, Basingstoke, Palgrave Macmillan, 2007, ISBN 0-230-02003-8.
- Nemery B, Yew WW, Albert R, et al, Tuberculosis, nontuberculous lung infection, pleural disorders, pulmonary function, respiratory muscles, occupational lung disease, pulmonary infections, and social issues in AJRCCM in 2004, in Am. J. Respir. Crit. Care Med., vol. 171, n. 6, 2005, pp. 554–62, DOI:10.1164/rccm.2412009, PMID 15753485.
- Ryan, Frank, The Forgotten Plague: How the Battle Against Tuberculosis Was Won — and Lost, Boston, MA, Little, Brown and Company, 1993 ISBN 0-316-76380-2. Pubblicato per la prima volta in Gran Bretagna col titolo Tuberculosis: The Greatest Story Never Told.
- Walton D, Farmer P, MSJAMA: the new white plague, in JAMA, vol. 284, n. 21, 2000, p. 2789, DOI:10.1001/jama.284.21.2789, PMID 11105192.
- Omodei Zorini Attilio e Mariani B., Terapia e profilassi della tubercolosi, capitolo 2 "Vaccinazione antitubercolare" di M. Lucchini e G. Spina, Torino, Minerva Medica, 1971
- editors-in-chief, Thomas M. Habermann, Amit K. Ghosh, Mayo Clinic internal medicine: concise textbook, Rochester, MN, Mayo Clinic Scientific Press, 2008, ISBN 978-1-4200-6749-1.
- [edited by] Gerald L. Mandell, John E. Bennett, Raphael Dolin, Mandell, Douglas, and Bennett's principles and practice of infectious diseases, 7th, Philadelphia, PA, Churchill Livingstone/Elsevier, 2010, ISBN 978-0-443-06839-3.
Voci correlate
modifica- Acnitis
- Artrite tubercolare
- Consorzio antitubercolare
- Dispensario antitubercolare di Alessandria
- Ex sanatorio antitubercolare di Salerno
- Infiltrato di Assman-Redker
- Istituto Trudeau
- Lega polmonare svizzera
- Megacolon
- Opera di prevenzione antitubercolare infantile
- Sanatorio antitubercolare Antonio Galateo
- Sovrappopolazione
- Storia della tubercolosi
- Tubercolosi postprimaria
- Tubercolosi intestinale
Altri progetti
modifica- Wikisource contiene una pagina sulla tubercolosi
- Wikiquote contiene citazioni sulla tubercolosi
- Wikizionario contiene il lemma di dizionario «tubercolosi»
- Wikimedia Commons contiene immagini o altri file sulla tubercolosi
Collegamenti esterni
modifica- (IT, DE, FR) Tubercolosi, su hls-dhs-dss.ch, Dizionario storico della Svizzera.
- (EN) tuberculosis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN, FR) Tubercolosi, su Enciclopedia canadese.
- (IT) Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute (CNESPS), Malattie infettive. Informazioni scientifiche epidemiologiche sulla tubercolosi (tubercolosi)
- (EN) Centers for Disease Control and Prevention (CDC), Divisione per l'Eliminazione della Tubercolosi. Curriculum Base sulla Tubercolosi: Quello che il Clinico Dovrebbe Sapere. 4ª edizione (2000). Aggiornata ad agosto 2003.
- (EN) Centers for Disease Control and Prevention (CDC), Divisione per l'Eliminazione della Tubercolosi News e aggiornamenti.
- (EN) Centers for Disease Control and Prevention (CDC), Divisione per l'Eliminazione della Tubercolosi Domande e risposte sulla TB, 2007.
- (EN) Agenzia per la Protezione della Salute, Inghilterra.
- (EN) Sito Web dei Premi Nobel. Gioco Educazionale sulla Tubercolosi.
- (EN) Organizzazione Mondiale della Sanità (OMS). Tubercolosi.
- Tuberculosis e HIV: conoscenze base dell'HIV capitolo Archiviato il 24 settembre 2014 in Internet Archive. e risorse collegate Archiviato il 15 novembre 2010 in Internet Archive..
- (EN) Mycobacterium tuberculosis SysbOrg all'Instituto della Genomica e della Biologia Integrativa.
- (EN) Iniziativa Open Source per la Scoperta dei Farmaci per la TB.
- (ES) Immagini da tubercolosi bovina, su flickr.com.
- storia della tubercolosi su PediatriaOnLine, dott. A. Semprini, su pediatria.it.
| Controllo di autorità | Thesaurus BNCF 7502 · LCCN (EN) sh85138408 · GND (DE) 4130621-1 · BNE (ES) XX527159 (data) · BNF (FR) cb119413462 (data) · J9U (EN, HE) 987007553657005171 · NSK (HR) 000064535 · NDL (EN, JA) 00565484 |
|---|