Microscopia con eccitazione di fluorescenza a due fotoni
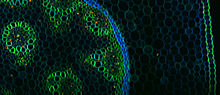
La microscopia con eccitazione a due fotoni (two-photon excitation microscopy, TPEF o 2PEF) è una tecnica di imaging a fluorescenza che consente l'acquisizione di tessuti viventi fino a circa un millimetro di spessore, con una risoluzione spaziale laterale di 0,64 µm e assiale di 3,35 µm.[1] A differenza della tradizionale microscopia a fluorescenza, in cui la lunghezza d'onda di eccitazione è più corta della lunghezza d'onda di emissione, l'eccitazione a due fotoni richiede l'assorbimento simultaneo di due fotoni con lunghezza d'onda maggiore della luce emessa. La microscopia con eccitazione a due fotoni utilizza tipicamente la luce di eccitazione nel vicino infrarosso (near-infrared, NIR) che può anche eccitare dye fluorescenti. Tuttavia, per ogni eccitazione, vengono assorbiti due fotoni di luce NIR. L'uso della luce infrarossa riduce al minimo la dispersione nel tessuto. A causa dell'assorbimento multifotonico, il segnale di fondo viene fortemente soppresso. Ciò permette a questa tecnica di raggiungere una maggiore profondità di penetrazione (penetration depth) nel campione. L'eccitazione a due fotoni può essere un'alternativa superiore alla microscopia confocale grazie alla sua penetrazione più profonda nei tessuti, all'efficiente rilevamento della luce e al ridotto photobleaching.[2][3]

L'eccitazione a due fotoni impiega l'assorbimento a due fotoni, un concetto descritto per la prima volta da Maria Goeppert Mayer (1906-1972) nella sua tesi di dottorato nel 1931,[4] e osservato per la prima volta nel 1961 da Wolfgang Kaiser usando l'eccitazione laser in un cristallo CaF2:Eu 2+.[5] Inoltre, Isaac Abella dimostrò nel 1962 nel vapore di cesio che è possibile l'eccitazione a due fotoni di singoli atomi.[6]
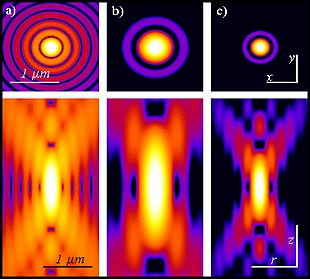
La microscopia con eccitazione di fluorescenza a due fotoni ha somiglianze con altre tecniche di microscopia laser confocale come la microscopia confocale a scansione laser e la microscopia Raman. Queste tecniche utilizzano raggi laser focalizzati scansionati in uno schema raster per generare immagini ed entrambe hanno un effetto di optical sectioning. A differenza dei microscopi confocali, i microscopi multifotonici non contengono pinhole, che conferisce al confocale la capacità di mettere a fuoco esclusivamente quanto presente sul piano focale. L'optical sectioning prodotto dal microscopio multifotonico è il risultato della point spread function di eccitazione: la point spread function di un microscopio multifotonico è tipicamente a forma di manubrio (più lunga nel piano xy), mentre la point spread function del microscopio confocale è a forma di palla da rugby. Il concetto di eccitazione a due fotoni si basa sull'idea che due fotoni, di energia fotonica relativamente inferiore a quella necessaria per l'eccitazione a un fotone, possano eccitare un fluoroforo in un evento quantistico. Ogni fotone trasporta circa la metà dell'energia necessaria per eccitare la molecola. L'eccitazione provoca la successiva emissione di un fotone di fluorescenza con la stessa resa quantica che risulterebbe dal convenzionale assorbimento di un singolo fotone. Il fotone emesso è tipicamente a un'energia più alta (lunghezza d'onda più corta) rispetto ai due fotoni eccitanti. La probabilità dell'assorbimento quasi simultaneo di due fotoni è estremamente bassa. Pertanto, è tipicamente richiesto un elevato flusso di fotoni di eccitazione, solitamente generato da un femtosecond pulsed laser. Lo scopo dell'utilizzo dell'eccitazione a due fotoni è che la diffusione assiale della point spread function sia significativamente inferiore a quella dell'eccitazione a singolo fotone. Di conseguenza, l'estensione lungo la dimensione z è migliorata, consentendo di acquisire sezioni ottiche sottili. Inoltre, in molti casi interessanti la forma e le dimensioni dello spot possono essere progettate per realizzare specifici obiettivi.[7] I laser di eccitazione a lunghezza d'onda maggiore e ad energia inferiore (tipicamente infrarossa) dei microscopi multifotonici, sono adatti per l'uso nell'imaging di cellule vive in quanto causano meno danni rispetto ai laser a lunghezza d'onda corta tipicamente utilizzati per l'eccitazione a singolo fotone, quindi le cellule possono essere osservate per periodi più lunghi con minore tossicità.
I fluorofori più comunemente usati hanno spettri di eccitazione tra 400 – 500 nm, mentre il laser utilizzato per eccitarne la fluorescenza con due fotoni si trova nel range di ~ 700 – 1000 nm (infrarossi) prodotta dai laser Ti-sapphire. Se il fluoroforo assorbe simultaneamente due fotoni infrarossi, acquisisce energia sufficiente per essere portato allo stato eccitato. Il fluoroforo emetterà quindi un singolo fotone con una lunghezza d'onda che dipende dal tipo di fluoroforo utilizzato (tipicamente nello spettro visibile). Poiché due fotoni vengono assorbiti durante l'eccitazione del fluoroforo, la probabilità di emissione fluorescente aumenta in modo quadratico con l'intensità di eccitazione. Pertanto, viene generata molta più fluorescenza a due fotoni dove il laser è strettamente focalizzato rispetto a dove è più diffuso. In effetti, l'eccitazione è limitata al minuscolo volume focale (~ 1 femtolitro), con conseguente omissione degli oggetti fuori fuoco. Questa localizzazione dell'eccitazione è il vantaggio chiave rispetto ai microscopi con eccitazione a singolo fotone, che devono impiegare elementi come la pinhole per escludere la fluorescenza fuori fuoco. La fluorescenza del campione viene quindi raccolta da un rivelatore ad alta sensibilità, come ad esempio un tubo fotomoltiplicatore (photomultiplier tube, PMT). Questa intensità di luce osservata diventa un pixel nell'immagine finale; il punto focale viene scansionato lungo la zona del campione desiderata per formare tutti i pixel dell'immagine.

La microscopia a due fotoni è stata sperimentata e brevettata da Winfried Denk e James Strickler nel laboratorio di Watt W. Webb alla Cornell University nel 1990. Combinarono infatti l'idea dell'assorbimento a due fotoni con l'uso di un laser scanner.[2][8]. Nella microscopia con eccitazione a due fotoni, un raggio laser infrarosso viene focalizzato attraverso un obiettivo. Il Ti-sapphire laser normalmente utilizzato ha una larghezza di impulso di circa 100 femtosecondi (fs) e una frequenza di ripetizione di circa 80 MHz, consentendo l'elevata densità di fotoni e il flusso richiesti per l'assorbimento di due fotoni, ed è inoltre sintonizzabile su un'ampia gamma di lunghezze d'onda. Per l'imaging del collagene sono stati impiegati anche laser mode-locked a fibra drogata con Yb, con impulsi da 325 fs, dimostrando una profondità di penetrazione di oltre 320 µm nel collagene, che è notevolmente superiore alle profondità dai 250 ai 300 µm ottenibili con l'eccitazione da parte di un tradizionale Ti-sapphire laser.
L'uso della luce infrarossa per eccitare i fluorofori nei tessuti che disperdono la luce ha addizionali vantaggi.[9] Le lunghezze d'onda più lunghe sono disperse in misura minore rispetto a quelle più corte, il che è un vantaggio per l'imaging ad alta risoluzione. Inoltre, è meno probabile che questi fotoni a bassa energia causino danni al di fuori del volume focale. Rispetto a un microscopio confocale, il rilevamento dei fotoni è molto più efficace poiché anche i fotoni dispersi contribuiscono al segnale utilizzabile. Questi vantaggi per l'imaging nei tessuti ad alto scattering sono stati riconosciuti solo diversi anni dopo l'invenzione della microscopia con eccitazione a due fotoni.[10]
Esistono diversi avvertimenti sull'utilizzo della microscopia a due fotoni: i pulsed lasers necessari per l'eccitazione a due fotoni sono molto più costosi dei laser a onda continua (continuous wave, CW) utilizzati nella microscopia confocale. Lo spettro di assorbimento a due fotoni di una molecola può variare significativamente dalla sua controparte a un fotone. Il fotodanneggiamento di ordine superiore diventa un problema e il bleaching è proporzionale al quadrato della potenza del laser, mentre è lineare per l'eccitazione a singolo fotone (confocale). Per oggetti molto sottili come singole cellule, i microscopi a singolo fotone (confocale) possono produrre immagini con una risoluzione ottica più elevata grazie alle loro lunghezze d'onda di eccitazione più corte. Invece, nei tessuti, che disperdono maggiormente la luce, le superiori capacità di optical sectioning e di rilevamento della luce del microscopio a due fotoni si traducono in prestazioni migliori.
Applicazioni
modificaPrincipale
modificaLa microscopia a due fotoni è stata applicata in numerosi campi tra cui: fisiologia, neurobiologia, embriologia e ingegneria dei tessuti. Anche i tessuti sottili e quasi trasparenti (come le cellule della pelle) sono stati visualizzati con dettagli chiari grazie a questa tecnica.[11] Le capacità di imaging ad alta velocità della microscopia a due fotoni possono essere utilizzate anche nella biopsia ottica non invasiva.[12] Nella biologia cellulare, la microscopia a due fotoni è stata opportunamente utilizzata per produrre reazioni chimiche localizzate.[10] È stato dimostrato che le molecole organiche porphyrin-type possono avere diversi momenti di dipolo di transizione per la fluorescenza a due fotoni e la second-harmonic generation (SHG),[13] che altrimenti si pensa che si verifichino dallo stesso momento di dipolo di transizione.[14] È stato dimostrato che l'eccitazione non degenerativa a due fotoni, ossia l'utilizzo di 2 fotoni di lunghezze d'onda diverse, aumenta la fluorescenza di tutte le small molecules e proteine fluorescenti testate.[15]
Ricerca sul cancro
modificaIl 2PEF si è anche dimostrato molto prezioso per caratterizzare il cancro della pelle.[16] È stato anche dimostrato che è in grado di rivelare l'arresto delle cellule tumorali, l'interazione tra cellule tumorali e piastrine, l'interazione cellule tumorali e leucociti ed i processi di colonizzazione metastatica.[17]
Ricerca embrionale
modifica2PEF ha dimostrato di essere vantaggioso rispetto ad altre tecniche, come la microscopia confocale, quando si tratta di imaging di cellule vive a lungo termine in embrioni di mammiferi.[18]
Ricerca sui reni
modifica2PEF è stato utilizzato anche nella visualizzazione di tipi di cellule di difficile accesso, in particolare per quanto riguarda le cellule renali.[19] È stato utilizzato per comprendere meglio la dinamica dei fluidi e la filtrazione.[20]
Neuroscienze
modifica2PEF e 3PEF sono usati per caratterizzare i tessuti neurali intatti. In particolare, è vantaggioso nell'imaging del calcio nei neuroni e nella rimozione localizzata del glutammato[21]
Imaging cerebrale in vivo
modificaLa fluorescenza multifotonica (2PEF e 3PEF) è un mezzo utile per l'imaging del cervello in vivo.[22][23] Questo perché queste tecniche di imaging eccellono nell'imaging in profondità in tessuti ad alta dispersione. Attualmente, la microscopia a due fotoni è ampiamente utilizzata per visualizzare l'attivazione dal vivo dei neuroni in organismi modello tra cui moscerini della frutta (Drosophila melanogaster), topi (Mus musculus) e zebrafish .[24][25][26]
Eccitazione di ordine superiore
modificaÈ anche possibile l'assorbimento simultaneo di tre o più fotoni, consentendo la microscopia di eccitazione multifotonica di ordine superiore.[27] La cosiddetta "microscopia a fluorescenza con eccitazione a tre fotoni" (3PEF) è la tecnica più utilizzata dopo la 2PEF, alla quale è complementare.
Dye e proteine fluorescenti per microscopia con eccitazione a due fotoni
modificaIn generale, tutte le proteine fluorescenti comunemente utilizzate (CFP, GFP, YFP, RFP) e le dye possono essere eccitati in modalità due fotoni. Gli spettri di eccitazione a due fotoni sono spesso considerevolmente più ampi, rendendo più difficile eccitare selettivamente i fluorofori cambiando le lunghezze d'onda di eccitazione.
Sono stati segnalati diverse dye emettenti nel verde, rosso e NIR (sonde e reactive lables) con cross-section di assorbimento a 2 fotoni estremamente elevate.[28] A causa della struttura di tipo donatore-accettore-donatore, le squaraine dyes come Seta-670, Seta-700 e Seta-660 presentano efficienze di assorbimento a 2 fotoni (2PA) molto elevate rispetto ad altre dye,[28][29][30] SeTau-647 e SeTau-665, un nuovo tipo di squaraine-rotaxane, presentano cross-section di azione a due fotoni estremamente elevate fino a 10.000 GM nella regione del vicino IR, inequiparate da qualsiasi altra classe di coloranti organici.[28]
Note
modifica- ^ vol. 14, DOI:10.1038/nmeth.4305, PMID 28553965, https://oadoi.org/10.1038/nmeth.4305.
- ^ a b vol. 248, DOI:10.1126/science.2321027, PMID 2321027, https://oadoi.org/10.1126/science.2321027.
- ^ 2017, pp. 642–686, DOI:10.2174/9781681085180117010023, ISBN 978-1-68108-518-0.
- ^ Goeppert-Mayer M., Über Elementarakte mit zwei Quantensprüngen, in Annals of Physics, vol. 9, n. 3, 1931, pp. 273–95, DOI:10.1002/andp.19314010303.
- ^ Kaiser, Two-Photon Excitation in CaF2:Eu2+, in Physical Review Letters, vol. 7, n. 6, pp. 229–231, DOI:10.1103/PhysRevLett.7.229.
- ^ Abella, Optical Double-Photon Absorption in Cesium Vapor, in Physical Review Letters, vol. 9, n. 11, pp. 453–455, DOI:10.1103/PhysRevLett.9.453.
- ^ Ido Kaminer, Optimizing 3D multiphoton fluorescence microscopy, in Optics Letters, vol. 38, n. 19, 2013, pp. 3945–3948, DOI:10.1364/OL.38.003945, PMID 24081095.
- ^ Winifried Denk, James H. Strickler e Watt W. Webb, Two-Photon Laser Scanning Fluorescence Microscopy, in Science, vol. 248, n. 4951, 6 aprile 1990, pp. 73–76, Bibcode:1990Sci...248...73D, DOI:10.1126/science.2321027, PMID 2321027.
- ^ vol. 2, 2005, DOI:10.1038/nmeth818, PMID 16299478, https://oadoi.org/10.1038/nmeth818.
- ^ a b vol. 54, 1994, DOI:10.1016/0165-0270(94)90189-9, PMID 7869748, https://oadoi.org/10.1016/0165-0270(94)90189-9.
- ^ vol. 72, 1997, DOI:10.1016/s0006-3495(97)78886-6, PMID 9168018, https://oadoi.org/10.1016/s0006-3495(97)78886-6.
- ^ vol. 23, DOI:10.1364/ol.23.000655, PMID 18087301, https://oadoi.org/10.1364/ol.23.000655.
- ^ vol. 15, 2017, DOI:10.1039/C6OB02319C, PMID 28054076, https://oadoi.org/10.1039/C6OB02319C.
- ^ vol. 103, 2012, DOI:10.1016/j.bpj.2012.08.003, PMID 23009840, https://oadoi.org/10.1016/j.bpj.2012.08.003.
- ^ vol. 27, DOI:10.1364/OE.27.028022, PMID 31684560, https://oadoi.org/10.1364/OE.27.028022.
- ^ vol. 28, DOI:10.1016/j.sder.2009.06.007, PMID 19782943, https://oadoi.org/10.1016/j.sder.2009.06.007.
- ^ vol. 6, PMID 24936213.
- ^ (EN) Long-term two-photon fluorescence imaging of mammalian embryos without compromising viability, in Nature Biotechnology, vol. 17, n. 8, agosto 1999, pp. 763–767, DOI:10.1038/11698, ISSN 1546-1696, PMID 10429240.
- ^ (EN) vol. 38, DOI:10.1017/S0033583505004129, ISSN 1469-8994, https://www.cambridge.org/core/journals/quarterly-reviews-of-biophysics/article/abs/twophoton-fluorescence-excitation-and-related-techniques-in-biological-microscopy/DBA4A3240D635730F5C9F59647D9974F.
- ^ (EN) vol. 72, DOI:10.1038/sj.ki.5002315, ISSN 0085-2538, PMID 17538570, https://www.sciencedirect.com/science/article/pii/S0085253815526689.
- ^ Principles of Two-Photon Excitation Microscopy and Its Applications to Neuroscience, in Neuron, vol. 50, n. 6, giugno 2006, pp. 823–839, DOI:10.1016/j.neuron.2006.05.019, PMID 16772166.
- ^ In vivo three-photon microscopy of subcortical structures within an intact mouse brain, in Nature Photonics, vol. 7, n. 3, marzo 2013, pp. 205–209, DOI:10.1038/nphoton.2012.336, PMID 24353743.
- ^ A review of imaging techniques for systems biology, in BMC Systems Biology, vol. 2, 12 agosto 2008, pp. 74, DOI:10.1186/1752-0509-2-74, ISSN 1752-0509, PMID 18700030.
- ^ Two‐Photon Excitation Microscopy for the Study of Living Cells and Tissues, in Current Protocols in Cell Biology, vol. 59, n. 1, giugno 2013, pp. Unit 4.11.1–24, DOI:10.1002/0471143030.cb0411s59, PMID 23728746.
- ^ Long-term optical brain imaging in live adult fruit flies, in Nature Communications, vol. 9, n. 1, dicembre 2018, pp. 872, DOI:10.1038/s41467-018-02873-1, PMID 29491443.
- ^ High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy, in Nature Methods, vol. 18, n. 9, settembre 2021, pp. 1103–1111, DOI:10.1038/s41592-021-01239-8, PMID 34462592.
- ^ C Xu, Multiphoton fluorescence excitation: new spectral windows for biological nonlinear microscopy., vol. 93, 1º ottobre 1996, DOI:10.1073/pnas.93.20.10763, PMID 8855254.
- ^ a b c vol. 7, DOI:10.1371/journal.pone.0051980, PMID 23251670, https://oadoi.org/10.1371/journal.pone.0051980.
- ^ vol. 80, DOI:10.1021/ac801106w, PMID 18800850, https://oadoi.org/10.1021/ac801106w.
- ^ Springer Series on Fluorescence, vol. 8, 2010, pp. 105–147, DOI:10.1007/978-3-642-04702-2_4, ISBN 978-3-642-04700-8.
Bibliografia
modifica- Michael Schmitt, Thomas Mayerhöfer, Jürgen Popp, Ingo Kleppe e Klaus Weisshart, Light-Matter Interaction, in Handbook of Biophotonics, 2013, DOI:10.1002/9783527643981.bphot003, ISBN 978-3-527-64398-1.
- Karsten König, Multiphoton Microscopy and Fluorescence Lifetime Imaging: Applications in Biology and Medicine, Walter de Gruyter GmbH & Co KG, 2018, ISBN 978-3-11-042998-5.
- Adib Keikhosravi, Jeremy S. Bredfeldt, Abdul Kader Sagar e Kevin W. Eliceiri, Second-harmonic generation imaging of cancer, in Quantitative Imaging in Cell Biology, Methods in Cell Biology, vol. 123, 2014, pp. 531–546, DOI:10.1016/B978-0-12-420138-5.00028-8, ISBN 978-0-12-420138-5, PMID 24974046.
- Hanry Yu e Nur Aida Abdul Rahim, Imaging in Cellular and Tissue Engineering, CRC Press, 2013, ISBN 978-1-4398-4804-3.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su microscopia di fluorescenza con eccitazione a due fotoni
Collegamenti esterni
modifica- http://www.twophotondyes.com/[collegamento interrotto]
- introduzione alla microscopia multifotonica
- Acquisizione di più immagini in tempo reale per la microscopia a scansione laser (articolo sulla microscopia Sanderson)
- Costruisci il tuo microscopio a 2 fotoni Video-Rate
- Microscopia ottica a fluorescenza a due fotoni, ENCICLOPEDIA DELLE SCIENZE DELLA VITA
- (EN) Multiphoton Fluorescence Microscopy, in Microscopy Primer, Florida State University. URL consultato il 3 marzo 2018.
- Microscopia a fluorescenza con eccitazione a più fotoni. Archiviato il 2 febbraio 2009 in Internet Archive. Università del Wisconsin.
- Fondamenti e applicazioni nella microscopia di eccitazione multifotonica . Microscopia NikonU.
- Two-photon action cross sections, su zipfellab.bme.cornell.edu. URL consultato il 10 gennaio 2023 (archiviato dall'url originale il 9 gennaio 2023).
- Two-photon absorption (2PA) spectra database, su KBFI.