Plicamicina
La plicamicina (o mitramicina) è un antibiotico antineoplastico prodotto da Streptomyces argillaceus, S. plicatus e S. tanashiensis. È un inibitore della sintesi dell'RNA.[1][2]
| plicamicina | |
|---|---|
 | |
| Nome IUPAC | |
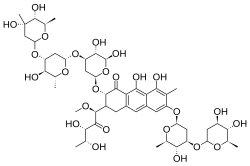
| (1S)-5-deossi-1-C-((2S,3S)-7-{[2,6-dideossi-3-O-(2,6-dideossi-β-D-arabino-esopiranosil)-β-D-arabino-esopiranosil]ossi}-3-{[2,6-dideossi-3-C-metil-β-D-ribo-esopiranosil-(1→3)-2,6-dideossi-β-D-arabino-esopiranosil-(1→3)-2,6-dideossi-β-D-arabino-esopiranosil]ossi}-5,10-diidrossi-6-metil-4-oxo-1,2,3,4-tetraidroantracen-2-il)-1-O-metil-D-xilulosio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C52H76O24 |
| Massa molecolare (u) | 1085,15 |
| Numero CAS | |
| Numero EINECS | 634-048-4 |
| Codice ATC | L01 |
| PubChem | 5284610 |
| DrugBank | DBDB06810 |
| SMILES | CC1C(C(CC(O1)OC2CC(OC(C2O)C)OC3=CC4=CC5=C(C(=O)C(C(C5)C(C(=O)C(C(C)O)O)OC)OC6CC(C(C(O6)C)O)OC7CC(C(C(O7)C)OC8CC(C(C(O8)C)O)(C)O)O)C(=C4C(=C3C)O)O)O)O |
| Dati farmacologici | |
| Modalità di somministrazione | Endovenosa |
| Indicazioni di sicurezza | |
Stabilità e conservazione
modificaLa plicamicina deve essere conservata in recipienti ben chiusi, al riparo dalla luce e a una temperatura compresa tra 2 e 8 °C.
Farmacodinamica
modificaLa plicamicina è un antibiotico molto tossico dotato di proprietà antineoplastiche ed ipocalcemiche. In presenza di cationi bivalenti (specialmente magnesio), sembra agire formando un complesso con il DNA tramite l'interazione con la guanina (presente soprattutto a livello dei promotori), inibendo la sintesi dell'acido ribonucleico e quindi l'espressione genica.[3] La plicamicina è dotata di attività batteriostatica nei confronti dei germi Gram-positivi, ma la sua citotossicità ne preclude l'uso come agente antisettico. L'azione ipocalcemica sembra essere dovuta all'inibizione dell'attività dell'ormone paratiroideo sugli osteoclasti.
Farmacocinetica
modificaA seguito di infusione per via endovenosa la plicamicina si diffonde rapidamente nei tessuti corporei, concentrandosi soprattutto nelle aree di riassorbimento attivo dell'osso. Il farmaco attraversa anche la barriera ematoencefalica. Dopo somministrazione endovenosa di plicamicina radioattiva in un paziente con glioblastoma si è osservato che a distanza di 4-6 ore le concentrazioni di farmaco nel sangue e nel liquido cefalorachidiano erano circa le stesse. L'eliminazione dall'organismo avviene prevalentemente per via urinaria. Circa il 25% di una dose somministrata è escreto nelle urine in 2 ore e circa il 40% nell'arco di 15 ore.
Tossicologia
modificaStudi sperimentali sugli animali (topo e ratto) hanno messo in evidenza valori di DL50 pari rispettivamente a 2,14 mg/kg peso corporeo e 1,74 mg/kg, quando il composto viene somministrato per endovena.
Usi clinici
modificaLa plicamicina è impiegata nel trattamento delle ipercalcemie ed ipercalciurie associate a neoplasie maligne. Il farmaco è inoltre utilizzato nel trattamento di tumori maligni del testicolo non sensibili ad intervento chirurgico o a radioterapia.[4][5][6][7] La plicamicina è stata sperimentata nella malattia di Paget,[8] anche se come farmaco di seconda o terza scelta, e nel glioblastoma.[9][10]. L'antibiotico è stato testato anche peril trattamento della leucemia mieloide cronica.[11] L'antibiotico deve avere una potenza non inferiore a 900 µg per mg di base anidra.
Effetti collaterali
modificaIl principale effetto collaterale della plicamicina è una sindrome emorragica dose-correlata: questa si manifesta inizialmente come epistassi, ma può progredire a ematemesi e a emorragie potenzialmente fatali. Il farmaco sembra interferire con i fattori della coagulazione ematica.
La plicamicina può causare una grave trombocitopenia, mentre la leucopenia è relativamente poco comune. Durante il trattamento con plicamicina sono frequenti i disturbi gastrointestinali (dispepsia, nausea, vomito, dolore addominale, diarrea). Altri effetti avversi sono febbre, malessere, sonnolenza, sedazione, letargia, debolezza, cefalea, depressione, rash cutaneo, flushing e diminuzione di calcemia, fosforemia e kaliemia. Sono state descritte anche insufficienza renale ed epatica reversibili.[12]
Lo stravaso delle soluzioni di plicamicina può causare irritazione locale, cellulite e flebite.[13] L'applicazione di calore moderato a livello del sito di stravaso può favorire la dispersione dell'antibiotico, diminuendo quindi l'irritazione locale.
Controindicazioni
modificaLa plicamicina dovrebbe essere somministrata con grande cautela ai pazienti con insufficienza epatica e renale. Il farmaco è controindicato in caso di trombocitopenia o depressione del midollo osseo, disturbi della coagulazione o tendenze all'emorragia, per qualsiasi causa. Durante il trattamento con il farmaco, e per molti giorni dopo l'interruzione, si dovrebbero monitorare la crasi ematica, il tempo di sanguinamento, il tempo di protrombina, la funzionalità renale ed epatica. In caso di modificazione di tali parametri il trattamento dovrebbe essere interrotto.
Il farmaco è controindicato durante la gravidanza e l'allattamento al seno.
Dosi terapeutiche
modificaNel trattamento sintomatico dell'ipercalcemia maligna il farmaco viene somministrato per infusione lenta (4-6 ore) alla dose usuale di 25 µg/kg/die, dopo diluizione in 1 litro di soluzione glucosata al 5% o di soluzione fisiologica. La somministrazione può essere ripetuta per 3-4 giorni e si possono effettuare ulteriori cicli, generalmente ad intervalli settimanali.
Nelle neoplasie maligne del testicolo la dose usuale è di 25-30 µg/kg/die per infusione lenta, da somministrare per 8-10 giorni. Le dosi possono essere somministrate anche a giorni alterni e il ciclo terapeutico può essere ripetuto ad intervalli mensili.
Interazioni
modifica- Diuretici (furosemide, idroclorotiazide ed altri): la terapia di associazione con plicamicina deve essere evitata in quanto espone ad un incremento del rischio di peggioramento dello squilibrio elettrolitico.
Avvertenze
modificaIl composto deve essere maneggiato con attenzione dal personale sanitario addetto alla preparazione delle soluzioni iniettabili, sia per il rischio di tossicità locale da contatto e di reazioni allergiche, sia per i rischi di carcinogenicità che di mutagenicità.[14][15]
Note
modifica- ^ Mithramycin A, su fermentek.co.il, Fermentek. URL consultato il 15 maggio 2013 (archiviato dall'url originale il 7 maggio 2013).
- ^ AA. Kusch, GE. Fedoseeva; OA. Kiseleva; AV. Zelenin, [Comparative analysis of mechanisms of biological action of antibiotics from the aureolic acid group and their derivatives]., in Antibiotiki, vol. 17, n. 6, Giu 1972, pp. 504-13, PMID 5045917.
- ^ S. Majee, A. Chakrabarti, Membrane interaction of an antitumor antibiotic, mithramycin, with anionic phospholipid vesicles., in Biochem Pharmacol, vol. 57, n. 9, Mag 1999, pp. 981-7, PMID 10796068.
- ^ Kennedy BJ, Torkelson JL, Long-term follow-up of stage III testicular carcinoma treated with mithramycin (plicamycin), in Med. Pediatr. Oncol., vol. 24, n. 5, maggio 1995, pp. 327–8, DOI:10.1002/mpo.2950240511, PMID 7700186.
- ^ John H. Brown e B. J. Kennedy, Mithramycin in the Treatment of Disseminated Testicular Neoplasms, in New England Journal of Medicine, vol. 272, n. 3, 1965, pp. 111–8, DOI:10.1056/NEJM196501212720301, PMID 14224214.
- ^ S. Kofman, TJ. Medrek; RW. Alexander, Mithramycin in the treatment of embryonal cancer., in Cancer, vol. 17, Lug 1964, pp. 938-48, PMID 14179556.
- ^ H. Gremmel, W. Schulte-Brinkmann, [Malignant testicular tumors. Results of the treatment using surgery, ionizing radiation and cytostatic agents]., in Radiologe, vol. 4, Lug 1964, pp. 209-20, PMID 14250288.
- ^ JL. Stumpf, Pharmacologic management of Paget's disease., in Clin Pharm, vol. 8, n. 7, Lug 1989, pp. 485-95, PMID 2666012.
- ^ T Hall, M Schaeublin e TJ Chambers, The Majority of Osteoclasts Require mRNA and Protein Synthesis for Bone Resorption in Vitro, in Biochemical and Biophysical Research Communications, vol. 195, n. 3, 1993, pp. 1245–53, DOI:10.1006/bbrc.1993.2178, PMID 8216256.
- ^ Lily L. Remsing, Hamid R. Bahadori, Giuseppina M. Carbone, Eileen M. McGuffie, Carlo V. Catapano e Jürgen Rohr, Inhibition of c-src Transcription by Mithramycin: Structure−Activity Relationships of Biosynthetically Produced Mithramycin Analogues Using the c-src Promoter as Target, in Biochemistry, vol. 42, n. 27, 2003, pp. 8313–24, DOI:10.1021/bi034091z, PMID 12846580.
- ^ Dutcher JP, Coletti D, Paietta E, Wiernik PH, A pilot study of alpha-interferon and plicamycin for accelerated phase of chronic myeloid leukemia, in Leuk. Res., vol. 21, n. 5, maggio 1997, pp. 375–80, DOI:10.1016/S0145-2126(96)00108-7, PMID 9225062.
- ^ RG. Benedetti, KJ. Heilman; PA. Gabow, Nephrotoxicity following single dose mithramycin therapy., in Am J Nephrol, vol. 3, n. 5, pp. 277-8, PMID 6227249.
- ^ ME. MacCara, Extravasation: a hazard of intravenous therapy., in Drug Intell Clin Pharm, vol. 17, n. 10, Ott 1983, pp. 713-7, PMID 6628223.
- ^ PF. D'Arcy, Reactions and interactions in handling anticancer drugs., in Drug Intell Clin Pharm, vol. 17, n. 7-8, pp. 532-8, PMID 6872848.
- ^ GP. Kaijser, WJ. Underberg; JH. Beijnen, The risks of handling cytotoxic drugs. II. Recommendations for working with cytotoxic drugs., in Pharm Weekbl Sci, vol. 12, n. 6, Dic 1990, pp. 228-35, PMID 2091018.
Bibliografia
modifica- J.C. Stevenson, Prescribers' J. 31, 98, 1991