Nicarbazina
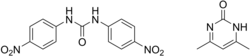
Dal punto di vista chimico, la nicarbazina è un complesso equimolare formato da 1,3 - bis (4- nitrofenil) urea e da 4 - 6 dimetil-2- (1H) - pirimidinone detti anche 4,4'- dinitrocarbanilide (DNC) e 2-idrossi - 4,6 dimetilpirimidina (HDP).
| Nicarbazina | |
|---|---|
 | |
| Nome IUPAC | |
| 1,3-bis(4-nitropenil)urea; 4,6-dimetil-1H-pirimidin-2-one | |
| Nomi alternativi | |
| C19H18N6O6 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C19H18N6O6 |
| Massa molecolare (u) | 426,38 |
| Aspetto | polvere gialla o bianca |
| Numero CAS | |
| Numero EINECS | 206-359-1 |
| PubChem | 9507 |
| DrugBank | DBDB11434 |
| SMILES | CC1=CC(=NC(=O)N1)C.C1=CC(=CC=C1NC(=O)NC2=CC=C(C=C2)[N+](=O)[O-])[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 46 ppb (ph 7) |
| Indicazioni di sicurezza | |
Il DNC rappresenta la parte biologicamente attiva del complesso, ma per essere assorbito deve essere legato al HDP (1). A causa della sua natura idrofobica il DNC da solo è scarsamente assorbito e presenta una limitata “disponibilità biologica” per cui, a seguito di somministrazione orale, sarebbe eliminato senza essere assorbito. Il DNC necessita quindi dell'HDP per essere assorbito e per raggiungere un livello plasmatico che permetta un effetto nella specie bersaglio.
A seguito di somministrazione orale, la nicarbazina si dissocia rapidamente in vivo nelle sue due componenti HDP e DNC, che seguono differenti vie di escrezione: HDP viene eliminato rapidamente per il 95% con le urine, mentre DNC permane più a lungo ed è eliminato prevalentemente con le feci.
Il metabolismo e la deplezione dei due componenti sono stati studiati approfonditamente con l'utilizzo di nicarbazina marcata con Carbonio-14 (2). A seguito di somministrazione orale, la nicarbazina si dissocia rapidamente in vivo nelle sue due componenti HDP e DNC, che sono assorbite attraverso l'intestino, passando quindi nel sangue, e seguono differenti vie di escrezione. L'HDP è escreto più rapidamente del DNC, principalmente attraverso i reni tramite le urine, mentre il DNC è assorbito più rapidamente del HDP ed è escreto, più lentamente di quest'ultimo, attraverso il fegato, tramite le feci (3). Nessun residuo significativo di entrambi i componenti è apprezzabile in qualsiasi tessuto dopo 7 giorni. Il DNC si accumula nelle uova e normalmente la concentrazione del DNC nelle uova è inferiore a 5 ppm.
Le due componenti HDP e DNC non subiscono metabolizzazione in vivo ed in vitro, se si eccettua la formazione di derivati strutturalmente analoghi alla nitroanilina. Questa possibilità appare comunque estremamente remota, realizzabile solo in laboratorio, in particolari condizioni chimico-fisiche (elevata temperatura in ambiente fortemente acido) (4).
Dei due componenti la molecola della nicarbazina, il DNC assume un significato dal punto di vista tossicologico in quanto permane più a lungo nell'organismo. La molecola di DNC è stata pertanto considerata come composto marker negli studi sui residui.
Attività
modificaLa nicarbazina, da lungo tempo presente sul mercato mondiale, è il prodotto di prima scelta come coccidiostatico, per la sua sicurezza di impiego, nell'allevamento del pollo da carne.
L'uso di nicarbazina come coccidiostatico ha messo in evidenza, anche se in forma completamente reversibile, un effetto inibente le funzioni produttive e riproduttive delle galline ovaiole, con conseguente riduzione della produzione di uova e del loro peso e la diminuzione della capacità di schiusa.
Gli effetti depressivi sulla ovulazione riscontrati nel pollame hanno costituito le basi razionali per lo sviluppo di un preparato, contenente nicarbazina, utilizzato per il controllo delle nascite nella popolazione dei piccioni randagi.
Attività coccidiostatica
modificaLa nicarbazina è attiva su alcune specie di Emeria con diversa sensibilità. A differenza di altri coccidiostatici, la nicarbazina presenta solo raramente fenomeni di resistenza nei riguardi delle più comuni coccidiosi come ad esempio quelle sostenute da Emeria tenella.
La dose di nicarbazina generalmente utilizzata nella prevenzione della coccidiosi cecale ed intestinale dei polli è pari a 125 ppm nel mangime.
La nicarbazina è spesso utilizzata in associazione con antibiotici ionofori per aumentarne lo spettro di attività e ridurne il fenomeno della resistenza.
Effetti sulla funzione riproduttiva nei polli
modificaLa somministrazione di nicarbazina nelle galline ovaiola è stata associata alla riduzione nella produzione e nel peso delle uova. La dose minima che si è dimostrata in grado di produrre questi effetti è stata quella di 50 ppm sul peso delle uova e di 70 ppm sulla produzione di uova (5). L'intensità di questi effetti è risultata correlata alla dose e alla durata del periodo di trattamento. Il trattamento con nicarbazina per una settimana, alla concentrazione di 125 ppm, ha ridotto del 50% la produzione di uova (6), mentre, alla dose di 400 ppm, la produzione di uova veniva totalmente soppressa (7).
Il meccanismo per il quale si riduce la produzione delle uova sembra essere il risultato di una ridotta sensibilità ipotalamica al progesterone esogeno, mentre rimane intatta la capacità dell'ipofisi di rispondere al fattore di escrezione luteinica (LHRF) (8).
Si è ipotizzato che la nicarbazina non solo potesse prevenire la deposizione dei costituenti del tuorlo nell'ovaio, ma che fosse anche in grado di contrastare la funzione stimolante dell'ipotalamo, probabilmente per un assetto ormonale non adeguato. L'iniezione di LHRF in animali trattati con nicarbazina, determina una immediata ed elevata concentrazione plasmatica di LH dovuta al rilascio da parte dell'ipofisi di LH precedentemente accumulato per la mancanza di stimolo ipotalamico.
Durante il trattamento con nicarbazina, il materiale costituente il tuorlo continua ad essere prodotto dal fegato, ma non viene depositato nel follicolo ovarico con conseguente riassorbimento che determina ipercolesterolemia (9) e ipertrofia epatica (8).
Il riassorbimento del materiale che forma il tuorlo è ulteriormente dimostrato dal fatto che le galline ovaiole alimentate con nicarbazina presentano ipercolesterolemia, mentre nei maschi o nelle femmine non ovaiole la colesterolemia rimane normale anche durante il trattamento con nicarbazina (9).
Studi recenti hanno messo in evidenza che il meccanismo d'azione della nicarbazina è correlato all'inibizione dei siti recettoriali spermatici ZP3 (10)
Questi effetti sulla produzione e il peso delle uova si sono dimostrati reversibili. La normale produzione riprende da una a tre settimane dopo la fine del trattamento con nicarbazina (9; 11). Le uova ritornano di dimensione normale entro dieci giorni circa (12).
Riduzione della schiusa delle uova
modificaLa nicarbazina somministrata alle galline non ha effetto sulla fertilità o sulla sopravvivenza dei pulcini. L'effetto principale è costituito dall'aumento della mortalità degli embrioni nei primi sette giorni (5).
Il meccanismo d'azione della nicarbazina richiede che l'uccello ingerisca l'esca in quantità sufficiente per raggiungere una concentrazione ematica tale di DNC che possa successivamente permettere il suo deposito nel tuorlo delle uova in via di formazione. Sono necessari 5-7 giorni per raggiungere il livello ematico che permette l'assorbimento nel tuorlo. Nella gallina ovaiola, come in quasi tutti i volatili, l'uovo richiede circa 14 giorni per svilupparsi prima di essere depositato. Durante lo sviluppo dell'uovo rivestono una particolare importanza gli ultimi 5-7 giorni, periodo in cui il tuorlo raggiunge il suo massimo sviluppo, l'albume ed il guscio vengono completati e l'uovo viene depositato (13, 10). L'interferenza con la schiusa dell'uovo si ottiene solo se l'animale target consuma una dose efficace di esca durante questo periodo di sviluppo dell'uovo.
Il livello minimo di dose che influisce sulla schiusa è da 10 a 20 ppm (14; 5). Aumentando il dosaggio, gli effetti sulla schiusa aumentano. A 20 ppm la capacità di schiusa si riduce di circa il 20%, da 50 a 125 ppm di circa il 50%. Le uova di galline trattate con 700 ppm di nicarbazina non si schiudono.
La schiusa ritorna normale da 7 a 21 giorni dopo la sospensione della nicarbazina (14; 5).
Effetti sulla funzione riproduttiva del piccione
modificaLo sviluppo numerico incontrollato di colonie di colombi nelle area urbane comporta problemi di tipo sanitario per l'uomo e per altri animali e mette a rischio l'integrità del patrimonio edilizio e monumentale delle città.
Gli effetti limitanti la capacità riproduttiva, che si sono evidenziati nelle galline ovaiole in seguito a trattamento con nicarbazina, hanno suggerito l'impiego di questo composto per il controllo delle nascite nei colombi.
In uno studio condotto nel 1993 (16) sono state utilizzate 40 coppie di colombi suddivise in 4 gruppi e trattate con mangime medicato con nicarbazina alle dosi di 0, 50, 230 e 400 ppm per un periodo di 120 giorni.
Al 100% di uova fertili con nascita di altrettanti pulcini nel gruppo di controllo (0 ppm), hanno corrisposto percentuali di fertilità del 33,3% a 50 ppm, del 43,3% a 230 ppm, mentre la fertilità risultava azzerata al dosaggio più elevato (400 ppm).
I risultati ottenuti appaiono legati alle modificazioni morfofunzionali evidenziati a carico dell'apparato riproduttore degli animali sacrificati anche se la loro entità non sembra proporzionale ai dosaggi. Il trattamento non sembra aver modificato lo stato di salute generale degli animali. Le indagini biochimiche ed anatomopatologiche hanno escluso danni anatomici ai dosaggi impiegati, mentre è stato confermato il carattere di reversibilità delle modificazioni funzionali a carico dell'apparato riproduttore.
Uno studio, condotto da Chelazzi (17) nel distretto di Firenze, con l'obiettivo di valutare gli effetti della nicarbazina sulla consistenza numerica dei piccioni in diverse aree, prevedeva un trattamento degli animali con granella di mais addizionata con nicarbazina (800 ppm) durante il periodo compreso tra la fine di febbraio e l'inizio di ottobre, con una dose giornaliera di 10 g/capo per 5 giorni alla settimana.
I risultati ottenuti mostrarono chiaramente che la somministrazione di nicarbazina portava ad una riduzione del numero dei piccioni formanti colonie senza la presenza di effetti letali.
Bursi (18), in prove di campo svolte nel corso degli anni 1997-1998, sottolinea come la somministrazione di un mangime costituito da chicchi di mais rivestiti in superficie con nicarbazina ad una concentrazione di 800 ppm, da febbraio a ottobre con un dosaggio di 30 g/capo/giorno (24 mg di nicarbazina/capo/giorno) a piccioni individuati nei centri urbani di Parma, Forlì, Carpi e San Felice s/P, permette di raggiungere risultati interessanti riguardanti l'attività di questo ingrediente attivo.
Infatti i censimenti effettuati nei tre mesi seguenti il trattamento, con la stessa metodologia utilizzata prima del trattamento, hanno evidenziato una significativa riduzione dei colombi randagi all'interno dell'ambiente urbano, che interessa prima di tutto i “novelli” dell'anno, e un valore di mortalità delle singole colonie normale per la specie e le condizioni ambientali, senza effetti tossici dovuti al trattamento con nicarbazina, che le indagini necroscopiche e batteriologice effettuate sugli animali gravemente malati o deceduti nel corso dello studio hanno attribuito invece a malattie infettive tipiche della specie
Infine, Ferri (19) ha somministrato a 552 colonie, per un totale di 85562 piccioni, un composto costituito da chicchi di granturco coperti sulla superficie con nicarbazina (800 ppm), alla dose di 8-10 g/capo/giorno per 5 giorni alla settimana durante il periodo marzo-ottobre negli anni 1990-2007. L'autore ha osservato, attraverso controlli svolti prima e dopo il trattamento, che l'effetto della nicarbazina sulla densità numerica dei piccioni determina una costante riduzione del 40-70% del numero della colonia, con picchi che possono raggiungere l'85-90%.
Una conferma delle osservazioni precedenti riguardanti gli effetti della nicarbazina sull'attività riproduttiva dei colombi (Columba livia) deriva dai risultati ottenuti da Avery et al. (20). Il trattamento di 11 coppie di piccioni in cattività con un mangime contenente nicarbazina (5000 ppm) per 4 ore al giorno, somministrato alla dose di 40 g / coppia senza altri alimenti, interferisce con la capacità riproduttiva degli animali.
In particolare, gli Autori hanno evidenziato che la produzione di uova non è stata influenzata, ma solo 9 delle 22 uova prodotte si sono schiuse, con una riduzione del 59% rispetto al periodo di pre-trattamento in cui ognuna delle 11 coppie sottoposte allo studio ha prodotto 2 pulcini. Nella fase di recupero, quando il mangime trattato è stato rimosso, le 11 coppie hanno prodotto 18 pulcini. Tutti i pulcini nati durante lo studio sono apparsi in buona salute e normali e non ci sono stati casi di mortalità tra le coppie di adulti. Pertanto gli autori hanno considerato la nicarbazina un efficace e sicuro mezzo per ridurre la schiusa di uova di colombi randagi con una conseguente riduzione numerica delle loro popolazioni.
Tossicità
modificaLa tossicità acuta della nicarbazina è risultata bassa nei roditori, con valori di DL50 >25000 mg/kg di peso corporeo nel topo e >10000 mg/kg nel ratto. Anche i singoli componenti hanno dimostrato una bassa tossicità per via orale: i valori di DL50 nel topo erano di 4000 e >18000 mg/kg di peso corporeo per i rispettivi componenti pirimidinone e fenilurea. La natura non tossica della Nicarbazina è stata studiata in modo approfondito ed è ben documentata in letteratura (22). Dopo più di 50 anni di ricerca, l'unico effetto collaterale costante derivante dall'ingestione di Nicarbazina nei volatili è la riduzione della capacità di schiusa delle uova. Il fenomeno è correlato alla dose e al tempo di esposizione. La letteratura rivela anche che la Nicarbazina non crea accumulo e che la riproduzione ritorna normale dopo 7 - 10 giorni dalla interruzione dell'assunzione. (23) I valori di tossicità acuta della Nicarbazina nei volatili sensibili sono riportati nella seguente tabella: Tabella 2 - Valori di tossicità acuta delle specie sensibili alla Nicarbazina (6)
| Specie | Livello tossico |
|---|---|
| Germano reale | CL 50 = 3680 ppm nella dieta totale |
| Colino della Virginia (Colinus virgilianus) | CL 50 > 5720 ppm nella dieta totale
DL 50 > 2250 mg/kg/pv |
Per quanto riguarda i sintomi causati da alti dosaggi di nicarbazina nei polli, come conseguenza di avvelenamento causato da alte dosi di nicarbazina (2500 ppm) nel mangime, dopo 8 ore dalla ingestione, i polli da carne hanno presentato una dispnea grave, un decubito permanente con un seguito estensione della gamba e ala e un aumento della temperatura corporea, con risultati letali per alcuni soggetti (21). L'ipertermia, osservata nel pollo dopo l'ingestione di una dose elevata nicarbazina, è stata confermata in uno studio eseguito da Beers et al. (22), gli autori hanno affermato che una concentrazione di 125 ppm di nicarbazina nel mangime è in grado di aumentare la temperatura corporea degli uccelli, sottoposti a stress termico, determinando importanti cambiamenti nel bilancio acido-base, nel lattato ematico e nella frequenza cardiaca. Nel loro complesso, le informazioni pubblicate sulla Nicarbazina riportano che si tratta di un composto con effetti non tossici. La seguente tabella 3 riporta un riassunto dei dati riguardanti le dosi acute e massime di Nicarbazina tollerate da alcuni mammiferi (1).
| Specie | Dose singola DL50
g/kg |
! Dose singola DL50
ppm |
! Massima dose tollerata nella dieta |
|---|---|---|---|
| Topo | > 10 | > 80.000 | |
| Ratto | > 10 | > 80.000 | 1.600 ppm per 177 giorni |
| Cane | > 5 | > 40.000 | 5g/kg/dì per 165 giorni (40.000 ppm) |
| Maiale | 10.000 ppm nella dieta per 49 giorni | ||
| Pecora | 4.000 ppm nella dieta per 1 anno | ||
| Vitello | 1.600 ppm nel latte per 42 giorni | ||
| Porcellino d'India | > 5 | > 40.000 | |
| Coniglio | > 5 | > 40.000 |
I dati pubblicati dal Joint FAO/WHO Expert Committee on Food Additives (JECFA) stabiliscono un NOEL (No Observable Adverse Effect Level), per il ratto e il cane, sulla base di uno studio della durata di 2 anni, su studi di riproduzione e teratologia, compreso tra 200 mg/kg e 400 mg/kg per lo standard di sicurezza alimentare del Codex Alimentarius. Questi valori, traslati con livelli di dieta da 1600 ppm a 3200 ppm, corrispondono ai dati di Ott. La scarsa tossicità della nicarbazina dopo trattamenti ripetuti è confermata da studi effettuati sul ratto e sul cane. Uno studio a due anni è stato condotto nel cane cui veniva somministrata una dieta contenente fenilurea e pirimidinone a dosi giornaliere di 0 + 0; 60+20; 180+60; 600+200 mg/kg. L'alanina aminotransferasi (ALT) serica era aumentata in diversi animali, mentre in un cane è stata osservata una proliferazione dei dotti biliari alla dose di 600 + 200 mg/kg della miscela fenilurea + pirimidinone. Non sono stati segnalati altri effetti dovuti al trattamento. Il NOEL è risultato 180 + 60 mg/kg. Uno studio a 2 anni è stato condotto nel ratto con dieta contenente fenilurea e pirimidone a dosi giornaliere, rispettivamente, in mg/kg di peso corporeo di 0 + 0; 50 + 17; 150 + 50; 300 + 100. Non sono stati osservati effetti tossici legati al trattamento o aumento dell'incidenza di tumori. È stata considerata NOEL la dose più alta della miscela 300 + 100 mg/kg. Un test di tossicità della funzione riproduttiva a tre generazioni è stato condotto nel ratto alimentato con dieta contenente la miscela fenilurea + pirimidinone alle dosi giornaliere, in mg/kg di peso corporeo di 0 + 0; 50 + 17; 150 + 50; 300 + 100 (27). Al dosaggio più elevato sono state osservate sporadiche riduzioni del numero dei feti e una riduzione dell'incremento del peso corporeo dei piccoli durante l'allattamento. Questi effetti non sono stati riscontrati nella maggioranza degli animali. Si è concluso che la nicarbazina non ha effetti sul sistema riproduttivo nel ratto. Uno studio di organogenesi è stato condotto nel ratto somministrando per sonda gastrica nicarbazina alle dosi di: 0, 70, 200, o 600 mg/kg di peso corporeo nei giorni 7 - 17 di gestazione. Alla dose maggiore è stata osservata una riduzione del peso corporeo e del consumo di cibo nelle femmine trattate con mortalità di 7/25 animali. A questa dose si è evidenziato ritardo nello sviluppo fetale. Sono state osservate alcune anomalie fetali come idronefrosi, e costole iperplastiche ed inclinate. Non sono state osservate forme teratogene. Il NOEL è stato considerato alla dose di 200 mg/kg (28). Negli Stati Uniti l'Agenzia per la Protezione dell'Ambiente (EPA, United States Environmental Protection Agency), considera la nicarbazina “praticamente non tossica” paragonando la sua tossicità a quella dello zucchero” (24).
Bibliografia
modifica- Ott, W.H., S. Kuna, C.C. Porter, and A.C. Cuckler. 1956. Biological studies on nicarbazin, a new anticoccidial agent. Poultry Science 35:1355-1367.
- World Health Organization (WHO), FAO Food and Nutrition Paper numero 41/11. Residues of Some Veterinary Drugs in Animals and Foods (1999).
- Porter C.C., Gilfillan J. The absorption and excretion of orally administered nicarbazin in chickens Poultry Sci. 34, 995 - 1001, 1955
- Valfrè F, Macrì A, “Nicarbazina: impiego nell'alimentazione dei broilers e valutazione dei residui” Obiettivi Veterinari 1990, 10:1116
- Sherwood DH, Milby TT, Witz HL. “Further studies on effect of nicarbazin on reproduction of chickens” Poultry Sci. 35, 1171, 1956
- McLoughlin DK, Wher EE, Rubin R, “Egg shell color and egg production in new Hampsire layng hens as affected by nicarbazin medication” Poult. Sci. 36:880–884
- Hurwitz S, Bornstein S, Lev Y, “Some responses of laying hens to induced arrest of egg production”, Poult. Sci. 1975, 54:415-422
- Luck MR “The adverse effects of nicarbazin on reproductive activity in the hen” Br. Poul. Sci., 1979, 20:605-607
- Weiss HS, Fisher H, Griminger P., “Chemical Control of Onset of Egg Production” Poult. Sci. (1960) 39: 1221-1223
- Barbato, G., A. MacDonald. 2006. Pekin Duck Model for Action of Nicarbazin on Fertility. Pennsylvania State University. Pending publication
- Cuckler A.C., W.H. Ott, and D.E. Fogg. Factor in the evaluation of coccidiostats in poultry. Cornell Vet. 47, 400 - 412, 1957
- Polin D, Ott W.H., Siegmund O.H. “The incidence and degree of yolk mottling in eggs from hens fed diet with and without nicarbazin” Poultry Sci. 1957, 36:524-528
- Jones, J.E., J. Solis, B.L. Hughes, D.J. Castadldo, and J.E. Toler. 1990. Reproduction responses of broiler-breeders to anticoccidial agents. Poultry Science. 69:27-36
- Polin, D, W.H. Ott, and O.H. Siegmund. The incidence and degree of yolk mottling in eggs from hens fed diets with and without nicarbazin. Poultry Sci. 36, 524 - 528, 1957
- Elder W., “Chemical inhibitors of ovulation in the pigeon”, J. Wild. Manag., 1964, July,Vol 28, N. 3: 557-74
- Martelli P, Bonati L., Gelati A, Ferraresi M, Montella L, Cabassi E., Zannetti G. “Effects of nicarbazin on pigeon reproduction. Preliminary note” Atti della Società Italiana delle scienze veterinarie” Atti SISVet, Volume XLVII,47, 1283, 1993
- Chelazzi G, Lebbroni M, Scoccianti G. (2000), Monitoraggio della popolazione di colombo di città Columba livia forma domestica nel comune di Firenze (periodo febbraio 1999-Febbraio 2000), Laboratorio di Ecologia, Dipartimento di Biologia Animale e Genetica, Facoltà di Scienze Matematiche, Fisiche e Naturali, Università degli Studi di Firenze
- Bursi E., Gelati A., Ferraresi M., Zannetti G. (2001), “Impiego della nicarbazina nel controllo della riproduzione del colombo randagio di città”, Annali della Facoltà di Medicina Veterinaria Università di Parma, 97-116
- Ferri M. , Ferraresi M. , Gelati A. , Zannetti G. , Ubaldi A., Contiero B., Bursi E, “Use of nicarbazine in the control of urban pigeon colonies in Italy in 1990-2007”, Ann. Fac. Medic. Vet. di Parma (Vol. XXIX, 2009) pag. 91 - pag. 102
- Avery M.L., Keacher K.L. and Tillman E.A., “Nicarbazin bait reduces reproduction by pigeons (Columba Livia)”,Wildlife Research, 2008, 35, 80-85
- Kuna, S. (1955) Tolerance studies in mammals. Unpublished report. Submitted to WHO by Koffolk, Rancho Santa Fe, California, USA – cited in WHO-FAO Joint Expert Committee on Feed Additives (JECFA) - WHO technical report series, 888, 1999
- Chapman, H.D. A Review of the Biological Activity of the Anticoccidial Drug Nicarbazin and its Application for the Control of Coccidiosis in Poultry. 1993. Poultry Science Reviews, v. 5 (4), p 231-243
- Barbato G., A. MacDonald. Pekin Duck Model for Action of Nicarbazin on Fertility. Pennsylvania State University. 2006. Pending publication
- EPA Fact Sheet, Nicarbazin Conditional Registration, Nov 2005
- Froyman R, Hales GB, “Nicarbazin toxicity in broilers”, The Vet. Rec. September 8, 1994:254
- Beers KW, Raup TJ, Bottie WG, Odom TW, “Phisiological responses of heat-stressed broilers fed nicarbazin”, Poul. Sci. 1989 Mar; 68(3): 428-434
- Kirschner S.L., Vogin E.E. (1970) Multigeneration reproduction and lactation studies with 4,4'-dinitrocarbanilide (DNC) and 2-hydroxy-4,6-dimethylpyrimidine dihydrate (HDP). Unpublished report from Food and Drug Research Laboratories, West Point, Pennsylvania, USA. Submitted to WHO by Koffolk, Rancho Santa Fe, California, USA
- Tajima, M. (1979) Teratogenicity test of nicarbazin with rats by oral administration. Unpublished report from Nisseiken (NIBS). Submitted to WHO by Koffolk, Rancho Santa Fe, California, USA – cited in WHO, 1998