Osmio pentacarbonile
L'osmio pentacarbonile è il composto metallorganico con formula Os(CO)5. In questo composto l'osmio ha formalmente stato di ossidazione zero. In condizioni normali è un liquido giallo. È un composto di interesse accademico, intermedio nelle razioni di sintesi di altri complessi carbonilici di osmio.[1][2]
| Osmio pentacarbonile | |
|---|---|
 | |
| Nome IUPAC | |
| pentacarbonilosmio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5O5Os |
| Peso formula (u) | 330,28 |
| Aspetto | liquido giallo[1] |
| Numero CAS | |
| PubChem | 10892861 e 171041432 |
| SMILES | [C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[Os] |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 2–2,5 °C (275–276 K)[1] |
| Indicazioni di sicurezza | |
Sintesi
modificaFu sintetizzato per la prima volta nel 1936 da Walter Hieber e Hartmut Stallmann, facendo reagire OsO4 con monossido di carbonio (100-200 atm) a 160 °C.[3][4] Più recentemente è stato preparato facendo reagire in autoclave Os3(CO)12 con monossido di carbonio (≈200 atm).[1]
- Os3(CO)12 + 3 CO ⇄ 3 Os(CO)5
Proprietà
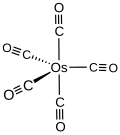
modificaLa molecola di Os(CO)5 ha una struttura a bipiramide trigonale, come illustrato in figura, con simmetria D3h.[4] Os(CO)5 contiene un totale di 18 elettroni nel livello elettronico più esterno, e dovrebbe essere quindi molto stabile in base alla regola dei 18 elettroni, analogamente all'omologo Fe(CO)5. Os(CO)5 è invece un composto stabile solo se conservato come solido a –18 ºC. Per riscaldamento a 80 ºC si converte nuovamente a Os3(CO)12. Per confronto, l'analogo Ru(CO)5 è ancora più instabile e la conversione a Ru3(CO)12 avviene già a temperatura ambiente.[1]
Os(CO)5 reagisce con cloro per formare il pentacarbonile cationico:[1]
- Os(CO)5 + Cl2 → [Os(CO)5Cl]+Cl−
Per irradiazione in soluzione di esano, Os(CO)5 reagisce con etilene per formare derivati mono-, di- e trisostituiti.[5]
- Os(CO)5 + n C2H4 → Os(CO)5-n(C2H4)n + n CO (n = 1,2,3)
Note
modificaBibliografia
modifica- (EN) F. Calderazzo e F. L'Eplattenier, Pentacarbonyls of ruthenium and osmium. I. Infrared spectra and reactivity, in Inorg. Chem., vol. 6, n. 6, 1967, pp. 1220-1224, DOI:10.1021/ic50052a033.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) W. Hieber e H. Stallmann, Über Osmiumcarbonyle, in Z. Elektrochem., vol. 49, n. 4-5, 1943, pp. 288-292, DOI:10.1002/bbpc.19430490423.
- (EN) G. Y. Kiel, J. Takats e F. W. Grevels, Multisubstitution of Os(CO)5 by ethylene: Isomeric Os(CO)2(C2H4)3 and a Derivative of Os(CO)(C2H4)4, in J. Am. Chem. Soc., vol. 109, n. 7, 1987, pp. 2227–2229, DOI:10.1021/ja00241a075.
- (EN) P. Rushman, G. N. Van Buuren, M. Shiralian e R. K. Pomeroy, Properties of the pentacarbonyls of ruthenium and osmium, in Organometallics, vol. 2, n. 5, 1983, pp. 693-694, DOI:10.1021/om00077a026.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su osmio pentacarbonile