Pentafluoruro di antimonio
Il pentafluoruro di antimonio è il composto inorganico binario dell'antimonio pentavalente con il fluoro, avente formula molecolare SbF5.
| Pentafluoruro di antimonio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| pentafluoruro di antimonio | |
| Nomi alternativi | |
| fluoruro di antimonio(V)
fluoruro antimonico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SbF5 |
| Massa molecolare (u) | 216,74 |
| Aspetto | liquido incolore oleoso igroscopico |
| Numero CAS | |
| Numero EINECS | 232-021-8 |
| PubChem | 24557 e 90479450 |
| SMILES | F[Sb](F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,99 |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | 281,4 (8,3 °C) |
| Temperatura di ebollizione | 422,7 (149,5 °C) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 301+311+331 - 314 - 411 - EUH014 |
| Consigli P | 260 - 264 - 273 - 280 - 305+351+338 - 310 [1] |
In condizioni ambiente è un liquido incolore molto viscoso, che fuma all'aria, igroscopico, sensibile all'umidità dell'aria e facilmente idrolizzabile.[2]
In questo composto l'antimonio è al suo massimo stato di ossidazione, +5. È noto soprattutto per le sue caratteristiche di forte acido di Lewis[3] che può unirsi a specie neutre dando addotti,[4][5] o catturare anioni a dare complessi anionici molto stabili: con lo ione fluoruro (F−) produce l'altrettanto importante ione esafluoroantimoniato SbF6−, uno degli anioni complessi meno coordinanti e, in quanto tale, apprezzato in chimica organometallica e inorganica in genere.[6]
Per la sua forza come acido di Lewis viene inoltre utilizzato, in soluzione di acido fluoridrico, per la preparazione del cosiddetto acido fluoroantimonico, un mezzo che è un superacido di Brønsted tra i più forti che si conoscano. Parimenti, in soluzione di acido fluorosolforico (FSO3H), forma il cosiddetto "acido magico", un altro mezzo superacido che permise la formazione in soluzione di carbocationi stabili e il loro studio.[7][8] SbF5 è però anche un ossidante e un fluorurante (vide infra).
Proprietà e struttura molecolare
modificaIl pentafluoruro di antimonio è un composto termodinamicamente molto stabile: ΔHƒ° = -(1.327,95 ± 0,93) kJ/mol.[9] SbF5 è un composto molecolare nonostante che la differenza di elettronegatività tra F e Sb sia notevole, pari a 1,93 sulla scala Pauling,[10] che è un valore appena superiore alla soglia per la ionicità del legame (Δχ > 1,8).[11]
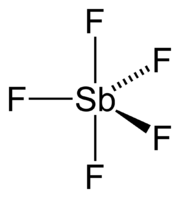
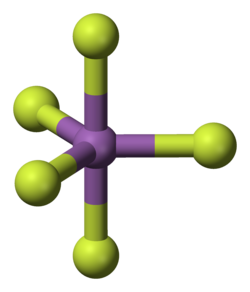
La molecola, presente come tale essenzialmente solo nella fase vapore (insieme a dimeri, trimeri e oligomeri), è ipervalente ed ha struttura a bipiramide trigonale, con simmetria D3h;[12] questo è in accordo sia con una ibridazione sp3d di Sb che con le previsioni del modello VSEPR per una molecola del tipo AX5.
Allo stato liquido (che è molto viscoso, a volte descritto come sciropposo[13]) le molecole SbF5 si associano a formare specie oligomere nelle quali sono presenti ottaedri SbF6, con due fluori a ponte che collegano due centri Sb vicini.[13]
Allo stato cristallino si formano tetrameri ciclici di formula (SbF5)4 e formula di struttura [SbF4(μ-F)]4.[14] Le distanze Sb–F con i fluori a ponte nell'anello a otto termini Sb4F4 sono circa 202 pm; per gli altri fluori non condivisi la distanza Sb–F è più corta, circa 182 pm.[14]
Da notare che SbF5 è il primo dei pentaalogenuri del gruppo dell'azoto che negli stati condensati non è monomero ed è seguíto in questo da quello del bismuto. Infatti, le specie pentafluoruro di fosforo (PF5) e pentafluoruro di arsenico (AsF5) sono monomeriche anche allo stato liquido e solido, probabilmente perché, essendo l'atomo centrale più piccolo, un aumento del numero di coordinazione da 5 a 6 comporterebbe eccessive repulsioni tra i fluori nella sfera di coordinazione. Il pentafluoruro di bismuto (BiF5) in condizioni ambiente è un solido polimerico lineare, -[F-(BiF4)-]n.[15]
Sintesi
modificaIl pentafluoruro di antimonio fu preparato per la prima volta da Otto Ruff e Wilhelm Plato nel 1904, facendo reagire pentacloruro di antimonio con acido fluoridrico anidro:[16]
Si può preparare anche da trifluoruro di antimonio e fluoro:[17]
Reattività
modificaIl pentafluoruro di antimonio è un composto estremamente reattivo, forte acido di Lewis ed energico fluorurante e ossidante.
Come acido di Lewis
modificaIl pentafluoruro di antimonio è un acido di Lewis molto potente, più potente di AsF5, e questo più di PF5; in particolare, è un forte accettore di ioni fluoruro, formando l'anione molto stabile esafluoroantimoniato, [SbF6]−, del quale si conoscono svariati sali con cationi metallici semplici, ma anche cationi molecolari, come [O2]+, [XeF]+, [Br2]+, [ClF2]+ e [NF4]+.[18]
Da SbF5 si possono formare specie anioniche anche più complesse: dato che l'anione [SbF6]− è comunque una base di Lewis, sebbene molto debole, esso può ulteriormente reagire con SbF5 formando [Sb2F11]− (cioè: [F5Sb–F–SbF5]–):[19]
Questo può reagire ancora con un'altra molecola di SbF5 dando [Sb3F16]−. In tal modo si producono anioni meno basici e meno coordinanti rispetto all'esafluoroantimoniato.[20] Di questi ulteriori anioni si conoscono, ad esempio, i «sali» [BrF4]+[Sb2F11]− e [IF6]+[Sb3F16]−.[21]
Come acido di Lewis per la formazione di superacidi di Brønsted
modificaLa formazione e la stabilità di [SbF6]− è alla base dell'utilizzo del pentafluoruro di antimonio per la generazione di superacidi. Miscele di pentafluoruro di antimonio e acido fluoridrico sono note come acido fluoroantimonico, un mezzo superacido tra i più forti noti, in grado di protonare anche basi estremamente deboli come gli idrocarburi:[22]
Il valore limite della funzione acidità di Hammett per questo sistema superacido è H0 = -28.[23]
Un altro superacido, noto come acido magico, si ottiene con miscele di pentafluoruro di antimonio e acido fluorosolforico:[24]
Per questo sistema si arriva ad avere H0 = -23.[23] L'aggiunta alla soluzione di anidride solforica fa aumentare un po' l'acidità del mezzo,[25] che comunque anche così non raggiunge il livello ottenibile con la miscela SbF5/HF.
Come acido di Lewis per reazioni con altre specie attive
modificaAltre reazioni che evidenziano la tendenza ad accettare ioni fluoruro sono:[24]
dove SbF5 si comporta da acido di Lewis polarizzando la molecola F2, e il risultato è anche una fluorurazione ossidativa di NF3 (N+3 → N+5) che non si ha da NF3 e F2 da soli, [NF4]+F− non esiste.[26]
Per confronto, nella reazione seguente si comporta solo da accettore di ioni fluoruro, As non viene ossidato:
Analogamente, il pentafluoruro di antimonio può servire ad aumentare il potere ossidante del fluoro per arrivare ad ossidare l'ossigeno (O0 → O+1/2):[27]
La grande affinità del pentafluoruro di antimonio per lo ione fluoruro ha permesso anche di realizzare la prima reazione chimica che porta alla formazione di fluoro elementare, molto interessante da un punto di vista teorico, sebbene non dal punto di vista pratico:[28][29]
La specie MnF4 che si forma come intermedio dopo la perdita di due ioni fluoruro da K2MnF6 , presi da SbF5, è troppo instabile e si decompone espellendo un atomo di fluoro. Questa reazione complessiva costituisce una risposta positiva al problema chimico di poter ossidare il fluoro presente in fluoruri (F−1 → F0) con mezzi puramente chimici, senza ricorrere a mezzi di 'forza bruta', quale può essere l'elettrolisi. Qui SbF5, operando da acido di Lewis, serve ad ottenere un fluoruro instabile (MnF4), dopodiché l'ossidazione di F−1 in esso contenuto è ad opera dell'atomo metallico in Mn(IV) che di conseguenza si riduce a Mn(III).[30]
Come fluorurante e ossidante
modificaLo zolfo può essere ossidato con pentafluoruro di antimonio usando un solvente sufficientemente inerte come l'anidride solforosa (SO2):[31]
Come fluorurante, il pentafluoruro di antimonio è spesso usato in miscela col pentacloruro di antimonio (SbCl5), principalmente per diminuirne sensibilmente l'alta viscosità;[32] in questo modo, ad esempio, dal cloruro di tionile (O=SCl2) e dall'ossicloruro di fosforo (O=PCl3) si ottengono rispettivamente fluoruro di tionile (O=SF2) e O=PFCl2.[33]
Sicurezza
modificaIl pentafluoruro di antimonio è un composto chimico pericoloso. È tossico per inalazione, ingestione e contatto. È fortemente corrosivo per la pelle e per i metalli[2] non è classificato come cancerogeno. È tossico per gli organismi acquatici e provoca danni a lungo termine per l'ambiente acquatico.[34]
Note
modifica- ^ scheda del composto su GESTIS
- ^ a b (EN) PubChem, Antimony pentafluoride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 7 novembre 2024.
- ^ Abhik Ghosh e Steffen Berg, Arrow pushing in inorganic chemistry: a logical approach to the chemistry of the main-group elements, John Wiley & Sons, Inc, 2014, p. 193, ISBN 978-1-118-17398-5, OCLC 876287906. URL consultato il 7 novembre 2024.
- ^ (EN) Karl O. Christe e Wolfgang Sawodny, Halogen pentafluoride Lewis acid adducts, in Inorganic Chemistry, vol. 12, n. 12, 1973-12, pp. 2879–2885, DOI:10.1021/ic50130a027. URL consultato il 7 novembre 2024.
- ^ (EN) Frederick A. Hohorst, Lawrence. Stein e Elizabeth. Gebert, Hexafluoroiodine(VII) hexafluoroantimonate(V), (IF6+SbF6-), in Inorganic Chemistry, vol. 14, n. 9, 1º settembre 1975, pp. 2233–2236, DOI:10.1021/ic50151a041. URL consultato il 7 novembre 2024.
- ^ (EN) Wolfgang Beck e Karlheinz Suenkel, Metal complexes of weakly coordinating anions. Precursors of strong cationic organometallic Lewis acids, in Chemical Reviews, vol. 88, n. 7, 1º novembre 1988, pp. 1405–1421, DOI:10.1021/cr00089a017. URL consultato il 7 novembre 2024.
- ^ (EN) George A. Olah, Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions, in Journal of the American Chemical Society, vol. 94, n. 3, 1972-02, pp. 808–820, DOI:10.1021/ja00758a020. URL consultato il 7 novembre 2024.
- ^ Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3., vollständig überarbeitete Auflage, Springer Spektrum, 2016, p. 273, ISBN 978-3-662-45066-6.
- ^ Gerald K Johnson, G. N Papatheodorou e Carl E Johnson, The enthalpies of formation of SbF5(l) and Sb2S3(c) and the high-temperature thermodynamic functions of Sb2S3(c) and Sb2S3(l), in The Journal of Chemical Thermodynamics, vol. 13, n. 8, 1º agosto 1981, pp. 745–754, DOI:10.1016/0021-9614(81)90063-X. URL consultato il 20 novembre 2024.
- ^ (EN) A.L. Allred, Electronegativity values from thermochemical data, in Journal of Inorganic and Nuclear Chemistry, vol. 17, n. 3-4, 1961-06, pp. 215–221, DOI:10.1016/0022-1902(61)80142-5. URL consultato il 20 luglio 2023.
- ^ (EN) 6.1: Electronegativity and Polarity, su Chemistry LibreTexts, 12 novembre 2018. URL consultato il 20 luglio 2023.
- ^ (EN) Lesley E. Alexander e I. R. Beattie, Raman Spectrum of Antimony Pentafluoride in the Gaseous Phase as a Function of Temperature. Evidence for a Trigonal Bipyramidal Shape for the Monomeric Species, in The Journal of Chemical Physics, vol. 56, n. 12, 15 giugno 1972, pp. 5829–5831, DOI:10.1063/1.1677123. URL consultato il 21 novembre 2024.
- ^ a b N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 562, ISBN 0-7506-3365-4.
- ^ a b (EN) A.J. Edwards e P. Taylor, Crystal structure of antimony pentafluoride, in J. Chem. Soc. D, Chem. Commun., 1971, pp. 1376-1377, DOI:10.1039/C29710001376. URL consultato il 9 aprile 2011.
- ^ (EN) A.F. Holleman e E. Wiberg, Inorganic chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
- ^ (DE) O. Ruff e W. Plato, Ueber die Darstellung und die physikalische Beschaffenheit einiger neuer Fluorverbindungen. Titantetrafluorid, Zinntetrafluorid, Antimonpentafluorid, sowie gemischte Antimon-Trifluoride und -Pentafluoride, in Ber. deutsch. chem. Ges., vol. 37, n. 1, 1904, pp. 673-683, DOI:10.1002/cber.190403701109. URL consultato l'11 aprile 2011.
- ^ (EN) G. Brauer (a cura di), Handbook of preparative inorganic chemistry, 2ª ed., New York, Academic Press, 1963, pp. 200.
- ^ Catherine E. Housecroft e Alan G. Sharpe, Inorganic chemistry, 3. ed, Pearson Prentice Hall, 2008, p. 462, ISBN 978-0-13-175553-6.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, p. 512, ISBN 88-299-1470-3.
- ^ (EN) Martin Möbs, David A. Dixon e Gabriel F. de Melo, The Crucial Role of Sb 2 F 10 in the Chemical Synthesis of F 2, in Angewandte Chemie International Edition, vol. 62, n. 39, 25 settembre 2023, DOI:10.1002/anie.202307218. URL consultato il 21 novembre 2024.
- ^ Catherine E. Housecroft e Alan G. Sharpe, Inorganic chemistry, 3. ed, Pearson Prentice Hall, 2008, p. 548, ISBN 978-0-13-175553-6.
- ^ George A. Olah, A life of magic chemistry: autobiographical reflections of a Nobel Prize winner, collana Wiley-interscience, John Wiley, 2001, ISBN 978-0-471-15743-4.
- ^ a b (EN) R. J. Gillespie e T. E. Peel, Hammett acidity function for some superacid systems. II. Systems sulfuric acid-[fsa], potassium fluorosulfate-[fsa], [fsa]-sulfur trioxide, [fsa]-arsenic pentafluoride, [sfa]-antimony pentafluoride and [fsa]-antimony pentafluoride-sulfur trioxide, in Journal of the American Chemical Society, vol. 95, n. 16, 1973-08, pp. 5173–5178, DOI:10.1021/ja00797a013. URL consultato il 21 novembre 2024.
- ^ a b (EN) Housecroft, C.E. e A.G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (Inghilterra), Pearson Education Limited, 2008, ISBN 978-01-31-75553-6.
- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 492, ISBN 978-3-11-026932-1, OCLC 970042787. URL consultato il 20 novembre 2024.
- ^ (EN) Karl O. Christe e William W. Wilson, Nitrogen pentafluoride: covalent NF5 versus ionic NF4+F- and studies on the instability of the latter, in Journal of the American Chemical Society, vol. 114, n. 25, 1992-12, pp. 9934–9936, DOI:10.1021/ja00051a027. URL consultato il 21 novembre 2024.
- ^ (EN) J. Shamir e J. Binenboym, Dioxygenyl salts, in Inorg. Synth., vol. 14, 1973, pp. 39-42, DOI:10.1002/9780470132456.ch8. URL consultato l'11 aprile 2011.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 549, ISBN 0-471-19957-5.
- ^ (EN) K.O. Christe, Chemical synthesis of elemental fluorine, in Inorg. Chem., vol. 25, n. 21, 1986, pp. 3721–3722, DOI:10.1021/ic00241a001. URL consultato l'11 aprile 2011.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. 851, ISBN 88-299-1470-3.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 664, ISBN 978-0-7506-3365-9.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 564, ISBN 0-7506-3365-4.
- ^ (EN) Greenwood, N.N. e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- ^ Alfa Aesar, Scheda dati di sicurezza di SbF5 (PDF), su alfa.com:. URL consultato l'11 aprile 2011.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Pentafluoruro di antimonio