Pentazenio
Il catione pentazenio (anche detto pentanitrogeno) è uno ione polinitrogeno caricato positivamente di formula chimica N+5. L'anione azoturo e il pentazenio, i polimeri del diazoto e l'azoto solido, sono le uniche specie polinitrogene ottenibili in quantità notevoli.
| ione pentazenio | |
|---|---|
 | |
| Nome IUPAC | |
| Catione Pentanitrogeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N5⁺ |
| Massa molecolare (u) | 70.0335 g/mol |
| Numero CAS | [1] |
| PubChem | 139031002 |
| SMILES | N#[N+][N-][N+]#N |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| attenzione | |
Storia
modificaNel programma di ricerca High Energy Density Matter, promosso dopo il 1986 dalla U.S. Air Force, inizia uno studio sistematico dei composti polinitrogeni nel 1998, quando l'Air Force Research Laboratory a Edwards AFB s'interessa a un combustibile per razzi alternativo a quello basato sul composto Idrazina, fortemente tossico, ottenendo diverse soluzioni. Karl O. Christe, un giovane ricercatore AFRL, propone un composto lineare N+5 con N2F+ e N−3 basato sulla seguente struttura:[2]
- [F−N≡N]+ + HN=N=N → [N≡N−N=N=N]+ + HF
La reazione avviene e il composto N+5AsF−6 viene creato in quantità sufficienti da essere studiato in NMR, IR e spettrosocopia Raman nel 1999.[3] Il sale è fortemente esplosivo, ma quando AsF5 fu sostituito con SbF5, un acido Lewis più forte, fu prodotto il composto N+5SbF−6, resistente agli shock e stabile termicamente fino a 60–70 °C. Questo consente la produzione in grandi quantità, un trattamento semplice, e l'analisi della struttura cristallina ai raggi X.[4]
Preparazione
modificaL'unico metodo conosciuto è la reazione di N2F+ e HN3 in soluzione non acquosa di HF a −78 °C cioè:
- cis-N2F2 + SbF5 → [N2F]+[SbF6]−
- [N2F]+[SbF6]− + HN3 → [N5]+[SbF6]− + HF
Chimica
modificaN+5 si ossida in acqua, NO, NO2 e Br2, ma non con soluzioni Cl2 o O2; la sua affinità elettronica è 10.44 eV (1018.4 kJ/mol). Per questo motivo N+5 dev'essere trattato e preparato in ambiente secco:
- 4N+5AsF−6 + 2H2O → 4HF + 4AsF5 + 10N2 + O2
- 2N+5SbF−6 + 2Br2 → 2Br+2SbF−6 + 5N2
Essendo il fluoroantimoniato stabile, viene usata come precursore di tutti i sali conosciuti, di solito accompagnati da reazione metatesi in un solvente non acquoso come HF, SO2, CHF3, o acetonitrile CH3CN, dove l'esafluoroantimoniato è insolubile:
- 2N+5SbF−6 + A+B− → N+5B− + ASbF6
I sali più stabili di N+5 si decompongono quando riscaldati a 50–60 °C: N+5SbF−6, N+5SbF−5, e N5B(CF3)4, mentre i sali più instabili ottenuti e studiati, N+5[P(N3)−6] e N+5[B(N3)−4] sono estremamente sensibili alla temperatura e agli shock, esplodendo in soluzione di 0.5 mmol. Un certo numero di sali, come fluoruri, azidi, nitrati, o perclorati, non riescono a formarsi.[2]
Struttura e legame
modificaNella Teoria del legame di valenza il pentazenio viene descritto da sei strutture di risonanza:
- [N≡N+−N−−N+≡N]+ ↔ [N−=N+=N−N+≡N]+ ↔ [N≡N+−N=N+=N−]+ ↔ [N≡N+−N+≡N+−N2−]+ ↔ [N2−−N+≡N+−N+≡N]+ ↔ [N−=N+=N+=N+=N−]+
dove le ultime tre strutture hanno minore peso al contributo della struttura di Lewis perché con stati della carica formale meno favoriti rispetto alle prime tre.[5]
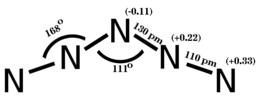
In accordo ai calcoli ab initio e alla struttura sperimentale ai raggi X-ray, il catione è planare, simmetrico, e di forma V approssimativamente, con angoli di legame 111° sull'atomo centrale (angolo N2–N3–N4) e 168° sul secondo e quarto atomo (angoli N1–N2–N3 e N3–N4–N5). La lunghezza di legame per N1–N2 e N4–N5 sono 1.10 Å e quella dei legami N2–N3 e N3–N4 sono 1.30 Å.[4]
Note
modifica- ^ Ricerca CAS, su tools.wmflabs.org, Wikimedia Tool Labs.
- ^ a b Karl O. Christe, Recent Advances in the Chemistry of N+5, N−5 and High-Oxygen Compounds, in Propellants, Explosives, Pyrotechnics, vol. 32, n. 3, 14 giugno 2007, pp. 194–204, DOI:10.1002/prep.200700020.
- ^ Karl O. Christe, William W. Wilson, Jeffrey A. Sheehy e Jerry A. Boatz, <2004::AID-ANIE2004>3.0.CO;2-7 N+5: A Novel Homoleptic Polynitrogen Ion as a High Energy Density Material, in Angewandte Chemie International Edition, vol. 38, 13–14, 12 luglio 1999, pp. 2004–2009, DOI:10.1002/(SICI)1521-3773(19990712)38:13/14<2004::AID-ANIE2004>3.0.CO;2-7.
- ^ a b Ashwani Vij, William W. Wilson, Vandana Vij, Fook S. Tham, Jeffrey A. Sheehy e Karl O. Christe, Polynitrogen Chemistry. Synthesis, Characterization, and Crystal Structure of Surprisingly Stable Fluoroantimonate Salts of N+5, in J. Am. Chem. Soc., vol. 123, n. 26, 9 giugno 2001, pp. 6308–6313, DOI:10.1021/ja010141g, PMID 11427055. URL consultato il 18 maggio 2018 (archiviato dall'url originale il 23 settembre 2017).
- ^ Method of drawing the Lewis Structures of N5+, su Chemistry Net Blogspot, Blogger, 31 ottobre 2012. URL consultato l'8 novembre 2016.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Pentazenio