Periodato
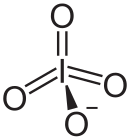
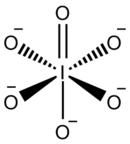
Il periodato è un anione formato da iodio e ossigeno. Questo è uno degli ossoanioni dello iodio e il maggiore della serie, con lo iodio nello stato di ossidazione +7. Come per altri peralogenati, come il perclorato, può esistere in due forme: l'anione metaperiodato IO−4 e il pentanione ortoperiodato IO5−6. A questo proposito è comparabile allo ione tellurato del periodo adiacente. Può combinarsi con un numero di ioni di carica opposta per formare i composti detti periodati, che possono anche essere considerati come i sali dell'acido periodico.
| Ione periodato | |
|---|---|
| Nome IUPAC | |
| tetraossoiodato(1−) esaossoiodato(5−) [1] | |
| Caratteristiche generali | |
| Formula bruta o molecolare | IO4− oppure IO65- |
| Numero CAS | |
| PubChem | 167232 |
| SMILES | [O-]I(=O)(=O)=O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
Gli ioni periodati sono stati scoperti da Heinrich Gustav Magnus e C. F. Ammermüller; che per primi hanno sintetizzato l'acido periodico nel 1833.[2]
Struttura e legame
modificaSia in orto che in metaperiodato lo iodio è ipervalente, in quanto forma più legami di quanto sarebbe normalmente permesso. Ciò è stato spiegato in termini di legame dativo, confermando l'assenza di un doppio legame in queste molecole.[3]
| Struttura 3D dell'anione periodato | Struttura 3D del pentanione ortoperiodato |
|---|
Le strutture esatte variano a seconda dei controioni, tuttavia in media gli ortoperiodati adottano una geometria ottaedrica leggermente deformata con diffrazione a raggi X che indicano una lunghezza del legame I–O di 1.89 Å.[4][5]
I metaperiodati adottano una geometria tetraedrica distorta con una distanza I-O media di 1.78 Å.[6][7]
Note
modifica- ^ (EN) Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). 6ed, Cambridge (UK), RSC/IUPAC (2005). ISBN 0-85404-438-8. p. 315. Versione elettronica.
- ^ (DE) Ammermüller F.; Magnus, G., Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure, in Ann. Phys. (Berl.), vol. 104, n. 7, 1833, pp. 514–525, Bibcode:1833AnP...104..514A, DOI:10.1002/andp.18331040709.
- ^ (EN) Ivanov A.; Popov A.; Boldyrev, A.; Zhdankin, V., The I=X (X = O,N,C) Double Bond in Hypervalent Iodine Compounds: Is it Real?, in Angew. Chem. Int. Ed., vol. 53, 2014, pp. 9617–9621, DOI:10.1002/anie.201405142.
- ^ (EN) Tichý K.; Rüegg, A.; Beneš, J., Neutron diffraction study of diammonium trihydrogen periodate, (NH4)2H3IO6, and its deuterium analogue, (ND4)2D3IO6, in Acta Crystallogr. B, vol. 36, n. 5, 1980, pp. 1028–1032, DOI:10.1107/S0567740880005225.
- ^ (EN) Feikema Y. D., The crystal structures of two oxy-acids of iodine. I. A study of orthoperiodic acid, H5IO6, by neutron diffraction, in Acta Crystallographica, vol. 20, n. 6, 1966, pp. 765–769, DOI:10.1107/S0365110X66001828.
- ^ (EN) Levason W.; Webster, M., Ammonium tetraoxoiodate(VII), in Acta Crystallogr. C, vol. 55, n. 6, 1999, p. IUC9900052, DOI:10.1107/S0108270199099394.
- ^ (EN) Kálmán A.; Cruickshank D. W. J., Refinement of the structure of NaIO4, in Acta Crystallogr. B, vol. 26, n. 11, 1970, pp. 1782–1785, DOI:10.1107/S0567740870004880.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Periodato