Pila Daniell
La pila Daniell è una pila inventata da John Frederic Daniell nel 1836 che sfruttava il prototipo della pila di Volta e apportando miglioramenti in termini di tensione e sicurezza d'uso.
Descrizione e funzionamento
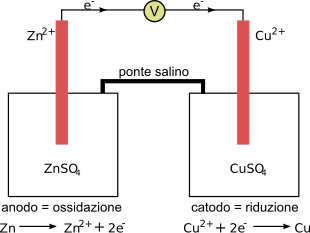
modificaLa cella è costituita da un compartimento anodico (semicella) formato da una barretta di zinco immersa in una soluzione di solfato di zinco (ZnSO4) 1 M e un compartimento catodico formato da una barretta di rame immersa in una soluzione di solfato di rame (CuSO4) 1 M[1]. Le due semicelle sono collegate da un ponte salino costituito da un tubo riempito da una soluzione satura di nitrato di potassio (KNO3) con dei tappi alle estremità permeabili a ioni e acqua.[1] Alla chiusura del circuito esterno con un conduttore, al catodo avviene la semireazione di riduzione:[2]
Cu2+(aq) + 2 e− → Cu(s)- (Eº = +0,34 V)
per cui ioni Cu2+ scompaiono dalla soluzione e si depositano come metallo sulla lamina. All'anodo avviene la semireazione di ossidazione:[2]
Zn(s) → Zn2+(aq) + 2 e−- (Eº = −0,76 V)
per cui dello zinco metallico si stacca dalla lamina raggiungendo la soluzione come ioni Zn2+. La reazione completa è:[2]
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)- (∆Eº = 1,1 V)
Per effetto di questa reazione nel comparto catodico mancherebbero cariche positive, mentre nel comparto anodico si avrebbe un eccesso di cariche positive. Il tutto però viene compensato perché gli ioni potassio (K+) e nitrato (NO−3) del ponte salino si spostano raggiungendo il compartimento catodico ed anodico, rispettivamente, ristabilendo l'elettroneutralità della soluzione, in accordo con la legge di Kirchhoff delle correnti. Gli elettroni nel circuito esterno girano dalla barretta di zinco a quella di rame e quindi la corrente convenzionale positiva I va dal rame allo zinco. Il potenziale teorico della pila Daniell è ∆Eº = Eº(Cu2+/Cu)−Eº(Zn2+/Zn)=1,10 V[3] ottenibile in condizioni quasi statiche reversibili, differenza tra il potenziale catodico (polo positivo) e quello anodico (polo negativo).
Note
modifica- ^ a b Bockris Vol. 2, p. 859.
- ^ a b c Elettrochimica (PDF), su chimica.unipd.it. URL consultato il 13 giugno 2019 (archiviato dall'url originale il 30 maggio 2009).
- ^ Elettrochimica (PDF), su uniroma2.it. URL consultato il 19 aprile 2015 (archiviato dall'url originale il 7 aprile 2017).
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Pila Daniell
Collegamenti esterni
modifica- (EN) Daniell cell, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.