Pila a concentrazione
Una pila a concentrazione è una pila primaria (cioè non ricaricabile) in grado di generare corrente elettrica sfruttando due semicelle galvaniche contenenti la medesima specie chimica ma presente a concentrazione diversa.
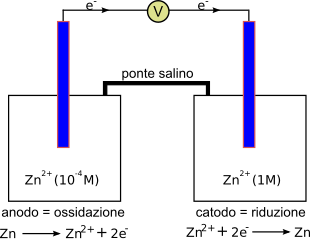
Ad esempio, una siffatta pila può essere costituita da due elettrodi di rame immersi in due soluzioni contenenti solfato di rame (CuSO4) a diversa concentrazione e separate da un setto poroso o da un ponte salino.[1] Il compartimento catodico è costituito dal semielemento formato dal metallo immerso nella soluzione più concentrata, mentre quello anodico è formato dal metallo immerso nella soluzione più diluita.
La pila si scaricherà quando la concentrazione dell'elettrolita nelle due semicelle diverrà la medesima.
Spiegazione teorica
modificaIn generale, per determinare il potenziale di cella di una pila si ricorre all'equazione di Nernst: [2][3][4]
dove:
- E è il potenziale di riduzione
- E0 è il potenziale di riduzione standard
- R è la costante universale dei gas, uguale a 8,314472 J K−1 mol−1 o 0,082057 L atm mol−1 K−1
- T è la temperatura assoluta in K
- ai,red è l'attività chimica della specie i-esima in forma ridotta, ovvero a destra della freccia nella semireazione di riduzione
- ai,ox è l'attività chimica della specie i-esima in forma ossidata, ovvero a sinistra della freccia nella semireazione di riduzione
- νred e νox sono i loro coefficienti stechiometrici
- n è il numero di elettroni trasferiti nella semireazione
- F è la costante di Faraday, uguale a 96485,309 C mol−1.
Il potenziale di cella, che può essere approssimato, alla differenza dei potenziali di riduzione delle due semicelle, può essere visto quindi come la somma di due contributi: un contributo relativo ai potenziali di riduzione standard E0 e un contributo relativo alla temperatura e alle concentrazioni delle specie elettroattive.
Nel caso specifico delle pile a concentrazione, le semicelle presentano lo stesso valore del potenziale di riduzione standard E0 (essendo costituite dalle stesse specie chimiche), per cui il potenziale di cella dipende solo dal secondo contributo, relativo alla concentrazione delle specie elettroattive nelle due semicelle.[5]
Il potenziale di cella (E) è inoltre correlato alla differenza di energia libera di Gibbs (ΔG) dalla seguente relazione:
L'energia di Gibbs può essere inoltre espressa come la differenza tra un contributo entalpico (ΔH) e un contributo entropico (ΔS):
Essendo T la temperatura assoluta.
Nel caso delle pile a concentrazione, il fattore principale che determina il potenziale di cella è la variazione di entropia ΔS, per cui si può scrivere:
Pile a concentrazione in chimica elettroanalitica
modificaUna cella a concentrazione può essere sfruttata in chimica elettroanalitica per determinare la concentrazione di una specie incognita: si sfrutta un semielemento galvanico contenente una quantità nota di sostanza da analizzare e lo si accoppia ad un semielemento formato da un opportuno elettrodo immerso nella soluzione oggetto dell'analisi, misurando la differenza di potenziale e risalendo alla concentrazione incognita tramite l'equazione di Nernst. Il piaccametro, ad esempio, è uno strumento che sfrutta tale principio.
Corrosione dovuta a differenze di concentrazione
modificaSe un materiale metallico è posto a contatto con soluzioni aventi differenti concentrazioni, si può scatenare il fenomeno che avviene all'interno delle pile a concentrazione, dando luogo a fenomeni di corrosione.[6][7]
Tali fenomeni di corrosione sono quindi legati all'effetto di contatto delle superfici metalliche con soluzioni a diversa concentrazione (ad esempio, umidità salmastra in zone di mare) o per il fenomeno dell'aerazione differenziale, dovuto all'effetto dell'ossigeno presente in diversa concentrazione a contatto con zone metalliche (ad esempio una parte metallica è a diretto contatto con l'aria mentre un'altra è sotterrata o immersa in acqua).
Note
modifica- ^ Esperimenti di elettrochimica, su funsci.com. URL consultato il 1º ottobre 2011 (archiviato dall'url originale il 20 ottobre 2010).
- ^ Ullmann's, cap. 2.
- ^ Origine dei potenziali elettrodici
- ^ Alcuni autori sono soliti indicare con E0 il potenziale standard di ossidazione (piuttosto che quello di riduzione), motivo per cui è anche possibile riscontrare l'equazione di Nernst nella forma:
- ^ l'elettrochimica Archiviato l'11 febbraio 2012 in Internet Archive.
- ^ Concentration Cell Corrosion, su corrosion.ksc.nasa.gov. URL consultato il 1º ottobre 2011 (archiviato dall'url originale il 18 febbraio 2013).
- ^ Corrosion Type Concentration Cell Corrosion Archiviato il 3 settembre 2011 in Internet Archive.
Bibliografia
modifica- (EN) Hartmut Wendt, Ullmann's Encyclopedia of Industrial Chemistry, "Electrochemistry", 7ª ed., Wiley-VCH, 2004, DOI:10.1002/14356007.a09_183.
Voci correlate
modificaCollegamenti esterni
modifica- (EN) Concentration cells and absurdities of modern science, su elkadot.com. URL consultato il 1º ottobre 2011 (archiviato dall'url originale il 9 marzo 2012).