Reazione di Favorskij
La reazione di Favorskij[1] consiste nell'attacco nucleofilo di un alchino terminale deprotonato ad un gruppo carbonilico.[2] La reazione venne scoperta nei primi anni del 1900 dal chimico russo Aleksej Evgrafovič Favorskij.[3][4]
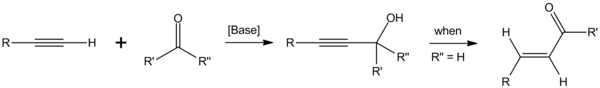
Se acido-catalizzata, essa è nota come riarrangiamento di Meyer–Schuster.
Meccanismo
modificaUn acetiluro metallico viene formato in situ trattando l'alchino con basi forti non nucleofile, tipicamente NaH oppure il terbutossido di potassio.[5] Esso reagisce con una aldeide o un chetone formando un alcol propargilico.[6] Se è presente un atomo di idrogeno in posizione alfa (come nel caso di reazioni con aldeidi), è possibile la trasposizione al corrispondente enone α,β-insaturo.
Uso come gruppo protettivo
modificaQuesta reazione viene utilizzata per proteggere gli alchini: questo gruppo funzionale viene infatti convertito, reagendo ad esempio con l'acetone, al 2-idrossipropil alchino. Questo gruppo protettivo può essere rimosso scaldando il composto in una soluzione di KH e 2-propanolo (una retro-Favorskij).[7]
In alternativa si può ottenere direttamente un alchino utilizzando un prodotto commerciale, come il 2-metil-3-butinin-2-olo, e deproteggendolo.[8]
Note
modifica- ^ Favorskii o Favorsky nella letteratura in lingua inglese; Favorski in quella in lingua tedesca
- ^ Chapter 16. Addition to Carbon–Hetero Multiple Bonds, in March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6th, Hoboken, New Jersey, John Wiley & Sons, Inc., 2007, pp. 1359-1360, DOI:10.1002/9780470084960.ch16, ISBN 978-0-471-72091-1.
- ^ A.E. Favorsky, Action of potassium hydroxide on mixtures of ketones and phenylacetylene, in Zhurnal Russkago Fiziko-Khimicheskago Obshchestva, vol. 37, 1905, pp. 643–645.
- ^ A.E. Favorsky, Action de la potasse caustique sur les mélanges des cétones avec le phénylacétylène, in Bulletin de la Société Chimique de France, vol. 2, 1907, pp. 1087–1088.
- ^ Chemistry of Acetylenes, 1st, New York, Marcel Dekker, inc., 1969, pp. 225-241, DOI:10.1002/ange.19720840843.
- ^ Synthesis of secondary propargyl alcohols from aromatic and heteroaromatic aldehydes and acetylene in the system KOH-H2O-DMSO, in Russian Journal of Organic Chemistry, vol. 49, n. 3, 2013, pp. 356-359, DOI:10.1134/S107042801303007X.
- ^ Chapter 8. Protection for the Alkynes, in Greene's Protective Groups in Organic Synthesis, 4th, Hoboken, New Jersey, John Wiley & Sons, Inc., 2007, p. 932, DOI:10.1002/9780470053485.ch8, ISBN 978-0-471-69754-1.
- ^ <277::AID-EJOC277>3.0.CO;2-R Synthesis of Monodisperse Oligo(para-phenyleneethynylene)s Using Orthogonal Protecting Groups with Different Polarity for Terminal Acetylene Units, in European Journal of Organic Chemistry, vol. 1999, n. 1, 1999, pp. 277–286, DOI:10.1002/(SICI)1099-0690(199901)1999:1<277::AID-EJOC277>3.0.CO;2-R.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su reazione di Favorskij