Sale di Reinecke
Il sale di Reinecke o reineckato di ammonio è il nome comune del composto chimico con formula NH4[Cr(NH3)2(NCS)4]·H2O. In condizioni normali è un solido cristallino di colore rosso scuro. Esiste anche il corrispondente sale di potassio, il reineckato di potassio, K[Cr(NH3)2(NCS)4].
| Sale di Reinecke | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diamminotetratiocianatocromato(III) di ammonio | |
| Nomi alternativi | |
| reineckato di ammonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H12N7OCrS4 |
| Massa molecolare (u) | 354,42 |
| Aspetto | solido rosso scuro |
| Numero CAS | |
| Numero EINECS | 237-003-3 |
| PubChem | 44134924 |
| SMILES | N.N.N.N#CS.N#C[S-].N#C[S-].N#C[S-].[Cr+3] |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 270 °C (543 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 20/21/22, 32, 50/53 |
| Frasi S | 13, 36/37, 46, 60, 61 |
Struttura
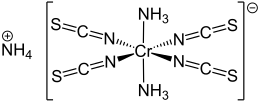
modificaIl cromo nello stato di ossidazione +3 si trova al centro di un complesso ottaedrico, coordinato da sei atomi di azoto. I due leganti NH3 sono disposti in posizione trans. Il sale cristallizza con una molecola di acqua.
Sintesi
modificaIl sale di Reinecke fu descritto per la prima volta da Reinecke nel 1863.[1] Si può preparare trattando NH4SCN fuso (ca. 145–150 °C) con (NH4)2Cr2O7.[2]
Reattività
modificaIl sale di Reinecke non è stabile in soluzione; il complesso si decompone e la soluzione acquosa di colore inizialmente rosso scuro diventa blu con rilascio di cianuro di idrogeno. La velocità di decomposizione cresce all'aumentare della temperatura.[2]
Usi
modificaIl reineckato di ammonio è disponibile in commercio. Veniva comunemente usato per precipitare ammine primarie e secondarie formando i rispettivi sali di ammonio. Si formano precipitati cristallini anche con ammine derivate da amminoacidi come prolina e idrossiprolina. Il sale reagisce inoltre con Hg2+, formando una colorazione rossa o un precipitato rosso.
Il reineckato di potassio è usato come attinometro.[3]
Indicazioni di sicurezza
modificaIl sale di Reinecke è considerato nocivo per inalazione, per contatto con la pelle e per ingestione. Non ci sono dati che indichino proprietà cancerogene. È altamente tossico per gli organismi acquatici.[4]
Note
modifica- ^ Reinecke 1863
- ^ a b Dakin 1943
- ^ Montalti et al. 2006
- ^ Alfa Aesar, Scheda di dati di sicurezza del reineckato di ammonio (PDF), su alfa.com. URL consultato il 4 novembre 2011.
Bibliografia
modifica- H. D. Dakin, Reinecke salt (PDF), in Org. Synth., Coll. Vol. 2, 1943, p. 555. URL consultato il 4 novembre 2011 (archiviato dall'url originale il 29 febbraio 2012).
- M. Montalti, A. Credi, L. Prodi, M. T. Gandolfi, Handbook of photochemistry, 3ª ed., Boca Raton, CRC Press, 2006, ISBN 0-8247-2377-5.
- A. Reinecke, Über Rhodanchromammonium-Verbindungen, in Justus Liebigs Annalen der Chemie, vol. 126, n. 1, 1863, pp. 113-118, DOI:10.1002/jlac.18631260116. URL consultato il 4 novembre 2011.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Sale di Reinecke