Riarrangiamento di Curtius
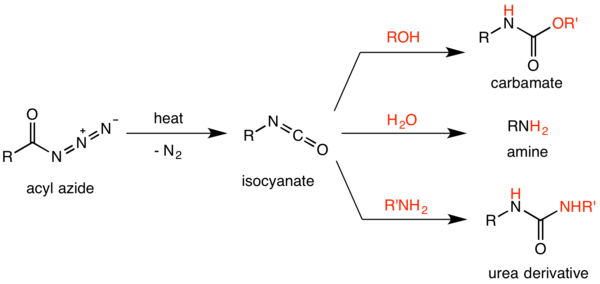
Il riarrangiamento di Curtius (o reazione di Curtius o degradazione di Curtius), descritta per la prima volta da Theodor Curtius nel 1885, è una decomposizione termica di un azoturo acilico, che attraverso la perdita di azoto gassoso forma un isocianato.[1][2] L'isocianato formatosi può essere attaccato da vari tipi di nucleofili come acqua, alcoli e ammine, ottenendo rispettivamente un'ammina primaria, un carbammato o un derivato dell'urea.[3] Su questa reazione sono stati effettuati parecchi studi al fine di comprenderne il meccanismo.[4][5]
Preparazione dell'azoturo acilico
modificaL'azoturo acilico viene preparato dalla reazione di un cloruro acilico o di un'anidride[6] con azoturo di sodio o trimetilsilil azoturo.[7] Si può ottenere anche dal trattamento di un'acilidrazina con acido nitroso.[8] L'azoturo acilico si può anche formare dalla reazione diretta di un acido carbossilico con difenilfosforil azide (DPPA).[9]
Meccanismo di reazione
modificaOriginariamente si credeva che il riarrangiamento di Curtius fosse un processo in due step, con la perdita di azoto gassoso per formare un acil nitrene, seguito dalla migrazione di un gruppo -R per dare l'isocianato. Tuttavia ricerche recenti indicano che la decomposizione termica avviene con un meccanismo concertato, con entrambi gli step di reazione che si verificano insieme, poiché è stata verificata l'assenza di sottoprodotti di inserzione o addizione al nitrene, che non sono stati né osservati né isolati.[10] Calcoli termodinamici supportano la teoria del meccanismo concertato.[11]
La migrazione del gruppo -R avviene con piena ritenzione della configurazione. L'attitudine migratoria del gruppo -R può essere approssimativamente indicata nell'ordine: gruppo terziario > secondario ~ arilico > primario.
Modifiche
modificaAlcune ricerche hanno dimostrato che il riarrangiamento di Curtius è catalizzato sia da acidi di Brønsted[12] sia di Lewis, attraverso rispettivamente, la protonazione, o la coordinazione dell'atomo di ossigeno del gruppo acilico. Per esempio, Fahr and Neumann dimostrarono che l'uso di trifluoruro di boro o tricloruro di boro come catalizzatori, riduce la temperatura di decomposizione necessaria per il riarrangiamento di circa 100 °C e permette un aumento della resa di isocianato in maniera significativa.[13]
Riarrangiamento fotochimico
modificaLa decomposizione dell'azoturo acilico è possibile anche per via fotochimica.[14] Tuttavia il riarrangiamento fotochimico non presenta un meccanismo concertato, ma avviene tramite un intermedio nitrenico altamente reattivo, il quale può reagire in vari modi per formare sottoprodotti non voluti.[15] Nell'esempio seguente il nitrene formatosi reagisce con il solvente, il cicloesano, e si forma N-cicloesilbenzammide come sottoprodotto.
Note
modifica- ^ Curtius, Th., Ueber Stickstoffwasserstoffsäure (Azoimid) N3H, in Berichte der Deutschen chemischen Gesellschaft zu Berlin, vol. 23, 1890, pp. 3023-3033, DOI:10.1002/cber.189002302232.
- ^ 20. Hydrazide und Azide organischer Säuren I. Abhandlung, in Journal für Praktische Chemie, vol. 50, 1894, pp. 275–294, DOI:10.1002/prac.18940500125.
- ^ Kaiser, C.; Weinstock, J. (1988).
- ^ Smith, P. A. S., The Curtius reaction, in Organic Reactions, vol. 3, 1946, pp. 337-449.
- ^ Azides: their preparation and synthetic uses, in Chemical Reviews, vol. 88, n. 2, 1988, p. 297, DOI:10.1021/cr00084a001.
- ^ Modified Curtius reaction, in J. Org. Chem., vol. 26, 1961, DOI:10.1021/jo01067a604.
- ^ Formation and Curtius rearrangment of acyl azides from unreactive acid chlorides, in Synth. Commun., vol. 10, 1980, pp. 107-110, DOI:10.1080/00397918008061812.
- ^ Azide synthesis with stable nitrosyl salts, in Tetrahedron Lett., vol. 28, 1987, pp. 5091-5092, DOI:10.1016/s0040-4039(00)95598-9.
- ^ New convenient reagent for a modified Curtius reaction and for peptide synthesis, in J. Am. Chem. Soc., vol. 94, 1972, pp. 6203-6205, DOI:10.1021/ja00772a052.
- ^ A theoretical study of the Curtius rearrangement. The electronic structures and interconversion of the CHNO species., in Can. J. Chem., vol. 55, 1977, pp. 1498-1510, DOI:10.1139/v77-209.
- ^ Decomposition and addition reactions of organic azides, in Chem. Rev., vol. 69, 1969, pp. 345-363, DOI:10.1021/cr60259a004.
- ^ The decomposition of substituted benzazides in acidic solvents, the acid catalysis, in J. Am. Chem. Soc., vol. 81, 1959, pp. 2007-2012, DOI:10.1021/ja01517a055.
- ^ Curtius-Reaktion mit Bortrihalogeniden, in Angew. Chem., vol. 77, 1965, DOI:10.1002/ange.19650771308.
- ^ Curtius rearrangment of acyl azides revisited - formation of cyanate, in Eur. J. Org. Chem., 2005, pp. 4521-4524.
- ^ Ein Betrag zur Isocyanatbildung bei der Photolyse von Acylaziden, in Tetrahedron Lett., vol. 30, 1974, pp. 2569-2572.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Riarrangiamento di Curtius
| Controllo di autorità | GND (DE) 4703222-4 |
|---|