Sale di Mohr
Il solfato ferroso ammonico esaidrato (o ferro(II) ammonio solfato o sale di Mohr) è un sale misto di ammonio e ferro(II) dell'acido solforico.
| Sale di Mohr | |
|---|---|
 | |
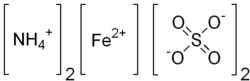 | |
| Nomi alternativi | |
| ferro (II) ammonio solfato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (NH4)2Fe(SO4)2 · 6 H2O |
| Massa molecolare (u) | 392,14 g/mol |
| Aspetto | solido azzurro-verde |
| Numero CAS | |
| Numero EINECS | 233-151-8 |
| PubChem | 71312611, 24863 e 57495516 |
| SMILES | N.N.OS(=O)(=O)[O-].OS(=O)(=O)[O-].[Fe+2] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,86 (20 °C) |
| Solubilità in acqua | 269 g/l (20 °C) |
| Temperatura di fusione | 100 °C (373 K) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [1] |
A temperatura ambiente si presenta come un solido blu-verde inodore. Essendo un sale ferroso, viene spesso usato come agente riducente in titolazioni di ossido-riduzione.
Il sale di Mohr prende il nome dal chimico tedesco Karl Friedrich Mohr, che nel XIX secolo fece importanti progressi nella metodologia delle titolazioni.
È un comune reagente di laboratorio perché cristallizza velocemente e i cristalli resistono all'ossidazione dell'aria. Come gli altri sali di solfato ferroso, il solfato di ammonio ferroso si dissolve in acqua per dare il complesso acquoso [Fe(H2O)6]2+, che ha una geometria molecolare ottaedrica.[2] La sua forma minerale è la mohrite.
Struttura
modificaQuesto composto fa parte di un gruppo di doppi solfati chiamati Schönites o sali di Tutton. I sali di Tutton formano cristalli monoclini e hanno la formula M2N(SO4)2*6H2O (M = catione monovalente). Per quanto riguarda il legame, i cristalli sono costituiti da ottaedri [Fe(H2O)6]2+ centrali, che formano legami a idrogeno con il solfato e l'ammonio.[3]
Applicazioni
modificaNella chimica analitica, questo sale è la fonte preferita di ioni ferrosi poiché il solido ha una lunga durata, essendo resistente all'ossidazione. Questa stabilità si estende in qualche modo alle soluzioni che riflettono l'effetto del pH sulla coppia redox ferrosa/ferrica. Questa ossidazione si verifica più facilmente a pH elevato. Gli ioni ammonio rendono le soluzioni del sale di Mohr leggermente acide, il che rallenta il processo di ossidazione.[2][4] L'acido solforico viene comunemente aggiunto alle soluzioni per ridurre l'ossidazione a Fe3+.
È usato nel dosimetro di Fricke per misurare elevate dosi di raggi gamma.[5]
Preparazione
modificaIl sale di Mohr viene preparato sciogliendo una miscela equimolare di solfato ferroso idratato e solfato di ammonio in acqua contenente un po' di acido solforico, quindi sottoponendo la soluzione risultante alla cristallizzazione.
Contaminanti
modificaLe impurità comuni includono magnesio, nichel, manganese, piombo e zinco, molti dei quali formano sali isomorfi.[6]
Note
modifica- ^ scheda della sostanza su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b (EN) Norman N. Greenwood e Alan Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, ISBN 978-0-08-037941-8.
- ^ Fritz Ephraim, Inorganic Chemistry, tr P. C. L. Thorne, London, Gurney and Jackson, 1926, pp. 484–485.
- ^ Ammonium Ferrous Sulphate 100 g (Mohr’s Salt), su oxfordchemserve.com, 2012. URL consultato il 13 giugno 2013.
- ^ (EN) C. Hickman, S. Lorrain, J.R. Barthe e G. Portal, Use of Mohr's Salt for High Level Gamma Dosimetry (Up to 108 Gy), in Radiation Protection Dosimetry, vol. 17, n. 1-4, 1º dicembre 1986, pp. 255–257, DOI:10.1093/oxfordjournals.rpd.a079818. URL consultato il 22 gennaio 2023.
- ^ Arthur I. Vogel, A Text-book of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis, 3ª ed., Longmans, 1961, pp. 281–282.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Sale di Mohr