Sale doppio
Un sale doppio è il prodotto dell'unione di due sali semplici aventi l'anione in comune e il catione diverso, o, più raramente, il contrario.
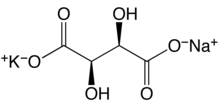
Molto raramente si possono incontrare sali doppi aventi sia l'anione, sia il catione diversi.
Esempi
modificaEsempi di sale doppio sono:
- il tartrato di sodio e potassio
- la serie degli allumi, caratterizzati dalla formula generale MIMIII(SO4)2•12H2O
- i cosiddetti sali di Tutton, molti dei quali sono caratterizzati dalla formula generale MI2MII(SO4)2•6H2O
- la alstonite
- la carnallite
Riconoscimento
modificaI sali doppi, contrariamente ai sali complessi, si dissociano in soluzione in modo esattamente uguale a come farebbero i sali semplici che lo compongono. Più semplicemente i sali doppi sono riconoscibili in quanto hanno due metalli.
Ad esempio, il potassio magnesio solfato, si dissocia in questo modo:
esattamente come se si solubilizzassero il solfato di potassio ed il solfato di magnesio:
come si può notare, in questo caso l'anione SO42− è in comune, mentre sono presenti due cationi, il potassio ed il magnesio.
Bibliografia
modifica- Chr. Balarew, Mixed Crystals and Double Salts between Metal (II) Salt Hydrates. Z. Krist. 181, 35-82 (1987).
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Sale doppio
| Controllo di autorità | J9U (EN, HE) 987007553421805171 |
|---|