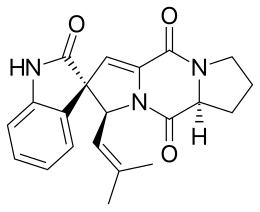
Spirotriprostatina B
La spirotriprostatina B è un alcaloide indolico presente nel fungo Aspergillus fumigatus che appartiene a una classe di 2,5-dichetopiperazine naturali.[1] La spirotriprostatina B, similmente a molti altri alcaloidi indolici (tra cui la spirotriprostatina A, nonché altre triprostatine e ciclotriprostatine) ha proprietà antimitotiche, rendendo questa classe di molecole di grande interesse negli studi riguardanti i farmaci antitumorali.[2] Per questo motivo, nella letteratura chimica sono state pubblicate numerose sintesi totali di questi composti.
| Spirotriprostatina B | |
|---|---|
 | |
| Nome IUPAC | |
| (2S,3S,5aS)-2′-Idrossi-3-(2-metilprop-1-en-1-yl)-5a,6,7,8-tetraidro-3H,5H,10H-spiro[dipirrolo[1,2-a:1′,2′-d]pirazolo-2,3′-indolo]-2',5,10-trione | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H21N3O3 |
| Massa molecolare (u) | 363,417 |
| PubChem | 9928968 |
| SMILES | O=C1C=3N(C(=O)[C@H]2N1CCC2)[C@@H](\C=C(/C)C)[C@]5(C=3)c4ccccc4NC5=O |
| Indicazioni di sicurezza | |
Sintesi totale
modificaLa prima sintesi totale della molecola è stata realizzata nel 2000 dal gruppo Danishefsky della Columbia University.[3] A questo studio seguirono numerose ricerche che riportarono i risultati di altre sintesi proposte da Williams,[4] Ganesan,[5] Fuji,[6] Carreira,[7] Horne,[8] Overman[9] e, più recentemente, Trost.[10]
Da un punto di vista sintetico, la molecola presenta caratteristiche strutturali impegnative da replicare in laboratorio, come ad esempio la giuntura dell'anello spirociclico in posizione C3 e l'adiacente carbonio prenil-sostituito. Gli approcci concettuali verso la preparazione dello scheletro molecolare della spirotriprostatina B sono variati considerevolmente nel corso degli anni. Nei successivi paragrafi sono sintetizzate le caratteristiche principali delle diverse vie sintetiche finora proposte.
Sintesi di Danishefsky
Nella sintesi di Danishefsky, un'ammina derivata dal triptofano condensa con un'aldeide in una reazione di Mannich, in cui l'ossindolo pendente agisce come nucleofilo nei confronti dell'intermedio imminio formato in situ.
Sintesi di Williams
La sintesi di Williams utilizza una reazione di accoppiamento a 3 componenti. Un'ammina secondaria è stata combinata con un'aldeide per formare un'ilide azometinica intermedia, la quale subisce di seguito una cicloaddizione 1,3-dipolare con un ossindolo insaturo presente anch'esso nella stessa miscela di reazione.
Sintesi di Ganesan
Ganesan ha utilizzato una strategia biomimetica nella sintesi della spirotriprostatina B. Un indolo è stato trattato con N-bromosuccinimmide in una miscela di THF, acido acetico e acqua per innescare un riarrangiamento ossidativo, formando lo stereocentro quaternario in modo diastereoselettivo.
Sintesi di Fuji
Nella sintesi sviluppata dal gruppo del professor Fuji, la stereochimica del carbonio spirociclico è stata stabilita mediante una reazione di nitroolefinazione. Un ossindolo con gruppo prenilico è stato fatto reagire con una nitroolefina recante un gruppo uscente chirale, in modo da garantire nel composto finale la stereochimica corretta.
Sintesi di Carreira
Carreira ha utilizzato una reazione di annulazione promossa da ioduro di magnesio per ottenere la molecola di spirotriprostatina B. Un ossindolo contenente un ciclopropano è stato fatto reagire con un'immina in presenza di ioduro di magnesio, innescando la reazione di espansione dell'anello ciclopropanico.
Sintesi di Horne
Anche la sintesi della spirotriprostatina B da parte di Horne si avvale della reazione di Mannich per ottenere lo scheletro molecolare finale. In questo caso, un derivato cloro-indolico funge da pro-nucleofilo. La ciclizzazione viene innescata trattando l'immina con il cloruro acilico derivato dalla prolina. La moecola intermedia di imminio è poi attaccata dal derivato cloro-indolicoo, formando il legame spirociclico desiderato.
Sintesi di Overman
Nella sintesi proposta da Overman si utilizza una reazione di Heck per preparare la molecola. Una iodoanilina funzionalizzata con un alchene viene sottoposta a ciclizzazione tramite la reazione di Heck, con apposita catalisi al palladio descritta in figura. La specie intermedia palladio-allile reagisce immediatamente con l'azoto ammidico per generare lo stereocentro prenilico nella stessa reazione.
Sintesi di Trost
Nella sintesi di Trost, la stereochimica del carbonio C3, giunzione dell'anello spirociclico, si ottiene da una sequenza di decarbossilazione-prenilazione, che ricorda il riarrangiamento di Carroll. In questo caso, un estere prenilico funge sia da precursore nucleofilo che da precursore elettrofilo. A seguito del trattamento con un catalizzatore chirale al palladio in toluene, il gruppo prenilico ionizza e decarbossila. La coppia di ioni risultante si ricombina successivamente per generare il prodotto prenilato. In particolare, si verifica la migrazione del doppio legame e il gruppo prenilico viene attaccato al carbonio ossindolico.
Note
modifica- ^ A.D. Borthwick et al., "2,5-Diketopiperazines: Synthesis, Reactions, Medicinal Chemistry, and Bioactive Natural Products", in Chemical Reviews, vol. 112, n. 7, 2012, DOI:10.1021/cr200398y, PMID 22575049.
- ^ C.B. Cui, "Spirotryprostatin B, a novel mammalian cell cycle inhibitor produced by Aspergillus fumigatus, in J. Antibiot., vol. 49, n. 8, 1996, DOI:10.7164/antibiotics.49.832, PMID 8823522.
- ^ F. von Nussbaum e S.J. Danishefsky, <2175::AID-ANIE2175>3.0.CO;2-J "A Rapid Total Synthesis of Spirotryprostatin B: Proof of Its Relative and Absolute Stereochemistry", in Angew. Chem. Int. Ed., vol. 39, n. 12, 2000, DOI:10.1002/1521-3773(20000616)39:12<2175::AID-ANIE2175>3.0.CO;2-J, PMID 10941053.
- ^ P.R. Sebahar e R.M. Williams, "The Asymmetric Total Synthesis of (+)- and (−)-Spirotryprostatin B", in J. Am. Chem. Soc., vol. 122, n. 23, 2000, DOI:10.1021/ja001133n.
- ^ H. Wang e A. Ganesan, "A Biomimetic Total Synthesis of (−)-Spirotryprostatin B and Related Studies", in J. Org. Chem., vol. 65, n. 15, 2000, DOI:10.1021/jo000306o, PMID 10959875.
- ^ T.D. Bagul e K. Fuji et al., "Total Synthesis of Spirotryprostatin B via Asymmetric Nitroolefination", in Org. Lett., vol. 4, n. 2, 2002, DOI:10.1021/ol016999s, PMID 11796062.
- ^ C. Meyers e E.M. Carreira, "Total Synthesis of (−)-Spirotryprostatin B", in Angew. Chem. Int. Ed., vol. 42, n. 6, 2003, DOI:10.1002/anie.200390192, PMID 12575009.
- ^ F.Y. Miyake e D.A. Horne et al., "Preparation and Synthetic Applications of 2-Halotryptophan Methyl Esters: Synthesis of Spirotryprostatin B", in Angew. Chem. Int. Ed., vol. 43, n. 40, 2004, DOI:10.1002/anie.200460419, PMID 15468070.
- ^ L.E. Overman e M.D. Rosen, <4596::AID-ANIE4596>3.0.CO;2-F "Total Synthesis of (−)-Spirotryprostatin B and Three Stereoisomers", in Angew. Chem. Int. Ed., vol. 39, n. 24, 2000, DOI:10.1002/1521-3773(20001215)39:24<4596::AID-ANIE4596>3.0.CO;2-F, PMID 11169682.
- ^ B.M. Trost e D.T. Stiles, "Total Synthesis of Spirotryprostatin B via Diastereoselective Prenylation", in Org. Lett., vol. 9, n. 15, 2007, DOI:10.1021/ol070971k, PMID 17592853.