Tetrafluoroborato
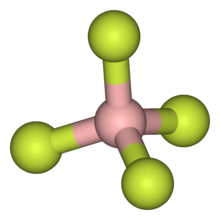
Tetrafluoroborato è il nome dell'anione di formula BF4−. È una specie tetraedrica, isostrutturale con le specie isoelettroniche tetrafluorometano CF4 e tetrafluoroammonio NF4+, e isostrutturale anche con numerose specie stabili e importanti come gli anioni solfato SO42− e perclorato ClO4−, che sono isolettronici rispetto agli elettroni di valenza.[1]
Sintesi
modificaL'anione BF4− si può sintetizzare per reazione di fluoruri con l'acido di Lewis trifluoruro di boro (BF3). La reazione va condotta in assenza di solvente o in solventi non acquosi come acido fluoridrico (HF), trifluoruro di bromo (BrF3), o anidride solforosa (SO2).[2]
Caratteristiche e utilizzo
modificaBF4− è un anione molto inerte e con scarsa tendenza alla coordinazione, sia perché la sua singola carica negativa è distribuita sui quattro atomi di fluoro, sia perché la presenza degli atomi di fluoro molto elettronegativi rendono poco basico l'anione. Per queste caratteristiche BF4− è molto usato in chimica sia organica che inorganica per isolare e precipitare i cationi più disparati. I sali ottenuti con BF4− hanno anche il vantaggio di essere in genere più solubili in solventi organici rispetto ai corrispondenti alogenuri o nitrati.[3]
L'anione BF4− è spesso usato per isolare sali di cationi molto reattivi. Alcuni esempi sono:
- Sali di diazonio con formula generale ArN2+ (Ar = arile).
- Reattivi di Meerwein come OEt3+, uno dei più forti agenti alchilanti noti.
- Il nitrosonio NO+, ben noto ossidante monoelettronico.
- Il nitronio NO2+, usato nelle reazioni di nitrazione.
- Il ferrocenio [Fe(C5H5)2]+.
Esistono tuttavia casi in cui il comportamento di BF4− non è "innocente": cationi estremamente reattivi come quelli derivati da titanio, zirconio, afnio e silicio riescono ad estrarre fluoruro da BF4−. In tali casi bisogna ricorrere ad anioni ancora meno coordinanti.
L'uso di BF4− ha contribuito a diminuire l'impiego di perclorato ClO4− come precipitante, perché BF4− non ha la tendenza a formare composti esplosivi come ClO4−, anche se ha lo svantaggio di essere più sensibile all'idrolisi.
Note
modificaBibliografia
modifica- (EN) J. Emri e B. Györi, Boron, in G. Wilkinson, R. D. Gillard e J. A. McCleverty (a cura di), Comprehensive Coordination Chemistry, vol. 3, 1ª ed., Oxford, Pergamon Press, 1987, ISBN 0-08-035946-9.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file sul tetrafluoroborato