Tetrafluoroidrazina
La tetrafluoroidrazina è il composto inorganico binario dell'azoto trivalente con il fluoro, avente formula N2F4, o anche F2N–NF2, dove però l'azoto è nello stato di ossidazione +2. Questo alogenuro di azoto in condizioni normali è un gas incolore fortemente reattivo.[2] Può esplodere facilmente a contatto con aria, ossigeno, sostanze organiche, calore e catalizzatori metallici.[1]
| Tetrafluoroidrazina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,1,2,2-tetrafluoroidrazina | |
| Nomi alternativi | |
| tetrafluoroidrazina tetrafluoruro di diazoto fluoruro di azoto(II) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F4N2 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 233-114-6 |
| PubChem | 24845 |
| SMILES | N(N(F)F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,5 (liq. a -100 °C)[1] |
| Temperatura di fusione | −164,5 °C (109 K)[2] |
| Temperatura di ebollizione | −73 °C (200 K)[2] |
| Tensione di vapore (Pa) a 20 °C K | 2,40 MPa[1] |
| Proprietà termochimiche | |
| ΔfG0 (kJ·mol−1) | +81,2[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 270 - 280 - 314 - 330 [1] |
Struttura
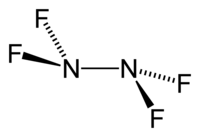
modificaAllo stato gassoso e allo stato liquido la molecola N2F4 esiste in due conformazioni tra loro in equilibrio (Figura 1), la forma gauche e quella sfalsata, con simmetria rispettivamente C2 e C2h. La configurazione sfalsata è favorita di solo 2 kJ/mol. La distanza N–N risulta 148 pm e quella N–F 139 pm.[2][3]
Sintesi
modificaLa tetrafluoroidrazina fu sintetizzata per la prima volta nel 1958 da Charles B. Colburn e Al Kennedy,[4] facendo reagire a 375 ºC in un reattore a flusso trifluoruro di azoto in presenza di trucioli di rame.[2]
Alternativamente si può ossidare la difluoroammina con ipoclorito a pH basico (circa 12):[2]
Reattività
modificaN2F4 è un agente fluorurante molto energico. Ad esempio può fluorurare silano e litio:[2]
Con forti accettori di ioni fluoruro come AsF5 forma sali che si possono formulare come [N2F3]+[AsF6]−.[2]
La tetrafluoroidrazina si dissocia facilmente formando radicali •NF2, di colore blu scuro. Questo comportamento giustifica la maggior reattività di N2F4 rispetto all'inerzia di NF3.[2][3] Il radicale •NF2 può dare varie reazioni, tra le quali anche l'addizione ad olefine:[3][5]
Note
modificaBibliografia
modifica- (EN) C. B. Colburn e A. Kennedy, Tetrafluorohydrazine, in J. Am. Chem. Soc., vol. 80, n. 18, 1958, p. 5004, DOI:10.1021/ja01551a059.
- GESTIS, gestis.dguv.de, 2020, https://gestis.dguv.de/data?name=490981&lang=en. URL consultato il 14 luglio 2023. Pagina della tetrafluoroidrazina nel data base GESTIS.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su tetrafluoroidrazina