Cloroformio
Il cloroformio, nome IUPAC triclorometano, è un composto chimico di formula CHCl3. È un alometano e in particolare un aloformio (trialogenometano),[1] che è il nome alla serie costituita, oltre ad esso, da CHF3 (fluoroformio), CHBr3 (bromoformio) e CHI3 (iodoformio), in cui l'atomo di carbonio è allo stato di ossidazione +2. È noto anche con le sigle commerciali freon 20 o CFC 20.
| Cloroformio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triclorometano | |
| Nomi alternativi | |
| freon 20 CFC 20 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CHCl3 |
| Massa molecolare (u) | 119,38 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-663-8 |
| PubChem | 6212 |
| DrugBank | DBDB11387 |
| SMILES | C(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,47 |
| Solubilità in acqua | 8 g/l a 293 K |
| Temperatura di fusione | −63 °C (210 K) |
| Temperatura di ebollizione | 61 °C (334 K) |
| ΔebH0 (kJ·mol−1) | 31,4 |
| Tensione di vapore (Pa) a 293 K | 21300 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −134,1 |
| ΔfG0 (kJ·mol−1) | −73,7 |
| S0m(J·K−1mol−1) | 201,7 |
| C0p,m(J·K−1mol−1) | 114,2 |
| Indicazioni di sicurezza | |
| Temperatura di autoignizione | 982 °C (1255 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 315 - 319 - 331 - 336 - 351 - 361d - 372 |
| Consigli P | 201 - 202 - 260 - 264 - 270 - 271 - 280 - 281 - 301+330+331 - 302+352 - 304+340 - 305+351+338 - 308+313 - 314 |
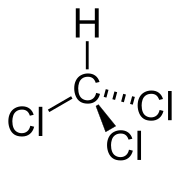
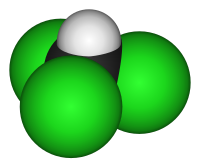
La sua struttura chimica deriva formalmente da quella di una molecola di metano in cui tre atomi di idrogeno sono stati sostituiti da tre atomi di cloro, con l'atomo di carbonio collocato al centro, ibridato sp3. Ne risulta una forma tetraedrica distorta avente simmetria C3v.[2]
A temperatura ambiente è un liquido incolore, denso (d = 1,47 g/mL), abbastanza volatile (Teb = 61 °C), dal caratteristico odore dolciastro. Non è infiammabile da solo, ma lo è in miscela con altri composti infiammabili.
È un composto nocivo alla salute umana e all'ambiente, nonché un forte sospetto cancerogeno.
Il cloroformio, esposto alla luce e in presenza di ossigeno atmosferico si trasforma nel ben più tossico e pericoloso fosgene. Per questo motivo viene conservato in contenitori ambrati e ben chiusi.
Storia
modificaIl cloroformio fu prodotto per la prima volta nel 1831 sia da Justus von Liebig sia da Eugène Soubeiran sia dall'americano Samuel Guthrie. Tutti e tre lo ottennero dalla reazione tra ipoclorito di calcio e acetone o etanolo, un'applicazione della reazione oggi nota come reazione dell'aloformio, tuttavia i tre ricercatori non conoscevano ancora la struttura chimica del composto e supposero di aver sintetizzato il dicloroetano.
Nel 1834 il chimico francese Jean-Baptiste Dumas identificò la formula chimica e diede il nome al composto scoperto di cloroformio.
Nel 1847 l'ostetrico di Edimburgo James Young Simpson usò il cloroformio per anestetizzare le pazienti durante il parto; da allora l'uso si estese alla chirurgia, specialmente in Europa. Negli Stati Uniti non si rimpiazzò l'etere come anestetico fino all'inizio del XX secolo, tuttavia fu presto abbandonato una volta noti i suoi effetti tossici indesiderati e appurata la sua tendenza a provocare delle fatali aritmie cardiache. Attribuita al cloroformio fu la morte di Edwin Bartlett causata dalla moglie Adelaide protagonista di un famoso processo tenuto nella Londra del XIX secolo. A partire dal 1900 il cloroformio fu definitivamente sostituito dall'etere nelle anestesie.
Iniezioni di cloroformio nel cuore sono state utilizzate da Josef Mengele per uccidere i gemelli monozigoti sui quali eseguiva i suoi esperimenti.[3]
Produzione
modificaA livello industriale, il cloroformio è prodotto per riscaldamento di una miscela di cloro e metano o cloruro di metile alla temperatura di 400-500 ºC. A questa temperatura avvengono reazioni di sostituzione radicalica che convertono il metano nei corrispondenti composti clorurati.
CH4 + Cl2 → CH3Cl + HClCH3Cl + Cl2 → CH2Cl2 + HClCH2Cl2 + Cl2 → CHCl3 + HClCHCl3 + Cl2 → CCl4 + HCl
Il prodotti di questa reazione costituiscono una miscela dei quattro clorometani (mono-, di-, tri- e tetraclorometano), i quali vengono successivamente separati per distillazione.
Utilizzi
modificaA cavallo tra il XIX ed il XX secolo il cloroformio era usato come anestetico per inalazione in chirurgia e nelle preparazioni di sciroppi antitosse.[4] Oggi è stato sostituito da sostanze meno tossiche. In alcuni telefilm della serie Ironside, il cloroformio viene iniettato endovena per ottenere un effetto anestetico temporaneo; ciò è tuttavia privo di qualsiasi significato.
Il principale utilizzo del cloroformio oggi è la produzione di clorodifluorometano (CHClF2, freon R-22 o anche HCFC-22),[5] usato come fluido refrigerante, tuttavia anche i freon sono stati messi internazionalmente al bando per via del loro effetto distruttivo sullo strato di ozono dell'alta atmosfera.
Piccole quantità di cloroformio sono usate come solvente nei laboratori - anche se la tendenza è quella di sostituirlo ovunque possibile con il meno pericoloso cloruro di metilene - ed in alcuni processi industriali.
Il cloroformio reagisce con l'idrossido di sodio in soluzione acquosa - preferibilmente in presenza di un catalizzatore di trasferimento di fase - per produrre in situ il diclorocarbene; questo reagisce rapidamente con composti aromatici attivati (come i fenoli) producendo le corrispondenti aril-aldeidi (reazione di Reimer-Tiemann di idroformilazione). Il diclorocarbene può anche reagire con un alchene addizionandosi al doppio legame e producendo un diclorociclopropano sostituito.
Il cloroformio deuterato, CDCl3, in cui l'atomo di idrogeno è rimpiazzato da un atomo di deuterio, è uno dei più comuni solventi usati nella spettroscopia di risonanza magnetica nucleare (NMR).
Il cloroformio viene anche utilizzato nell'artigianato per incollare il metacrilato (plexiglas).
Precauzioni
modificaIn laboratori amatoriali una volta sintetizzato il cloroformio tramite reazione aloformica, o reazione dell'aloformio, viene stabilizzato con una piccola aggiunta di etanolo per prevenire la formazione di fosgene causata dall'ossidazione del cloroformio con l'ossigeno atmosferico, viene quindi piuttosto ossidato l'etanolo in acido acetico.
L'inalazione di cloroformio ha un effetto deprimente sul sistema nervoso centrale, da qui il suo effetto anestetico. La respirazione di aria contenente 900 ppm di cloroformio produce in breve tempo confusione, affaticamento e mal di testa. Un'esposizione prolungata può produrre danni al fegato (dove viene metabolizzato in fosgene) e ai reni. In alcuni soggetti, l'esposizione può produrre irritazioni alla pelle e reazioni allergiche con febbre fino a 40 ºC.
Sperimentazioni su topi hanno dimostrato che l'esposizione durante la gravidanza ad aria contenente da 30 a 300 ppm di cloroformio o la sua ingestione può produrre aborti o nascite di cuccioli malformati. Nei maschi si è osservata un'alterazione dello sperma. L'effetto del cloroformio sulla riproduzione umana non è noto.
Sospetto agente cancerogeno come evidenziato nelle monografie pubblicate dalla International Agency for Research on Cancer (IARC) [PDF], probabilmente associato al carcinoma epatocellulare, è stato bandito in molte nazioni dall'uso in prodotti farmaceutici o ausiliari (dentifrici, sciroppi, unguenti).
Note
modifica- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, pp. 117-118.
- ^ CCCBDB Experimental Data page 1, su cccbdb.nist.gov. URL consultato il 19 febbraio 2023.
- ^ Josef Mengele: l'angelo della morte di Auschwitz Archiviato il 25 giugno 2013 in Internet Archive.
- ^ Per questo motivo, il cloroformio fa spesso la sua comparsa nei film e nei romanzi polizieschi d'epoca, dove viene spesso usato per mettere temporaneamente fuori combattimento qualcuno.
- ^ (EN) Velisa Vesovic, CHLOROFORM, Begel House Inc., 8 febbraio 2011, ISBN 978-1-56700-456-4. URL consultato il 15 agosto 2023.
Voci correlate
modificaAltri progetti
modifica- Wikiquote contiene citazioni sul cloroformio
- Wikizionario contiene il lemma di dizionario «cloroformio»
- Wikimedia Commons contiene immagini o altri file sul cloroformio
Collegamenti esterni
modifica- clorofòrmio, su sapere.it, De Agostini.
- (EN) Francis A. Carey, chloroform, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 38594 · LCCN (EN) sh85024563 · GND (DE) 4123008-5 · BNF (FR) cb12430403w (data) · J9U (EN, HE) 987007285616305171 |
|---|