Trifluoruro di iodio
Il trifluoruro di iodio o fluoruro di iodio(III) è il composto binario interalogenico dello iodio trivalente con il fluoro, avente formula IF3. In questo fluoruro lo iodio è nello stato di ossidazione +3. È un solido giallo, stabile solo al di sotto di –28 °C.[2][3]
| Trifluoruro di iodio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| trifluoruro di iodio, fluoruro di iodio(III) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F3I |
| Peso formula (u) | 183,9 |
| Aspetto | solido giallo[1] |
| Numero CAS | |
| PubChem | 13932268 |
| SMILES | FI(F)F |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | −28 °C (245 K) dec[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | ≈ –486[2] |
| Indicazioni di sicurezza | |
Sintesi
modificaIl composto fu descritto per la prima volta nel 1960 da Schmeisser e Scharf,[4] che lo ottennero per sintesi diretta introducendo fluoro in una soluzione di iodio in CCl3F a –78 °C.[5] Le condizioni di sintesi vanno scelte con cura per evitare la formazione di IF5.[6] Un'altra possibilità è fluorurare lo iodio con difluoruro di xeno:[3]
- I2 + 3 XeF2 → 2 IF3 + 3 Xe
Proprietà e struttura
modificaIl trifluoruro di iodio è una sostanza termodinamicamente molto stabile (ΔHƒ° = -486 kJ/mol),[7] ma cineticamente instabile: sopra a –28 °C,[2][3] e molto più a temperatura ambiente, tende a disproporzionarsi in iodio elementare (I0) e pentafluoruro di iodio (IV):[5]
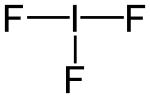
La struttura cristallina di IF3 è ortorombica, gruppo spaziale Pcmn, con costanti di reticolo a = 465,0 pm, b = 655,5 pm, e c = 875,5 pm, con quattro unità formula per cella elementare. La molecola IF3, avendo l'atomo di iodio centrale 3 legami sigma e due coppie solitarie, assume la forma a T prevista in base alla teoria VSEPR o anche in base all'ibridazione sp3d dell'atomo centrale di iodio.[8][9] In ogni caso, ne risulta una struttura a bipiramide trigonale distorta in cui le tre posizioni equatoriali sono occupate da un F (Feq) e due coppie solitarie, mentre le due assiali sono occupate da due F (Fax). I due atomi Fax, pressoché opposti, hanno distanze I–F di 198 pm e l'angolo F–I–F è di 160,3° (< 180°), mentre il fluoro equatoriale ha distanza I–F di 187 pm;[10] per confronto, la lunghezza del legame I–F nel fluoruro di iodio(I) (190,97 pm[11]) è intermedia, ma più vicina a quella del legame equatoriale. Come accade quasi invariabilmente, anche qui il legame equatoriale è più corto rispetto a quelli assiali.[8] La molecola ha simmetria molecolare appartenente al gruppo puntuale C2v.[12]
Il trifluoruro di iodio è anche un acido di Lewis e in particolare un accettore di fluoruro, come pure gli analoghi BrF3 e ClF3: reagisce con i fluoruri alcalini formando l'anione complesso IF4− (tetrafluoroiodato(III)), che è planare quadrato, simmetria D4h,[13] con i fluori che occupano i vertici del quadrato di base di un ottaedro e i due doppietti liberi che occupano due vertici liberi opposti dell'ottaedro; ad esempio, con il fluoruro di cesio si ha:[14]
CsF + IF3 → Cs+[IF4]−
Può anche accettare altri ioni fluoruro formando l'anione esafluoroiodato(III):[14]
3 CsF + IF3 → [Cs+]3[IF6]3−
Come altri fluoruri di alogeno, IF3 è sensibile all'idrolisi ed è un forte agente fluorurante e ossidante in genere, ma in questo è meno efficace degli altri trifluoruri di alogeno, BrF3 o ClF3.[15]
Note
modifica- ^ a b Greenwood e Earnshaw 1997
- ^ a b c Holleman e Wiberg 2007
- ^ a b c N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, pp. 828-831, ISBN 0-7506-3365-4.
- ^ Rolf Werner Soukup, Chemiegeschichtliche Daten anorganischer Substanzen (PDF), su rudolf-werner-soukup.at, p. 65.
- ^ a b Schmeisser e Scharf 1960
- ^ Schmeisser et al. 1968
- ^ Erwin Riedel e Christoph Janiak, Anorganische Chemie, collana De Gruyter Studium, 10. Auflage, De Gruyter, 2022, p. 441, ISBN 978-3-11-069604-2.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. 155, ISBN 88-299-1470-3.
- ^ (EN) IF3 Lewis Structure, Hybridization, Molecular Geometry, and Polarity - Techiescientist, su techiescientist.com, 21 marzo 2021. URL consultato il 20 maggio 2024.
- ^ Hoyer e Seppelt 2000
- ^ K. P. Huber e G. Herzberg, Molecular Spectra and Molecular Structure IV: Constants of Diatomic Molecules, Van Nostrand Reinhold, 1979.
- ^ Experimental data for IF3 (iodone trifluoride), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, pp. 5010-511, ISBN 978-3-11-026932-1, OCLC 970042787. URL consultato il 4 febbraio 2025.
- ^ a b Karl O. Christe e Dieter Naumann, Tetrafluoroiodate(III) anion, IF4-, in Inorganic Chemistry, vol. 12, n. 1, 1º gennaio 1973, pp. 59–62, DOI:10.1021/ic50119a016. URL consultato il 4 febbraio 2025.
- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 509, ISBN 978-3-11-026932-1, OCLC 970042787. URL consultato il 20 maggio 2024.
Bibliografia
modifica- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) S. Hoyer e K. Seppelt, <1448::AID-ANIE1448>3.0.CO;2-G The structure of IF3, in Angew. Chem. Int. Ed., vol. 39, n. 8, 2000, pp. 1448-1449, DOI:10.1002/(SICI)1521-3773(20000417)39:8<1448::AID-ANIE1448>3.0.CO;2-G.
- (DE) M. Schmeisser e E. Scharf, Über Jodtrifluorid JF3 und Jodmonofluorid JF, in Angew. Chem., vol. 72, n. 9, 1960, pp. 324-324, DOI:10.1002/ange.19600720912.
- (DE) M. Schmeisser, W. Ludovici, D. Naumann, P. Sartori e E. Scharf, Zur Kenntnis des Jodtrifluorids, in Chem. Ber., vol. 101, n. 12, 1968, pp. 4214-4220, DOI:10.1002/cber.19681011221.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su trifluoruro di iodio