Herpesvirus umano 4
Il virus di Epstein-Barr (EBV) o, in inglese, Human herpesvirus 4 (HHV-4, Human gammaherpesvirus 4) è una specie di virus a DNA appartenente al genere Lymphocryptovirus, della famiglia degli herpesvirus, responsabile della mononucleosi infettiva e coinvolto nella genesi di alcuni tumori epiteliali e di alcuni tipi di linfoma.
| Virus di Epstein-Barr | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Duplodnaviria |
| Regno | Heunggongvirae |
| Phylum | Peploviricota |
| Classe | Herviviricetes |
| Ordine | Herpesvirales |
| Famiglia | Herpesviridae |
| Sottofamiglia | Gammaherpesvirinae |
| Genere | Lymphocryptovirus |
| Specie | Human gammaherpesvirus 4 |
| Nomi comuni | |
|
Virus di Epstein-Barr | |
Caratteristiche
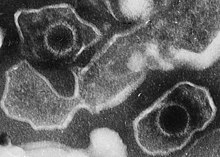
modificaCome tutti gli herpesvirus, l'EBV ha una forma sferoide ed è formato da una doppia membrana lipoproteica, il pericapside, che riveste un capside icosaedrico (100-110 nm di diametro). Il capside racchiude il genoma, che è costituito da una molecola lineare di DNA a doppio filamento di 172 kilobasi. Il genoma è caratterizzato dalla presenza di diverse sequenze ripetute, alcune localizzate altre intersperse. Codifica circa cento geni di cui durante la latenza ne vengono trascritti al massimo 11 di cui 9 tradotti.
Questo virus è diffuso ovunque sulla superficie terrestre e l'averlo potuto isolare anche in etnie umane isolate costituisce una situazione abbastanza eccezionale in virologia umana. L'analisi molecolare ha evidenziato che esiste un solo tipo di EBV e che le piccole variazioni osservate nel DNA del suo genoma non sono significative e non modificano le sue proprietà.
L'EBV ha come ospite esclusivo l'uomo ed, occasionalmente, le scimmie antropomorfe; l'indisponibilità di modelli animali ha posto difficoltà per la valutazione sperimentale di un eventuale vaccino. Le cellule colpite di preferenza dall'EBV sono i linfociti B.
Storia
modificaL'EBV fu isolato a Londra per la prima volta nel 1964 da Anthony Epstein, Yvonne Barr e Bert Achong.[1] Questi virologi inglesi avevano ricevuto dall'Uganda e messo in coltura delle cellule prelevate da pazienti africani affetti da un particolare linfoma che colpiva le zone malariche sub-sahariane. I prelievi erano stati eseguiti da Denis Parsons Burkitt, che dal 1958 aveva individuato e descritto questa malattia e ne aveva analizzato le caratteristiche epidemiologiche. Isolando una linea cellulare e analizzando le cellule al microscopio elettronico, Epstein e Barr scoprirono la presenza di questo nuovo herpesvirus che venne chiamato virus di Epstein-Barr in loro onore.
Considerato all'inizio responsabile del linfoma di Burkitt, il virus fu in seguito ritrovato nella quasi totalità degli individui adulti e il suo ruolo nella patogenesi del tumore africano fu messa in discussione.
Dal 1968 si sa che nella maggioranza degli individui infettati l'EBV non provoca manifestazioni patologiche o provoca una forma indistinguibile dalle comuni infezioni respiratorie da virus; in alcuni casi è responsabile della malattia benigna nota come mononucleosi infettiva e comunque è associato, oltre che al linfoma di Burkitt, ad altri tipi di tumore maligno, tra cui il linfoma di Hodgkin e il carcinoma del rinofaringe, comune in Asia sud-orientale e nel Maghreb.
Trasmissione
modificaLa trasmissione del virus avviene principalmente con la saliva. Questo tipo di trasmissione è ben evidenziato dal nome che si dà comunemente alla mononucleosi: "malattia del bacio". Anche le vie di trasmissione ematica e sessuale sono possibili, ma in via del tutto eccezionale. Nei paesi economicamente sviluppati il primo contatto con il virus avviene nell'adolescenza e dopo i 25 anni di età quasi tutti gli individui, anche coloro che non hanno sviluppato la mononucleosi, presentano positività agli anticorpi anti-EBV. L'età della prima infezione si riduce in modo significativo a seconda del livello socio-economico e delle condizioni di promiscuità e di igiene. In Africa la trasmissione estremamente precoce del virus (sotto i 3 anni di età) è stata messa in relazione a particolari abitudini alimentari: la madre premastica il cibo che viene dato da mangiare al bambino piccolo.
Cellule bersaglio
modificaI linfociti B umani, cellule bersaglio dell'EBV, presentano sulla loro membrana un recettore, Cr2 (CD21), a cui si legano le glicoproteine gp350 e gp220 del virus. Questo recettore è anche il punto su cui si lega il frammento C3d del complemento. Quindi l'EBV si serve di un recettore fisiologico, imitando un legame naturale e riuscendo ad aggirare le difese dell'ospite. Una situazione analoga è quella che avviene tra il virus HIV e la molecola CD4 dei linfociti T. L'infezione di altri tipi di cellule è molto meno efficiente e avviene attraverso vie ancora poco conosciute.
Meccanismo dell'infezione
modificaDopo essersi fissato sul suo recettore, l'EBV penetra nel linfocita B e il suo DNA persiste nella cellula in due forme: una forma episomiale, in cui il DNA virale rimane sotto forma circolare, staccato dal materiale genomico umano, e una forma integrata in cui il DNA si incorpora nel genoma dell'ospite, senza comunque una sede specifica di integrazione.
Dopo l'infezione dei linfociti B, possono verificarsi due situazioni: la prima, caratteristica della maggior parte delle infezioni virali, comporta l'inizio di un ciclo replicativo virale e la morte della cellula infettata per lisi, a cui segue il rilascio di nuove particelle virali complete che andranno a infettare altre cellule. La seconda, tipica dell'EBV e di pochi altri virus, comporta uno stato di latenza in cui il virus non si moltiplica all'interno della cellula. Questa latenza può durare per un tempo molto lungo e spiega il motivo per cui un individuo venuto a contatto con l'EBV possa ospitare per tutta la vita un certo numero di cellule infettate.
In ogni caso, dopo aver infettato i linfociti B, il genoma virale governa la sintesi di alcune proteine, dette antigeni EBNA (Epstein Barr Nuclear Antigens). All'inizio si credeva che l'EBNA fosse una sola proteina, oggi si conoscono sei proteine diverse, numerate da EBNA-1 a EBNA-6. Queste proteine interferiscono con il DNA cellulare modificando l'espressione di diversi geni e attivando in maniera permanente i linfociti B che vanno così incontro a una proliferazione indefinita (immortalizzazione cellulare).
Il fenomeno dell'immortalizzazione cellulare è stato studiato riproducendo in vitro colture di linfociti umani infettati dal virus. Le cellule proliferano indefinitamente sotto il governo delle proteine virali EBNA, di tre proteine di membrana (LMP1-2A-2B) e di due tipi di RNA non poliadenilati (EBER1 ed EBER2). La linea cellulare così ottenuta è chiamata linea cellulare linfoblastoide (LCL).
In base all'espressione delle proteine virali e all'espressione dei marcatori di superficie cellulari, sono stati identificati tre programmi di latenza virale:
- La latenza I è caratterizzata dall'espressione di EBNA-1, dal promotore Q (Qp), degli EBER 1,2 e di LMP2A. In vivo EBV persiste per tutta la vita nelle cellule B della memoria di un portatore sano attuando programma di latenza I. In condizioni patologiche l'espressione dei tre geni suddetti caratterizza le biopsie di linfoma di Burkitt e le linee cellulari corrispondenti messe in coltura per tempi non prolungati.
- La latenza II è caratterizzata dall'espressione di EBNA-1, dal promotore Q (Qp) e inoltre di LMP1, LMP2A, EBERs. Può esserci anche l'espressione di LMP2B. La latenza II è stata osservata nella malattia di Hodgkin, nel carcinoma del rinofaringe, nel linfoma nasale NK/T, e nei linfomi delle effusioni primarie.
- La latenza III è caratterizzata dalla trascrizione di tutte e nove le proteine della latenza. EBNA 1-2-3-4-5-6 sono trascritti dal promotore Wp/Cp. L'utilizzo di questo promotore è la condizione necessaria per definire la latenza III. Tali cellule sono le linee linfoblastoidi e alcune linee di linfoma di Burkitt in coltura prolungata. La latenza III viene anche riscontrata nei linfomi associati a EBV nei soggetti immunocompromessi.
Oncogenesi
modificaÈ ormai noto il contributo delle infezioni virali alla patogenesi di molti tumori. Diversi tipi di papillomavirus umano (HPV) sono associati al tumore della cervice uterina; il retrovirus umano della leucemia a cellule T di tipo 1 (HTLV-1) è associato alla leucemia/linfoma dei linfociti T. Anche il virus dell'herpes simplex (HSV) contribuisce alla patologia di alcuni tumori orali, mentre il virus dell'epatite B è strettamente associato al carcinoma epatico.
È anche risaputo che alla genesi dei tumori contribuiscono più fattori: i virus da soli non sono sufficienti a indurre i tumori in quanto sono necessari anche altri fattori ambientali e genetici. In generale i virus possono contribuire allo sviluppo dei tumori umani tramite due meccanismi non in contrapposizione. Il primo è la stimolazione della proliferazione cellulare determinata da un'attivazione anomala di oncogeni o dal silenziamento della funzione degli oncosoppressori. Il secondo avviene grazie alla soppressione dei meccanismi di difesa, in cui si può avere l'insorgenza di tumori non correlati al virus che ha determinato la soppressione del sistema immunitario (come l'HIV).
Anche il virus di Epstein-Barr è potenzialmente oncogenico ed è stato correlato a numerose malattie, statisticamente correlato ad anomalie del cromosoma 11[2]; rappresenta un grosso problema anche nei malati di AIDS dove è associato a diffusi linfomi policlonali, polmonite interstiziale linfocitica, leucoplachia della cavità orale. Linfomi di Burkitt EBV positivi e altre malattie linfoproliferative correlate al virus (indicate complessivamente con l'acronimo PTLD) si stanno osservando con sempre maggior frequenza nei pazienti trapiantati che ricevono terapia immunosoppressiva. In un individuo sano, lo stato latente dell'infezione di EBV è sorvegliato dall'immunità umorale, dai linfociti T citotossici e del sistema dell'interferone.
Malattie associate
modificaPiù del 90% della popolazione umana è portatrice sana di EBV. L'infezione primaria è generalmente asintomatica nei bambini, patologica nel 50% dei casi negli adolescenti e negli adulti. Utilizzando la tecnica della PCR semiquantitativa è stato stimato che il numero dei linfociti B infettati dal virus è una cellula per milione nel sangue periferico e rimane costante per tutta la vita di un individuo sano.
EBV è anche associato a vari tumori. L'associazione del virus di Epstein-Barr con differenti tumori supera di gran lunga tutti gli altri virus umani. Nello stesso tempo però il virus non causa nessuna malattia nella maggioranza dei portatori. Questo apparente paradosso ci porta a concludere che questa pacifica coesistenza è dovuta all'interazione dell'immuno-sorveglianza dell'ospite con l'espressione delle proteine virali.
Negli anni 2010 è stata scoperta una forte associazione tra alcune varianti genomiche del virus di Epstein-Barr e la sclerosi multipla, rafforzando l'idea che il virus di Epstein-Barr possa avere un ruolo nello sviluppo della malattia.[3]
Principali malattie associate all'EBV
modifica- Mononucleosi infettiva
- Linfoma di Burkitt
- Carcinoma nasofaringeo
- Disordine linfo-proliferativo post trapianto
- Disordine linfoproliferativo associato all'X
- Linfoma effusivo primitivo
- Linfoma di Hodgkin
- Linfoma diffuso a grandi cellule B
- Carcinoma gastrico
- Sclerosi multipla
- Stomatite aftosa
La letteratura scientifica spesso associa la presenza del virus di Epstein-Barr con diverse patologie che si caratterizzano per una depressione delle difese immunitarie, come:
- Nefrite lupica o LES[4][5][6][7][8]
- Trapianti[9][10][11][12]
- Paralisi dei nervi cranici[13]
- Neurite ottica[14][15][16]
- Meningiti asettiche[17][18][19][20][21]
- Encefaliti e meningoncefaliti[17][22][23][24][25][26]
- Edema periorbitale[27]
- Pancreatiti[28][29][30]
- Colecistite acalcolotica[31][32][33][34]
- Miocarditi[35][36][37][38]
- Adeniti mesenteriche[39]
- Miositi[40][41][42][43][44]
- Nefrite glomerulare[45][46][47][48][49][50]
- Sindrome da stanchezza cronica (CFS)
- Sindrome di Guillain-Barré e altre neuropatie immunomediate
Note
modifica- ^ (EN) M.A Epstein, B.G Achong e Y.M Barr, VIRUS PARTICLES IN CULTURED LYMPHOBLASTS FROM BURKITT'S LYMPHOMA, in The Lancet, vol. 283, n. 7335, 1964-03, pp. 702–703, DOI:10.1016/s0140-6736(64)91524-7. URL consultato il 22 luglio 2022.
- ^ (EN) Breaking Bad: How a Virus Infecting 90% of the World’s Population Unleashes Cancer, su scitechdaily.com, SciTech Daily, DOI:10.1038/s41586-023-05923-x.
- ^ Mechelli R, Manzari C, Policano C, Annese A, Picardi E, Umeton R, Fornasiero A, D'Erchia AM, Buscarinu MC, Agliardi C, Annibali V, Serafini B, Rosicarelli B, Romano S, Angelini DF, Ricigliano VA, Buttari F, Battistini L, Centonze D, Guerini FR, D'Alfonso S, Pesole G, Salvetti M, Ristori G., Epstein-Barr virus genetic variants are associated with multiple sclerosis (abstract), in Neurology, vol. 84, 13 1362-1368, DOI:10.1212/WNL.0000000000001420.
- ^ JL. Te, IM. Dozmorov; JM. Guthridge; KL. Nguyen; JW. Cavett; JA. Kelly; GR. Bruner; JB. Harley; JO. Ojwang, Identification of unique microRNA signature associated with lupus nephritis., in PLoS One, vol. 5, n. 5, 2010, pp. e10344, DOI:10.1371/journal.pone.0010344, PMID 20485490.
- ^ B. Roszkowiak, ZI. Niemir, [Potential role of the Epstein-Barr virus in the pathogenesis of systemic lupus erythematosus and kidney diseases], in Postepy Hig Med Dosw (Online), vol. 58, 2004, pp. 390-7, PMID 15536397.
- ^ MH. Lin, JJ. Huang; TY. Chen; FF. Chen; KC. Chang; MF. Liu; WT. Huang; WC. Su; CJ. Tsao, EBER-1 positive diffuse large cell lymphoma presenting as lupus nephritis., in Lupus, vol. 12, n. 6, 2003, pp. 486-9, PMID 12873053.
- ^ W. Huang, J. Sinha; J. Newman; B. Reddy; L. Budhai; R. Furie; A. Vaishnaw; A. Davidson, The effect of anti-CD40 ligand antibody on B cells in human systemic lupus erythematosus., in Arthritis Rheum, vol. 46, n. 6, giugno 2002, pp. 1554-62, DOI:10.1002/art.10273, PMID 12115186.
- ^ P. Stratta, C. Canavese; G. Ciccone; S. Santi; M. Quaglia; V. Ghisetti; G. Marchiaro; A. Barbui; F. Fop; R. Cavallo; G. Piccoli, Correlation between cytomegalovirus infection and Raynaud's phenomenon in lupus nephritis., in Nephron, vol. 82, n. 2, giugno 1999, pp. 145-54, PMID 10364707.
- ^ Y. Ito, S. Takakura; S. Ichiyama; M. Ueda; Y. Ando; K. Matsuda; E. Hidaka; K. Nakatani; J. Nishioka; T. Nobori; N. Kajiyama, Multicenter evaluation of prototype real-time PCR assays for Epstein-Barr virus and cytomegalovirus DNA in whole blood samples from transplant recipients., in Microbiol Immunol, vol. 54, n. 9, settembre 2010, pp. 516-22, DOI:10.1111/j.1348-0421.2010.00243.x, PMID 20840150.
- ^ R. Cavallo, M. Elia; V. Gruosso; A. Curtoni; C. Costa; M. Bergallo, Molecular epidemiology of epstein-barr virus in adult kidney transplant recipients., in Transplant Proc, vol. 42, n. 7, settembre 2010, pp. 2527-30, DOI:10.1016/j.transproceed.2010.05.151, PMID 20832536.
- ^ N. Reddy, K. Rezvani; AJ. Barrett; BN. Savani, Strategies to prevent EBV reactivation and post- transplant lymphoproliferative disorders (PTLD) after allogeneic stem cell transplantation in high risk patients., in Biol Blood Marrow Transplant, agosto 2010, DOI:10.1016/j.bbmt.2010.08.007, PMID 20732435.
- ^ E. Cheng, N. Fustino; L. Klesse; S. Chinnakotla; R. Sanghavi, Post-transplant lymphoproliferative disorder resembling Wilms tumor. Diagnostic dilemma: Renal biopsy or nephrectomy?, in Pediatr Transplant, luglio 2010, DOI:10.1111/j.1399-3046.2010.01371.x, PMID 20670357.
- ^ S. Boudjemaa, F. Boman; V. Guigonis; L. Boccon-Gibod, Brain involvement in multicentric Epstein-Barr virus-associated smooth muscle tumours in a child after kidney transplantation., in Virchows Arch, vol. 444, n. 4, aprile 2004, pp. 387-91, PMID 15143769.
- ^ P. Phowthongkum, K. Phantumchinda; K. Jutivorakool; C. Suankratay, Basal ganglia and brainstem encephalitis, optic neuritis, and radiculomyelitis in Epstein-Barr virus infection., in J Infect, vol. 54, n. 3, marzo 2007, pp. e141-4, DOI:10.1016/j.jinf.2006.09.007, PMID 17055062.
- ^ EP. Corssmit, MA. Leverstein-van Hall; P. Portegies; P. Bakker, Severe neurological complications in association with Epstein-Barr virus infection., in J Neurovirol, vol. 3, n. 6, dicembre 1997, pp. 460-4, PMID 9475119.
- ^ MD. Anderson, CA. Kennedy; AW. Lewis; GR. Christensen, Retrobulbar neuritis complicating acute Epstein-Barr virus infection., in Clin Infect Dis, vol. 18, n. 5, maggio 1994, pp. 799-801, PMID 8075274.
- ^ a b M. Ueda, T. Tateishi; H. Shigeto; R. Yamasaki; Y. Ohyagi; J. Kira, [A case of acute disseminated encephalomyelitis associated with Epstein-Barr virus reactivation during infliximab therapy], in Rinsho Shinkeigaku, vol. 50, n. 7, luglio 2010, pp. 461-6, PMID 20681262.
- ^ A. Doja, A. Bitnun; EL. Jones; S. Richardson; R. Tellier; M. Petric; H. Heurter; D. Macgregor, Pediatric Epstein-Barr Virus-Associated Encephalitis: 10-Year Review., in J Child Neurol, vol. 21, n. 5, maggio 2006, pp. 385-391, PMID 16948923.
- ^ A. Pohl-Koppe, M. Blay; G. Jäger; M. Weiss, Human herpes virus type 7 DNA in the cerebrospinal fluid of children with central nervous system diseases., in Eur J Pediatr, vol. 160, n. 6, giugno 2001, pp. 351-8, PMID 11421414.
- ^ S. Luchi, L. Del Bono; A. Vincenti; F. Messina; A. Scasso, [Neurological disorder associated to EBV: three case reports], in Infez Med, vol. 5, n. 3, luglio 1997, pp. 182-5, PMID 15034320.
- ^ S. Imai, N. Usui; M. Sugiura; T. Osato; T. Sato; H. Tsutsumi; N. Tachi; S. Nakata; T. Yamanaka; S. Chiba, Epstein-Barr virus genomic sequences and specific antibodies in cerebrospinal fluid in children with neurologic complications of acute and reactivated EBV infections., in J Med Virol, vol. 40, n. 4, agosto 1993, pp. 278-84, PMID 8228918.
- ^ K. Yakushijin, I. Mizuno; A. Sada; S. Imoto; T. Koizumi; S. Imashuku; T. Murayama, Cyclosporin neurotoxicity with Epstein-Barr virus-associated hemophagocytic syndrome., in Haematologica, vol. 90, n. 3, marzo 2005, pp. ECR11, PMID 15753052.
- ^ A. Volpi, Epstein-Barr virus and human herpesvirus type 8 infections of the central nervous system., in Herpes, 11 Suppl 2, giugno 2004, pp. 120A-127A, PMID 15319099.
- ^ H. Fujimoto, K. Asaoka; T. Imaizumi; M. Ayabe; H. Shoji; M. Kaji, Epstein-Barr virus infections of the central nervous system., in Intern Med, vol. 42, n. 1, gennaio 2003, pp. 33-40, PMID 12583615.
- ^ N. Tachikawa, M. Goto; Y. Hoshino; H. Gatanaga; A. Yasuoka; T. Wakabayashi; H. Katano; S. Kimura; S. Oka; A. Iwamoto, Detection of Toxoplasma gondii, Epstein-Barr virus, and JC virus DNAs in the cerebrospinal fluid in acquired immunodeficiency syndrome patients with focal central nervous system complications., in Intern Med, vol. 38, n. 7, luglio 1999, pp. 556-62, PMID 10435361.
- ^ YW. Tang, MJ. Espy; DH. Persing; TF. Smith, Molecular evidence and clinical significance of herpesvirus coinfection in the central nervous system., in J Clin Microbiol, vol. 35, n. 11, novembre 1997, pp. 2869-72, PMID 9350749.
- ^ N. Scheinfeld, Imatinib mesylate and dermatology part 2: a review of the cutaneous side effects of imatinib mesylate., in J Drugs Dermatol, vol. 5, n. 3, marzo 2006, pp. 228-31, PMID 16573254.
- ^ ME. Teniente Urbina, JC. Castañeda; P. José Ortiz Saavedra, [Pancreatitis, myocarditis and interstitial nephritis associated with acute infection with Epstein Barr virus], in Rev Gastroenterol Peru, vol. 29, n. 4, pp. 367-73, PMID 20066023.
- ^ RE. Schwarz, LM. Weiss, Lymphoepithelial cyst of the pancreas. No evidence for Epstein-Barr virus-related pathogenesis., in Int J Pancreatol, vol. 25, n. 3, giugno 1999, pp. 223-7, PMID 10453424.
- ^ L. Stigendal, S. Hermodsson; R. Olsson, Prevalence of markers of hepatotrophic viruses in alcoholics with symptomatic liver cirrhosis or pancreatitis., in Scand J Gastroenterol, vol. 19, n. 5, luglio 1984, pp. 588-90, PMID 6089303.
- ^ A. Attilakos, A. Prassouli; G. Hadjigeorgiou; E. Lagona; S. Kitsiou-Tzeli; A. Galla; A. Stasinopoulou; T. Karpathios, Acute acalculous cholecystitis in children with Epstein-Barr virus infection: a role for Gilbert's syndrome?, in Int J Infect Dis, vol. 13, n. 4, luglio 2009, pp. e161-4, DOI:10.1016/j.ijid.2008.08.009, PMID 19008138.
- ^ T. Miloh, M. Magid; A. Yurovitsky; J. Strauchen; R. Arnon; N. Kerkar; H. Rosenberg; U. Joashi; D. Bhojwani, T-cell PTLD presenting as acalculous cholecystitis., in Pediatr Transplant, vol. 12, n. 6, settembre 2008, pp. 717-20, PMID 18798362.
- ^ C. Iaria, L. Arena; G. Di Maio; MG. Fracassi; MS. Leonardi; C. Famulari; A. Cascio, Acute acalculous cholecystitis during the course of primary Epstein-Barr virus infection: a new case and a review of the literature., in Int J Infect Dis, vol. 12, n. 4, luglio 2008, pp. 391-5, DOI:10.1016/j.ijid.2007.10.005, PMID 18083615.
- ^ A. Prassouli, J. Panagiotou; M. Vakaki; I. Giannatou; A. Atilakos; A. Garoufi; V. Papaevangelou, Acute acalculous cholecystitis as the initial presentation of primary Epstein-Barr virus infection., in J Pediatr Surg, vol. 42, n. 1, gennaio 2007, pp. E11-3, DOI:10.1016/j.jpedsurg.2006.11.004, PMID 17208530.
- ^ F. Roubille, G. Gahide; T. Moore-Morris; M. Granier; JM. Davy; H. Vernhet; C. Piot, Epstein Barr virus (EBV) and acute myopericarditis in an immunocompetent patient: first demonstrated case and discussion., in Intern Med, vol. 47, n. 7, 2008, pp. 627-9, PMID 18379149.
- ^ C. Chimenti, A. Russo; M. Pieroni; F. Calabrese; R. Verardo; G. Thiene; MA. Russo; A. Maseri; A. Frustaci, Intramyocyte detection of Epstein-Barr virus genome by laser capture microdissection in patients with inflammatory cardiomyopathy., in Circulation, vol. 110, n. 23, dicembre 2004, pp. 3534-9, DOI:10.1161/01.CIR.0000148823.08092.0E, PMID 15557377.
- ^ M. Häusler, B. Sellhaus; S. Scheithauer; B. Gaida; S. Kuropka; K. Siepmann; A. Panek; W. Berg; A. Teubner; K. Ritter; M. Kleines, Myocarditis in newborn wild-type BALB/c mice infected with the murine gamma herpesvirus MHV-68., in Cardiovasc Res, vol. 76, n. 2, novembre 2007, pp. 323-30, DOI:10.1016/j.cardiores.2007.06.025, PMID 17658501.
- ^ U. Kühl, M. Pauschinger; M. Noutsias; B. Seeberg; T. Bock; D. Lassner; W. Poller; R. Kandolf; HP. Schultheiss, High prevalence of viral genomes and multiple viral infections in the myocardium of adults with "idiopathic" left ventricular dysfunction., in Circulation, vol. 111, n. 7, febbraio 2005, pp. 887-93, DOI:10.1161/01.CIR.0000155616.07901.35, PMID 15699250.
- ^ PM. Adcock, HS. Nagaraj; GS. Marshall, Pseudoappendicitis preceding infectious mononucleosis., in Pediatr Emerg Care, vol. 14, n. 5, ottobre 1998, pp. 345-6, PMID 9814402.
- ^ BR. Koppula, S. Pipavath; DH. Lewis, Epstein-Barr virus (EBV) associated lymphoepithelioma-like thymic carcinoma associated with paraneoplastic syndrome of polymyositis: a rare tumor with rare association., in Clin Nucl Med, vol. 34, n. 10, ottobre 2009, pp. 686-8, DOI:10.1097/RLU.0b013e3181b53f5a, PMID 19893401.
- ^ M. Steff, Y. Le Corre; I. Penisson-Besnier; S. Michalak; G. Drossard; B. Lebrun-Vignes; C. Le Clec'h, [Cutaneous EBV-associated lymphoproliferative disorder in a dermatomyositis treated with immunosuppressive agents], in Rev Med Interne, vol. 30, n. 8, agosto 2009, pp. 720-3, DOI:10.1016/j.revmed.2008.10.022, PMID 19027995.
- ^ HS. Min, CL. Hyun; JH. Paik; YK. Jeon; G. Choi; SH. Park; JW. Seo; CW. Kim, An autopsy case of aggressive CD30+ extra-nodal NK/T-cell lymphoma initially manifested with granulomatous myositis., in Leuk Lymphoma, vol. 47, n. 2, febbraio 2006, pp. 347-52, DOI:10.1080/10428190500288545, PMID 16321870.
- ^ F. Shirasaki, K. Taniuchi; T. Matsushita; Y. Hamaguhi; M. Takata; K. Takehara, Epstein-Barr virus-associated T-cell lymphoma: a case of eyelid swelling and intramuscular infiltration mimicking dermatomyositis., in Br J Dermatol, vol. 147, n. 6, dicembre 2002, pp. 1244-8, PMID 12452878.
- ^ K. Yamashita, M. Hosokawa; S. Hirohashi; Y. Arimura; T. Endo; R. Denno; T. Ikeda; K. Imai, Epstein-Barr virus-associated gastric cancer in a patient with dermatomyositis., in Intern Med, vol. 40, n. 2, febbraio 2001, pp. 96-9, PMID 11300169.
- ^ H. Suzuki, R. Fan; Z. Zhang; R. Brown; S. Hall; BA. Julian; WW. Chatham; Y. Suzuki; RJ. Wyatt; Z. Moldoveanu; JY. Lee, Aberrantly glycosylated IgA1 in IgA nephropathy patients is recognized by IgG antibodies with restricted heterogeneity., in J Clin Invest, vol. 119, n. 6, giugno 2009, pp. 1668-77, DOI:10.1172/JCI38468, PMID 19478457.
- ^ JL. Becker, F. Miller; GJ. Nuovo; C. Josepovitz; WH. Schubach; EP. Nord, Epstein-Barr virus infection of renal proximal tubule cells: possible role in chronic interstitial nephritis., in J Clin Invest, vol. 104, n. 12, dicembre 1999, pp. 1673-81, DOI:10.1172/JCI7286, PMID 10606621.
- ^ H. Iwama, S. Horikoshi; I. Shirato; Y. Tomino, Epstein-Barr virus detection in kidney biopsy specimens correlates with glomerular mesangial injury., in Am J Kidney Dis, vol. 32, n. 5, novembre 1998, pp. 785-93, PMID 9820448.
- ^ K. Joh, Y. Kanetsuna; Y. Ishikawa; S. Aizawa; A. Imadachi; O. Tastusawa; T. Ohishi, Epstein-Barr virus genome-positive tubulointerstitial nephritis associated with immune complex-mediated glomerulonephritis in chronic active EB virus infection., in Virchows Arch, vol. 432, n. 6, giugno 1998, pp. 567-73, PMID 9672200.
- ^ L. Layward, AM. Finnemore; AC. Allen; SJ. Harper; J. Feehally, Systemic and mucosal IgA responses to systemic antigen challenge in IgA nephropathy., in Clin Immunol Immunopathol, vol. 69, n. 3, dicembre 1993, pp. 306-13, PMID 8242901.
- ^ M. Kunimoto, Y. Hayashi; K. Kuki; M. Mune; Y. Yamada; S. Tamura; I. Takano; K. Fujiwara; Y. Akagi; T. Samukawa, Analysis of viral infection in patients with IgA nephropathy., in Acta Otolaryngol Suppl, vol. 508, 1993, pp. 11-8, PMID 8285037.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su virus di Epstein-Barr
- Wikispecies contiene informazioni su virus di Epstein-Barr
Collegamenti esterni
modifica- (EN) Epstein-Barr virus, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 36271 |
|---|
