Colestiramina
La colestiramina è una resina a scambio anionico cloridrata, che lega gli acidi biliari nell'intestino formando un complesso insolubile escreto per via fecale.[2] La molecola è affine a colestipolo la cui azione e indicazioni sono sovrapponibili.
| Colestiramina | |
|---|---|
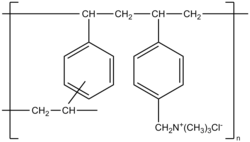 | |
| Caratteristiche generali | |
| Numero CAS | |
| Numero EINECS | 234-270-8 |
| Codice ATC | C10 |
| PubChem | 70695640 |
| DrugBank | DBDB01432 |
| Dati farmacocinetici | |
| Metabolismo | Epatico |
| Emivita | 1h |
| Escrezione | Fecale |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [1] |
Farmacodinamica
modificaDurante i processi digestivi gli acidi biliari vengono secreti nell'intestino. Una quota importante di questo pool di acidi biliari viene assorbita dal tratto gastroenterico e ritorna alla ghiandola epatica grazie all'esistenza della circolazione enteroepatica. Nel siero normale possono essere rintracciate solo piccole quantità di acidi biliari.
La resina di colestiramina assorbe e si lega agli acidi biliari nell'intestino, formando un complesso insolubile che viene eliminato dall'organismo attraverso le feci. Ciò si traduce in una rimozione di una quota del pool degli acidi biliari dalla circolazione enteroepatica che ne impedisce il riassorbimento.
L'aumentata perdita fecale di acidi biliari causata dal complesso con colestiramina comporta un aumento di ossidazione del colesterolo in acidi biliari (neosintesi degli stessi da parte degli epatociti), un aumento del pool di recettori per le LDL a livello degli stessi epatociti, una diminuzione dei livelli plasmatici di β-lipoproteine e lipoproteine a bassa densità (LDL) e una diminuzione dei livelli di colesterolo nel siero (precursore degli acidi biliari).[3]
Nei pazienti affetti da una parziale ostruzione delle vie biliari, la riduzione delle concentrazioni di acidi biliari sierici indotta da colestiramina diminuisce l'eccesso di deposito di queste sostanze nel tessuto dermico comportando una diminuzione della sensazione di prurito.
Farmacocinetica
modificaA seguito di somministrazione per via orale il composto non viene minimamente assorbito dal tratto gastroenterico.
Usi clinici
modificaÈ utilizzata come farmaco ipocolesterolemizzante in soggetti con ipercolesterolemia primaria.[4][5] Può essere utilizzato in caso di prurito dovuto a litiasi biliare (calcoli delle vie biliari), unicamente in soggetti con ostruzione parziale. Non ha infatti alcuna attività nei casi di ostruzione completa delle vie biliari non potendo esplicare la propria azione se la bile non viene secreta nell'intestino. [6] Viene prescritta anche in casi di prurito dovuto a cirrosi biliare primitiva.
Usi off label
modificaVista la sua azione sugli acidi biliari, la molecola è utilizzata anche per il trattamento della diarrea cronica in pazienti affetti da malattia di Crohn e sottoposti a resezione ileale,[7][8] da sindrome dell'intestino irritabile,[9][10] e della diarrea cronica causata dalla sindrome post-colecistectomia (PCS),[11] nonché della diarrea post vagotomia (anche quest'ultima mediata da sali biliari).[12][13][14][15][16][17]
Ne è stato sperimentato l'utilizzo anche nella tossicità da digitale[18][19][20][21] e nelle coliti pseudomembranose, in associazione a vancomicina e altri antibiotici, con il fine di legare le enterotossine A e B prodotte da Clostridioides difficile.[22][23][24][25][26][27]
Un'altra resina a scambio ionico, facente parte della categoria farmaceutica dei sequestranti degli acidi biliari, utilizzata per il trattamento delle dislipidemie è il colestipolo che ha un'azione analoga a quella della colestiramina e viene usata anch'essa nei casi in cui il trattamento con statine sia inefficace.
Effetti collaterali e indesiderati
modificaIn corso di trattamento sono stati segnalati diversi disturbi gastrointestinali: dispepsia, perdita di appetito, nausea, vomito, dolore addominale e sensazione di distensione, flatulenza, diarrea, steatorrea, pancreatite acuta, ostruzione intestinale.[28][29][30]
L'effetto avverso gastrointestinale che ricorre con maggiore frequenza è comunque la stipsi, per altro controllabile con le normali misure terapeutiche.
Altri effetti indesiderati segnalati consistono in facilità al sanguinamento correlata a ipoprotrombinemia (da deficit di vitamina K), alterazioni della visione notturna secondarie a deficit di vitamina A, deficit di vitamina D, osteomalacia e osteoporosi.[31][32]
Possono anche comparire eruzioni cutanee, della lingua e della regione perineale.
Controindicazioni
modificaIl farmaco è controindicato nei soggetti con ipersensibilità individuale nota al principio attivo oppure a uno qualsiasi degli eccipienti della formulazione farmacologica. È inoltre controindicato nei pazienti con ostruzione completa delle vie biliari (la bile non può essere secreta nell'intestino e pertanto il farmaco è totalmente inefficace).
Dosi terapeutiche
modificaNei soggetti adulti la dose consigliata è pari a 4g (equivalente a una bustina), da 1 a 6 volte al giorno, prima dei pasti.
Per il trattamento del prurito che riconosce come causa una parziale ostruzione delle vie biliari, il dosaggio consigliato è di 4-8 g (1–2 bustine) al giorno.
Interazioni
modifica- Idroclorotiazide: la contemporanea somministrazione di idroclorotiazide e di resine sequestranti gli acidi biliari può comportare una riduzione dell'assorbimento del tiazidico. Se la terapia d'associazione non può essere evitata idroclorotiazide deve essere assunta almeno 2 ore dopo tali resine.[33][34]
Note
modifica- ^ Sigma Aldrich; rev. del 28.02.2011
- ^ WG. Thompson, Cholestyramine., in Can Med Assoc J, vol. 104, n. 4, Feb 1971, pp. 305-9, PMID 5544698.
- ^ DJ. Nazir, L. Horlick; BJ. Kudchodkar; HS. Sodhi, Mechanisms of action of cholestyramine in the treatment of hypercholesterolemia., in Circulation, vol. 46, n. 1, Lug 1972, pp. 95-102, PMID 5039828.
- ^ B. Jacotot, V. Beaumont; JC. Buxtorf; JC. Le Parco; JL. Beaumont, [Treatment of hypercholesteremia with cholestyramine]., in Therapeutique, vol. 48, n. 3, Mar 1972, pp. 225-30, PMID 4560997.
- ^ Cholestyramine and hypercholesterolaemia., in Br Med J, vol. 1, n. 5592, Mar 1968, p. 629, PMID 5637576.
- ^ JH. Caldwell, NJ. Greenberger, Interruption of the enterohepatic circulation of digitoxin by cholestyramine. I. Protection against lethal digitoxin intoxication., in J Clin Invest, vol. 50, n. 12, Dic 1971, pp. 2626-37, DOI:10.1172/JCI106763, PMID 5129314.
- ^ AF. Hofmann, JR. Poley, Role of bile acid malabsorption in pathogenesis of diarrhea and steatorrhea in patients with ileal resection. I. Response to cholestyramine or replacement of dietary long chain triglyceride by medium chain triglyceride., in Gastroenterology, vol. 62, n. 5, Mag 1972, pp. 918-34, PMID 5029077.
- ^ H. Lichtenstein, R. Poupon; F. Bodin; M. Conte, [Respective role of microbial growth and resection in diarrhea pathogenesis after ileotomy for Regional enteritis. Effects of antibiotic-cholestyramine association]., in Sem Hop, vol. 49, n. 8, Feb 1973, pp. 562-4, PMID 4349576.
- ^ F. Castiglione, B. Daniele; G. Mazzacca, Therapeutic strategy for the irritable bowel syndrome., in Ital J Gastroenterol, vol. 23, 8 Suppl 1, Nov 1991, pp. 53-5, PMID 1661628.
- ^ L. Sinha, R. Liston; HJ. Testa; KJ. Moriarty, Idiopathic bile acid malabsorption: qualitative and quantitative clinical features and response to cholestyramine., in Aliment Pharmacol Ther, vol. 12, n. 9, Set 1998, pp. 839-44, PMID 9768525.
- ^ http://www.scirp.org/Journal/PaperDownload.aspx?paperID=19988
- ^ JD. George, J. Magowan, Diarrhea after total and selective vagotomy., in Am J Dig Dis, vol. 16, n. 7, Lug 1971, pp. 635-40, PMID 5563217.
- ^ JR. Condon, MI. Suleman; YS. Fan; MD. McKeown, Letter: Cholestyramine and diabetic post-vagotomy diarrhoea., in Br Med J, vol. 4, n. 5889, Nov 1973, p. 423, PMID 4749795.
- ^ JG. Allan, VP. Gerskowitch; RI. Russell, Letter: Bile acids and post-vagotomy diarrhoea., in Br Med J, vol. 4, n. 5894, Dic 1973, p. 741, PMID 4776900.
- ^ LS. Hill, Postvagotomy diarrhea treated with cholestyramine., in Proc R Soc Med, vol. 69, n. 7, Lug 1976, p. 521, PMID 959232.
- ^ JG. Allan, RI. Russell, Cholestyramine in treatment of postvagotomy diarrhoea--double-blind controlled trial., in Br Med J, vol. 1, n. 6062, Mar 1977, pp. 674-6, PMID 321088.
- ^ VM. Duncombe, TD. Bolin; AE. Davis, Double-blind trial of cholestyramine in post-vagotomy diarrhoea., in Gut, vol. 18, n. 7, Lug 1977, pp. 531-5, PMID 326641.
- ^ N. Krivoy, A. Eisenman, [Cholestyramine for digoxin intoxication]., in Harefuah, vol. 128, n. 3, Feb 1995, pp. 145-7, 199, PMID 7759003.
- ^ RP. Henderson, CP. Solomon, Use of cholestyramine in the treatment of digoxin intoxication., in Arch Intern Med, vol. 148, n. 3, Mar 1988, pp. 745-6, PMID 3341874.
- ^ H. Haacke, K. Johnsen; KD. Kolenda, [Therapy of digitalis poisoning: another experimental indication on the efficiency of adsorbents]., in Med Welt, vol. 24, n. 36, Set 1973, pp. 1274-5, PMID 4766287.
- ^ JH. Caldwell, CA. Bush; NJ. Greenberger, Interruption of the enterohepatic circulation of digitoxin by cholestyramine. II. Effect on metabolic disposition of tritium-labeled digitoxin and cardiac systolic intervals in man., in J Clin Invest, vol. 50, n. 12, Dic 1971, pp. 2638-44, DOI:10.1172/JCI106764, PMID 5129315.
- ^ EJ. Burbige, FD. Milligan, Pseudomembranous colitis. Association with antibiotics and therapy with cholestyramine., in JAMA, vol. 231, n. 11, Mar 1975, pp. 1157-8, PMID 1172816.
- ^ RH. George, DJ. Youngs; EM. Johnson; DW. Burdon, Anion-exchange resins in pseudomembranous colitis., in Lancet, vol. 2, n. 8090, Set 1978, p. 624, PMID 80541.
- ^ EW. Kreutzer, FD. Milligan, Treatment of antibiotic-associated pseudomembranous colitis with cholestyramine resin., in Johns Hopkins Med J, vol. 143, n. 3, Set 1978, pp. 67-72, PMID 691920.
- ^ RE. Ariano, GG. Zhanel; GK. Harding, The role of anion-exchange resins in the treatment of antibiotic-associated pseudomembranous colitis., in CMAJ, vol. 142, n. 10, Mag 1990, pp. 1049-51, PMID 2186849.
- ^ D. Kunimoto, AB. Thomson, Recurrent Clostridium difficile-associated colitis responding to cholestyramine., in Digestion, vol. 33, n. 4, 1986, pp. 225-8, PMID 3956890.
- ^ NS. Taylor, JG. Bartlett, Binding of Clostridium difficile cytotoxin and vancomycin by anion-exchange resins., in J Infect Dis, vol. 141, n. 1, Gen 1980, pp. 92-7, PMID 7365273.
- ^ MI. Cohen, PR. Winslow; SJ. Boley, Intestinal obstruction associated with cholestyramine therapy., in N Engl J Med, vol. 280, n. 23, Giu 1969, pp. 1285-6, DOI:10.1056/NEJM196906052802307, PMID 5770053.
- ^ JD. Lloyd-Still, Cholestyramine therapy and intestinal obstruction in infants., in Pediatrics, vol. 59, n. 4, Apr 1977, pp. 626-7, PMID 850604.
- ^ DF. Merten, H. Grossman, Intestinal obstruction associated with cholestyramine therapy., in AJR Am J Roentgenol, vol. 134, n. 4, Apr 1980, pp. 827-8, DOI:10.2214/ajr.134.4.827, PMID 6767374.
- ^ WG. Thompson, GR. Thompson, Effect of cholestyramine on the absorption of vitamin D3 and calcium., in Gut, vol. 10, n. 9, Set 1969, pp. 717-22, PMID 4318526.
- ^ KW. Heaton, JV. Lever; D. Barnard, Osteomalacia associated with cholestyramine therapy for postileectomy diarrhea., in Gastroenterology, vol. 62, n. 4, Apr 1972, pp. 642-6, PMID 5020877.
- ^ DB. Hunninghake, S. King; K. LaCroix, The effect of cholestyramine and colestipol on the absorption of hydrochlorothiazide., in Int J Clin Pharmacol Ther Toxicol, vol. 20, n. 4, Apr 1982, pp. 151-4, PMID 7076343.
- ^ DB. Hunninghake, DM. Hibbard, Influence of time intervals for cholestyramine dosing on the absorption of hydrochlorothiazide., in Clin Pharmacol Ther, vol. 39, n. 3, Mar 1986, pp. 329-34, PMID 3948472.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su colestiramina