Helicobacter pylori
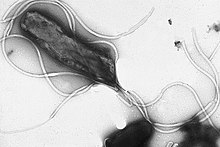
Helicobacter pylori è un batterio gram negativo flagellato acido-tollerante, il cui habitat ideale è il muco gastrico situato nello stomaco umano.[2]
| Helicobacter pylori | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Proteobacteria Epsilon |
| Ordine | Campylobacterales |
| Famiglia | Helicobacteraceae |
| Genere | Helicobacter |
| Specie | H. pylori |
| Nomenclatura binomiale | |
| Helicobacter pylori ((Marshall et al. 1985) Goodwin et al. 1989)[1] | |
La resistenza a pH compreso tra 1 e 2 gli è conferita dalla produzione dell'enzima ureasi che crea intorno al batterio un microambiente compatibile con la propria esistenza.[3]
La presenza di questo enzima ha reso possibile la messa a punto del test del respiro, o UBT, secondo la dizione inglese.[4] Al paziente viene somministrata urea marcata con l'isotopo 13C. Se il batterio è presente avviene la reazione, catalizzata dall'enzima ureasi, che porta alla scissione dell'urea-13C con la formazione di ammonio e 13CO2, ovvero anidride carbonica formata da ossigeno e l'isotopo 13C del carbonio.[5] Se l'analisi del respiro del paziente rivela la presenza di 13CO2 il test è positivo.[4][5]
La maggior parte delle persone ne è portatrice, ma un buon equilibrio fra potere patogeno del microrganismo e difese immunitarie del soggetto normalmente garantisce un'adeguata protezione; per questo motivo i soggetti con una marcata immunodeficienza sono particolarmente esposti a questo agente.
Il batterio vive soltanto in ambiente acido protetto da uno strato di muco; per questo motivo si trova solo nello stomaco. Una volta insediatosi nello stomaco, non fa altro che sottoporre la mucosa ai metaboliti tossici da esso prodotti. Il batterio può produrre sostanze che causano danni alle cellule e con il tempo possono sopraggiungere gastrite e ulcera.[3]
Etimologia
modificaAl batterio fu inizialmente assegnato il nome di Campylobacter pyloridis, poi Campylobacter pylori, in seguito a una correzione nel nome, secondo la grammatica latina. Nel 1989, dopo il sequenziamento del DNA del batterio e altri studi riguardo alla sua morfologia, fu scoperto che esso non apparteneva al genere Campylobacter, bensì al genere Helicobacter. Questo nome deriva dal greco antico «έλιξ» (traslitterato «hělix»), letteralmente spirale.[6] L'epiteto pylōri significa invece «del piloro», o della valvola pilorica, organo che fa parte dell'apparato digerente e che è situato al primo posto tra gli organi che fanno parte del tragitto che va dallo stomaco al duodeno e che a sua volta deriva dalla parola in greco antico «πυλωρός», che significa «portinaio».[6]
Storia
modificaSi deve la sua scoperta ai ricercatori australiani Robin Warren e Barry Marshall nel 1982. Avendo rinvenuto il batterio nelle feci di pazienti che soffrivano tra le altre cose anche di patologie dell'apparato digerente e in particolare dello stomaco, pensarono che il batterio potesse esserne la causa. All'epoca, si riteneva che lo stomaco fosse sterile e nessun batterio potesse vivervi a causa dell'ambiente troppo acido. I loro tentativi di trovare il batterio nello stomaco furono infruttuosi fino a quando dimenticarono nell'armadietto del loro laboratorio delle piastre contenenti succhi gastrici; dopo qualche giorno notarono la formazione di una patina sulla superficie delle piastre: erano colonie batteriche di Helicobacter pylori.[7]
I due ricercatori australiani non furono per la verità i primi a scoprire il batterio. Esso fu analizzato da diversi ricercatori nel XIX secolo; in particolare fu isolato nel 1893 da Giulio Bizzozero, un medico italiano che rilevò il batterio nello stomaco di cani.[8] Tuttavia non fu intuito il ruolo che esso potesse avere e si dovette aspettare quasi un secolo per capire di cosa il batterio "a virgola" fosse capace.[9][10]
L'articolo proposto da Marshall e Warren incontrava scetticismo e rimase in attesa di pubblicazione per mesi; la comunità scientifica riteneva che nessun microrganismo sarebbe sopravvissuto a lungo nell'ambiente acido che caratterizza lo stomaco. Alla fine del 1982 Marshall decise quindi di ingerire egli stesso una dose di H. pylori, che gli causò entro cinque giorni una gastrite e si supponeva quindi la fissazione del batterio nella parte in superficie del muco gastrico, soddisfacendo tre dei quattro postulati di Koch. Il quarto postulato fu soddisfatto da una endoscopia dieci giorni dopo l'ingerimento, con cui furono confermati segni di gastrite e la presenza dell'H. pylori. Marshall fu inoltre capace di autocurarsi utilizzando una doppia terapia di quattordici giorni a base di bismuto e metronidazolo. Barry Marshall e Robin Warren provarono che questi antibiotici sono efficaci in molteplici casi di gastrite.
Nel 1994 i National Institutes of Health, che sono localizzati in diverse città degli Stati Uniti d'America, pubblicarono una dichiarazione che affermava che la maggior parte delle gastriti è causata dall'H. pylori e raccomandava, in caso di infezione da questo batterio, l'utilizzo degli antibiotici precedentemente segnalati da Marshall e Warren.[11] Fu inoltre provato che queste ulcere duodenali sono associate all'infezione da parte dell'H. pylori.[12][13]
Nel 2005 Marshall e Warren ricevettero il Premio Nobel per la medicina proprio grazie alla scoperta dell'H. pylori: oggi si stima infatti che circa il 90% delle ulcere duodenali e l'80% di quelle gastriche siano di origine infettiva.[14][15]
Prima, il riconoscimento del ruolo del batterio nelle ulcere gastriche era solitamente legato a farmaci che però neutralizzavano l'acido gastrico o eliminavano le varie protezioni dello stomaco. Nonostante questi funzionassero bene, le ulcere riapparivano spesso. Una medicazione molto usata contro le gastriti e le ulcere peptiche è stato il subsalicilato di bismuto. Esso faceva spesso effetto, ma indipendentemente dal suo uso, la sua storia e i suoi meccanismi restavano un mistero. È abbastanza chiaro oggi che la reazione è dovuta al sale del bismuto che agisce come un antibiotico. Molte ulcere gastriche sono oggi trattate con antibiotici efficaci contro l'infezione da H. pylori.
Anche se l'H. pylori resta il più importante e diffuso batterio che popola gli stomaci degli esseri umani, altre varianti del genere Helicobacter sono state identificate in altre specie: in altri mammiferi e negli uccelli (alcuni di questi infettano anche gli uomini).[16] Le specie Helicobacter hanno inoltre infettato il fegato di alcuni esseri viventi, soprattutto mammiferi, causando malattie e infezioni a questo organo.[17]
Descrizione
modificaL'H. pylori è un batterio gram negativo dotato di flagelli per il movimento, lungo circa 3 micrometri e con un diametro medio di 0,5 micrometri. Esso possiede dai quattro ai sei flagelli (o ciglia). È un batterio microaerofilo, perciò per la sua sopravvivenza richiede dell'ossigeno, ma in piccole quantità. Produce un enzima idrogenasi che può essere usato per ottenere energia dall'ossidazione dell'idrogeno molecolare (H2) prodotto da altri batteri intestinali.[18] Risulta positivo nei test dell'ossigeno, della catalasi e dell'urea. È capace di formare biofilm[19] e convertirsi dalla forma bacillare a quella coccoide,[20] entrambe le trasformazioni sono utili per la sua sopravvivenza e sono fattori dell'epidemiologia del batterio. La forma coccoide dell'organismo non è quella originale, anche se sono stati trovati alcuni esemplari di questo tipo negli Stati Uniti d'America. In questa forma l'H. pylori è più abile ad aderire alle cellule gastriche.[20]
L'H. pylori possiede cinque maggiori famiglie di membrane proteiniche (OMP). Ognuna di esse ha una specifica funzione.[21] Tutte le specie enteroepatiche e gastriche degli Helicobacter sono dotate di flagelli che consentono a questi batteri il movimento. I tipi di filamento caratteristici sono formati da due piccoli flagelli colipomerizzati, chiamati dagli scienziati FlaA e FlaB. Il movimento tramite i flagelli è essenziale per le specie Helicobacter per colonizzarsi nel muco gastrico.[22]
Habitat e diffusione
modificaL'ambiente in cui l'H. pylori trova le condizioni favorevoli per svolgere le funzioni vitali richiede un'atmosfera poco ossigenata, quindi questo batterio è definito microaerofilo. In condizioni ambientali sfavorevoli, come ad esempio in corso di incremento parziale della pressione di ossigeno, della temperatura o il contatto con farmaci inibitori della pompa protonica o antibiotici, il microrganismo trasforma il proprio aspetto da bacillare a coccoide, evento che ha causato molte controversie.[2][23]
L'H. pylori è particolarmente diffuso nei Paesi in cui gran parte della popolazione è sotto i sedici anni, come in Colombia e in Cina. In questi Stati il batterio colpisce molto facilmente i bambini.[14]
La prevalenza dell'infezione da parte degli H. pylori, nella popolazione di etnia caucasoide degli Stati Uniti d'America e del Sudafrica, è spesso sovrapponibile a quella europea;[24][25] differenti sono i dati inerenti agli altri gruppi etnici, che presentano valori di prevalenza doppi.[26][27]
L'H. pylori si insedia negli stomaci delle persone di età medio-anziana: si stima infatti che circa il 20% delle persone tra i quaranta e i sessanta anni sia infettato da questo batterio. In queste persone, con la presenza del microrganismo, producono ulcere gastriche e duodenali con associazione del 65%-100%[28][29]
Resistenza in habitat particolari
modificaLa capacità di questo batterio di resistere all'acido è perlopiù legata alla sua attività ureasica, attraverso cui scinde l'urea in diossido di carbonio e ammoniaca; quest'ultima neutralizza l'acido prodotto nella cavità gastrica. Al tempo stesso l'attività ureasica viene implicata nella colonizzazione e nella patogenicità del batterio, in quanto sembrerebbe determinare un'azione lesiva, diretta, sui tessuti da parte dell'ammoniaca.[2][30]
Vita in colonia
modificaCon i suoi flagelli, il batterio si muove nello stomaco e scava nei suoi vari strati mucosi. In questo modo, vagando per lo stomaco, l'H. pylori si fissa in un'area e si stabilisce permanentemente lì. Le aree che questi batteri prediligono sono gli strati di muco (con una preferenza per l'area più in superficie), le cellule epiteliali e i vacuoli formati da essi nelle cellule epiteliali. Questo microrganismo produce inoltre una sostanza appiccicosa che si fissa ai lipidi delle membrane e dei carboidrati e aiuta l'adesione alle cellule epiteliali. Qui il batterio produce una grande quantità di ureasi all'esterno di esso. L'ureasi è un enzima, appartenente alla classe delle idrolasi, che catalizza l'idrolisi dell'urea in anidride carbonica e ammoniaca (che neutralizza l'effetto dei succhi gastrici). La sopravvivenza degli H. pylori nell'acido dello stomaco dipende dall'ureasi: infatti senza di essa il batterio muore. L'ammoniaca prodotta è tossica per le cellule epiteliali e, insieme alle altre sostanze prodotte dall'H. pylori, tra cui la proteasi, la catalasi e la fosfolipasi, le danneggia.
Alcuni ceppi appartenenti a questo batterio mettono in pratica un meccanismo con cui vengono iniettate sostanze infiammatorie, tra cui agenti peptidoglicanici dalle loro membrane cellulari dentro le cellule epiteliali gastriche. Questo fattore gioca un ruolo importante nello studio dei vari ceppi biologici di questo batterio.[31]
Aspetti clinici
modificaGastrite
modificaL'H. pylori è l'agente causale più importante della gastrite cronica, detta anche "aspecifica". La relazione patogenetica tra quest'ultima e l'infezione è sorretta da studi che hanno dimostrato che l'eradicazione del batterio può inizialmente far diminuire e successivamente far scomparire i segni dell'infiammazione.[32]
L'endoscopia permette di valutare e di descrivere la presenza e la localizzazione delle lesioni macroscopiche e l'esame istologico dà notizie sullo stato dell'infezione nell'area esaminata, sulla presenza e sulla profondità dell'infiltrazione delle cellule infiammatorie, sul loro tipo e sulla condizione delle cellule epiteliali situate sulla superficie e delle foveole gastriche, l'evidenza di metaplasia intestinale o l'ipertrofia delle cellule endocrine.[33]
La distribuzione della gastrite nelle zone dello stomaco dà solo in parte la vista a occhio nudo della differenza tra l'infiammazione causata dal batterio e la secrezione acida. La localizzazione antrale favorisce una condizione dell'ipersecrezione acida, che aumenterà il rischio di sviluppo dell'ulcera duodenale, mentre quella del fondo gastrico provocherà una distruzione ghiandolare, con uno stato di iposecrezione acida, atrofia e metaplasia intestinale gastrica e, in un'area intermedia, si svilupperà l'ulcera gastrica.[34]
Una condizione di pangastrite (cioè dell'interessamento di tutte le aree dello stomaco all'infezione) è esposta a una maggiore possibilità di evoluzione verso il cancro gastrico.[32]
Ulcera peptica
modificaEpidemiologia
modificaLe persone affette dalla malattia ulcerosa sono negli ultimi anni costantemente diminuite, pur con livelli differenti se si suddividono le forme non-complicate da quelle complicate: per le ultime, infatti, il calo è meno accentuato, e ciò può essere attribuito all'aumentato consumo di farmaci gastrolesivi (come, ad esempio, i FANS), soprattutto dalle persone anziane.
Una letteratura scientifica, ormai consolidata, ha dimostrato l'importante ruolo dell'H. pylori nella malattia dell'ulcera peptica. L'associazione è più evidente con l'ulcera duodenale (abbreviata UD), in cui l'infezione oscilla tra l'85% e il 100%. Inoltre, la cura di questo batterio cambia la storia naturale della malattia fino a pochi decenni fa definita cronica e recidivante, con una diminuzione delle recidive ulcerose come conseguenza.[35] La ricorrenza dopo l'eliminazione del microrganismo è spesso dovuta all'ingerimento di FANS.
La percentuale di ulcere gastriche (o UG), associate all'infezione dall'H. pylori, è sempre inferiore rispetto a quella delle UD, variando tra il 50% e il 90% dei casi. Nonostante ciò, se si eliminano dal calcolo le forme conseguenti all'assunzione di FANS, la percentuale avanza a un numero circa pari a quello delle UD. Anche la storia naturale dell'UG è stata modificata dopo l'eradicazione del microrganismo, con percentuali di ricorrenza del 4% contro il 59% nelle persone in cui esso persiste.[35]
Per ciò che concerne il rischio, per gli individui infettati dall'H. pylori, di sviluppare malattia ulcerosa, è emerso da alcuni studi che in un lungo periodo di osservazione, una percentuale compresa tra il 10% e il 20% è soggetto alla comparsa di una lesione ulcerosa, con un aumento dalle quattro alle dieci volte rispetto ai non infettati.[32]
Patogenesi
modificaLa sequenza di eventi che conducono allo sviluppo della lesione ulcerosa prevede per prima cosa la colonizzazione gastrica da parte dell'H. pylori che oltre a indurre un danno mucoso diretto allo stomaco perturba la fisiologia con alterazioni della secrezione acida. È possibile, inoltre, che l'azione del batterio si estrinsechi contemporaneamente sulla riduzione della secrezione dei bicarbonati, protettivi a livello duodenale.[34]
Quanto all'ulcera gastrica ciò che causa la formazione della lesione è una condizione di squilibrio tra i fattori aggressivi, tra cui spicca l'infezione dall'H. pylori, e quelli protettivi, che sono ridotti. Le lesioni nello strato protettivo di muco lo rendono inadeguato a rallentare e neutralizzare la retrodiffusione di una serie di agenti, che arrivano alle cellule superficiali dello stomaco danneggiandole.[34] All'aggressione batterica è anche complice la liberazione di mediatori dell'infiammazione, che amplificano, seppur in via indiretta, il danneggiamento.
Il risultato di questa complessa interazione nel duodeno tra l'H. pylori e l'ospite determina, in una fase successiva, la trasformazione delle cellule gastriche in cellule proprie delle ghiandole duodenali (ossia la cosiddetta metaplasia intestinale) e la loro colonizzazione per opera del batterio di provenienza dallo stomaco. A questo punto si danneggiano le varie cellule epiteliali colpite, conducendo alla formazione dell'ulcera duodenale.
Sintomi
modificaIl sintomo più diffuso dell'ulcera gastroduodenale è un bruciore o un dolore nella parte superiore dell'addome, l'epigastrio, molto più forte lontano dai pasti e nel mattino presto, quando lo stomaco è vuoto.[14] Tuttavia può insorgere anche in qualsiasi momento, con durata che può variare da pochi minuti fino ad alcune ore. Più raramente possono insorgere sintomi come nausea, vomito e mancanza di appetito. A volte l'ulcera può sanguinare e indurre anemia.
L'infezione dagli H. pylori è associata a un aumento di 2-6 volte del rischio di linfoma MALT e soprattutto di cancro gastrico, il secondo cancro più comune nel mondo, soprattutto in Paesi come la Cina e la Colombia dove più della metà della popolazione è sotto i sedici anni ed è infetta da H. pylori.[14]
Dispepsia funzionale
modificaLa definizione attualmente più accettata di dispepsia (una volta definita "cattiva digestione") è quella di "dolore o fastidio addominale persistente o ricorrente, riferito ai quadranti addominali superiori che dura da almeno tre mesi e non si associa a diagnosi di malattia organica".[36] La prevalenza della dispepsia è presente tra il 30% e il 50% della popolazione. Si sostiene inoltre che questa condizione rappresenti tra il 3% e il 5% delle cause di visita al medico.[34]
La relazione tra l'infezione causata dall'H. pylori e la dispepsia funzionale è tuttora controversa. Sono stati condotti numerosi studi al fine di valutare se l'eradicazione del batterio possa condurre a un beneficio sui sintomi. I risultati ottenuti sono variabili, perlopiù negativi a causa delle modalità con cui sono stati selezionati i pazienti e delle diversità con cui essi sono stati valutati.
Nella pratica clinica è utile identificare in maniera schematica individui con:
- dispepsia simil-ulcerosa, che presentano una sintomatologia pressappoco come quella dell'ulcera peptica pur in assenza di corrispondenti lesioni;
- dispepsia tipo-dismotilità, in cui si presentano sintomi riferibili ad alterazioni della motilità gastrica;
- dispepsia aspecifica, per le forme che non sono inquadrabili nei precedenti casi.
In generale, sembra che solo il sottogruppo di pazienti con dispepsia simil-ulcerosa tragga giovamento dal trattamento eradicante l'infezione dall'Helicobacter pylori.
Cancro gastrico
modificaIl ruolo dell'infezione da parte dell'H. pylori[37] tra gli eventi che conseguono all'evoluzione in cancro gastrico è sottolineato dall'importanza assegnata a esso dall'International Agency for Research on Cancer (abbreviato IARC)[38] che lo ha classificato come "carcinogeno di gruppo I", al pari del fumo per il cancro al polmone. L'associazione del microrganismo con lesioni cancerose e precancerose (cioè che tendono a un'evoluzione verso il cancro) è assai elevata, infatti essa raggiunge in alcuni casi fino al 100%.[39]
La patogenesi di questa neoplasia è multifattoriale ed è legata a molti agenti iniziatori e ad altri continuatori; l'infezione dell'H. pylori ha un ruolo fino a un certo passo del processo di trasformazione cellulare, oltre il quale la malattia progredisce indipendentemente dalla presenza del microrganismo.
Il coinvolgimento dell'H. pylori nell'induzione del cancro gastrico è confermato da dati secondo i quali la concentrazione di acido ascorbico (o vitamina C, ad azione antiossidante e presente in parecchi frutti e vegetali) nel succo gastrico è particolarmente inferiore nei pazienti infettati rispetto ai non infettati e ciò è ancor più evidente se si suddividono i pazienti in base alla presenza della proteina CagA (cioè il marcatore dei ceppi più virulenti).[34] L'ipotesi che ne esce è che la riduzione dell'acido ascorbico, insieme allo stato di ipoacidità dipendente dall'atrofia gastrica, è associata alla produzione aumentata di nitrosamine, composti ad azione carcinogena (in grado cioè di produrre il cancro).
A tutto ciò si collega il fatto che sono state riportate alterazioni genetiche legate alla patogenesi delle neoplasie maligne gastriche, con inattivazione dei geni oncosoppressori (che quando funzionano normalmente agiscono contro lo sviluppo della neoplasia) e attivazione dei geni protoncogeni (che sono alla base dello sviluppo della neoplasia). L'impatto dell'H. pylori sulle modifiche genetiche rimane da chiarire anche se è stata dimostrata una proliferazione cellulare aumentata e un'instabilità del genoma (cioè dell'insieme di geni di un individuo) in caso di infezione.[40]
Differenti modi, ma non contrastanti tra di loro, potrebbero condurre perciò all'origine del cancro gastrico, di cui il tipo istologico più frequente è definito carcinoma.
La maggioranza dei carcinomi sono di tipo "intestinale" e sono preceduti da un lungo stadio di precancerosi scandito in fasi di progressione, che comprendono lo sviluppo della gastrite cronica atrofica, la metaplasia intestinale e la displasia.[41]
La relazione tra l'infezione dall'H. pylori e lo sviluppo della metaplasia e della displasia non è tutt'oggi chiara, soprattutto per quel che riguarda la possibilità di regressione della lesione dopo l'eradicazione del microrganismo: mentre alcuni studi sembrano indicare che ciò avvenga, altri non hanno osservato un beneficio istologico, tra l'altro non è chiaro quali siano i tempi necessari affinché questo evento possa verificarsi.[42][43]
L'identificazione dell'helicobacter pylori avviene tramite test non invasivo del respiro o delle feci, da ripetersi al termine della profilassi. La profilassi dura 10 giorni a base di inibitore di pompa protonica (come lansoprazolo, omeprazolo) allo scopo di bloccare la secrezione, in aggiunto ad amoxicillina nei primi cinque giorni, e altri due antibiotici nei rimanenti cinque[44].
Se la terapia non eradica il batterio (circa il 6% dei casi), si esegue gastroscopia e antibiogramma per preparare una cura "su misura" del paziente, efficace nel 90% dei casi. L'Helicobacter pylori è responsabile della gastrite e dell'ulcera gastrica in 25 milioni di italiani[45]: l'eradicazione dell'helicobacter aumenta notevolmente l'efficacia dei farmaci contro l'ipotiroidismo, per cui è importante che chi soffre di ipotirodismo si sottoponga a uno screening per identificare l'eventuale presenza di un'infezione da Helicobacter pylori.
MALT-linfoma (linfoma extranodale a cellule B della zona marginale associato al MALT)
modificaIl MALT (acronimo della parola inglese Mucosa Associated Lymphoid Tissue), è un tessuto linfoide (cioè dotato di linfa, costituita da una sostanza liquida e una cellulare con prevalenza di linfociti),il cui compito principale è la protezione delle superfici mucose esposte all'ambiente.
Il MALT-linfoma primitivo gastrico è il tipo di linfoma più frequente tra quelle che sorgono al di fuori dei linfonodi (extranodali) e, da oltre un decennio, è associato all'infezione da parte dell'H. pylori. Si tratta di un linfoma non-Hodgkin a cellule B, a basso grado di malignità. La principale caratteristica dei linfomi-MALT extranodali è di avere un decorso clinico non severo, con scarsa tendenza all'evoluzione e una buona risposta alla terapia; spesso si ha risoluzione del quadro neoplastico con l'eradicazione dell'infezione.[32]. Questa neoplasia è di basso grado per definizione; il termine MALT-linfoma di alto grado andrebbe evitato: dunque un linfoma diffuso a grandi cellule B, pur se frutto di un'evoluzione di un MALT-linfoma, non andrebbe indicato come MALT-linfoma di alto grado.
È stata documentato da diversi studi sia un elevato accordo tra l'infezione e la patologia, sia la possibilità di regressione delle forme linfomatose, a basso grado di malignità, dopo l'eradicazione dell'H. pylori.[46]
MACROSCOPIA: si manifesta con ulcere, erosioni, zone discromiche, aspetti ad "acciottolato", rughe ingrossate (l'aspetto macroscopico entro certi limiti può dare un'idea del quadro di sviluppo neoplastico).
ISTOPATOLOGIA: le cellule neoplastiche infiltrano attorno ai follicoli linfatici, esternamente rispetto alla zona mantellare, con un pattern a zona marginale. Le cellule tipiche della zona marginale sono di dimensioni intermedie con citoplasma pallido e nucleo leggermente irregolare, un aspetto simile ai centrociti, e infatti le cellule del MALT-linfoma sono anche dette "centrocita-simili". Le cellule linfomatose infiltrano le ghiandole gastriche originando le lesioni linfoepiteliali.
Il meccanismo patogenetico, in grado di indurre la lesione linfomatosa, è rappresentato da un'abnorme risposta immunitaria, fatta dai linfociti T, allo stimolo costituito dall'infezione. L'eliminazione di quest'ultima, cioè l'eradicazione dell'H. pylori, indurrebbe nelle forme a basso grado di malignità una regressione della lesione e perciò il trattamento del batterio è considerato, insieme a una sorveglianza clinico-ematologica, il primo livello di terapia. Mentre questa strategia è sicuramente vantaggiosa sul breve periodo, non è ancora ben chiaro il destino di questi pazienti, per cui la gestione da intraprendere deve essere improntata su una certa prudenza.[46]
Attualmente non esistono indicazioni all'attuazione della reazione nei linfomi gastrici MALT ad alto grado di malignità.
Patologie extragastroduodenali
modificaNegli ultimi anni si è studiato molto sul potenziale ruolo dell'H. pylori nella patogenesi di patologie a sede extragastroduodenale.
Tra queste si ricordano la malattia ischemica coronarica, la sindrome di Sjögren, la porpora di Schönlein-Henoch, l'orticaria cronica idiopatica, l'acne rosacea, la cefalea, la sindrome di Raynaud, l'anemia sideropenica, la porpora trombocitopenica autoimmune e la sindrome di Prader-Willi. Nonostante ciò, bisogna ancora definire se queste associazioni siano causali od occasionali.[47][48]
La stessa presenza del genoma batterico è stata dimostrata nel fegato e nella bile di alcuni pazienti con malattie in queste sedi (come la cirrosi epatica e la colecistite) ed è stato osservato che altri microrganismi appartenenti allo stesso genere (Helicobacter bilis, Helicobacter pullorum, Helicobacter hepaticus) possono causare epatite anche negli animali.[48] Ancora oggi, molti studi sono in corso e il loro scopo è quello di chiarire il significato di questi riscontri.
Modalità di trasmissione
modificaLe modalità con cui l'H. pylori si trasmette sono ancora oggi sconosciute e attualmente l'uomo è l'unico serbatoio noto di questo batterio. La modalità di trasmissione più probabile è quella orale o oro-fecale.[14] Altre possibili vie di contagio sono il contatto con acque o con strumenti endoscopici contaminati, ma non esistono ancora dati definitivi al riguardo.[14][49]
Riassumendo, le principali modalità di trasmissione dell'Helicobacter pylori sono quattro:
- oro-fecale;
- orale (è stata dimostrata la presenza dell'H. pylori nella placca e nella saliva);
- attraverso materiali sanitari (uso di endoscopi o sondini naso gastrici);
- zoonosi (prevalenza alta nei veterinari e nelle persone a stretto contatto con gli animali).
Via oro-fecale
modificaÈ stato dimostrato che l'H. pylori può rimanere metabolicamente attivo in acqua corrente per vari giorni. Indagini condotte nell'America meridionale hanno rilevato che il rischio di infettarsi, tra i bambini che ingeriscono acqua proveniente dall'acquedotto, è significativamente più elevato rispetto a coloro che utilizzano una sorgente privata.
A rafforzare l'ipotesi della trasmissione attraverso questa via sono stati registrati alcuni dati che indicano un modello di distribuzione rassomigliante a quello del virus A dell'epatite, prevalentemente a trasmissione oro-fecale, e associato a situazioni igienico-sanitarie scarse e a condizioni di vita in molte persone. Infine, dopo l'evidenza della sopravvivenza dell'H. pylori in pollo e latte, anche per diversi mesi se refrigerati, si è cominciato a indagare sulla possibilità che alimenti soggetti a manipolazione e a contaminazione fecale possano rappresentare una causa di infezione. Contro una possibile via di trasmissione oro-fecale vi è la difficoltà a isolare dalle feci il batterio, oltre che il fatto che la dimostrazione a livello fecale della presenza del DNA batterico non è sintomo di evidenza dell'intero microbo in vita o in forma attiva.
Via orale
modificaA sostegno dell'ipotesi della trasmissione per via oro-orale vi è l'isolamento dell'H. pylori nella placca dentale e nella saliva. Si è inoltre ipotizzato che il microrganismo possa giungere nella cavità orale attraverso il rigurgito o il vomito. Tra l'altro alcuni dati indicano che in Africa vi è una percentuale più elevata di infezione tra i bambini le cui madri premasticano il cibo che essi a loro volta ingeriranno.
Diagnosi
modifica«Noi ci siamo soffermati sul test per riconoscere la presenza di Helicobacter pylori, tenendo presente che si tratta di un batterio molto diffuso, e su 20 milioni di ipotetici portatori, 10 sono sani e asintomatici ma altri 10 manifestano segnali come una cattiva digestione. Ci siamo soffermati su questi.»
I metodi per la diagnosi dell''Helicobacter pylori possono essere classificati come invasivi (gastroscopia e biopsia) e non invasivi (test del respiro, ricerca dell'antigene nelle feci, ricerca di anticorpi nel sangue).
Uno dei metodi non invasivi più diffusi è l'Urea Breath Test (test del respiro). Esso consiste nel far ingerire al paziente una bevanda che contiene dell'urea marcata con un isotopo del carbonio (C13 o C14) e valutare la presenza dell'anidride carbonica (CO2) marcata rilasciata nell'aria espirata.[4]. L'esame viene effettuato in ambulatorio utilizzando strumentazione apposita e con l'aiuto di un tecnico specializzato. Un'alternativa altrettanto affidabile e poco invasiva per il paziente è la ricerca dell'antigene nelle feci, chiamato test HpSA.[52] In questo caso il paziente deve semplicemente consegnare al laboratorio analisi un campione delle proprie feci su cui verrà condotto un test immunoenzimatico. L'infezione da H. pylori è anche diagnosticabile grazie alla rilevazione degli anticorpi IgG nel sangue; questo metodo, però, non consente di distinguere tra infezione attiva e infezione pregressa quindi è sconsigliato per il monitoraggio dell'efficacia della terapia.
Il metodo di riferimento per la diagnosi dell'H. pylori rimane però la gastroscopia, perché permette al medico una visione più diretta delle eventuali lesioni sulla parete dello stomaco e simultaneamente di raccogliere un campione di tessuto, che può quindi essere analizzato mediante metodi istologici o con il CLO Test (Test dell'Ureasi su campione istologico). L'H. pylori possiede un enzima, l'ureasi, che scinde l'urea.[52] Il CLO test prevede che il campione bioptico venga messo in una provetta contenenti l'urea e una cartina tornasole, con cui si può notare il cambiamento di pH nel liquido. Se esso varia significa che l'urea è stata scissa, e quindi in essa è presente l'H. pylori. Il test del respiro all'urea sfrutta lo stesso procedimento, ossia la presenza di ureasi che riesce a scindere l'urea.[52]
Terapia
modificaAutoimmunitaria
modificaStudi eseguiti in Europa hanno dimostrato una prevalenza media di sieropositività, per anticorpi contro gli H. pylori, compresa tra il 5% e il 15% nei bambini e tra il 30% e il 65% negli adulti. Il dato è differente se si stratificano i soggetti in relazione all'origine etnica, in quanto gli immigrati e i loro discendenti di prima generazione presentano dei valori più elevati rispetto agli autoctoni, numericamente simili se non identici rispetto a quelli del paese d'origine.[27]
Farmacologica
modificaLa terapia per l'eradicazione del batterio comprende inibitori di pompa protonica (IPP) per ridurre l'acidità, e l'uso di antibiotici. Tuttavia la migliore terapia è una "multipla", costituita da un inibitore di pompa associato a più antibiotici contemporaneamente. Quella che si è dimostrata più efficace contro H. pylori è quella con tetraciclina (eccetto che nei bambini al di sotto dei dodici anni),[53] metronidazolo, bismuto ed esomeprazolo per due settimane.[32][53][54]
Il primo ciclo terapeutico si basa sull'uso di:
- claritromicina 500 mg per 2/die;[55]
- amoxicillina 1 g per 2/die, o metronidazolo 500 mg per 2/die.[55]
La terapia deve durare per almeno una settimana e devono essere associati IPP.
Nel caso in cui non sia avvenuta l'eradicazione del batterio la seconda scelta terapeutica è:
- bismuto 120 mg per 4/die;[53]
- metronidazolo 500 mg per 3/die;[53]
- tetraciclina 500 mg per 4/die.[53]
Se anche il secondo ciclo dovesse rivelarsi inefficace, è indicata una biopsia endoscopica, per isolare il batterio ed effettuare la scelta del farmaco in base al risultato dell'antibiogramma.
Uno studio effettuato in Italia, nel 2006, ha proposto l'utilizzo della levofloxacina in sostituzione della claritromicina e dell'amoxicillina, come primo ciclo terapeutico per l'eradicazione del batterio.[56]
Studi genetici sui vari ceppi Helicobacter
modificaAl giorno d'oggi conosciamo vari ceppi di H. pylori, suddivisi in modo anche minimale tra loro.[57][58] I due ceppi principali differiscono per il 6% del loro genoma.
Lo studio del ceppo dell'H. pylori è incentrato nel tentativo di comprenderne la patogenicità. Possiede sessantadue geni coinvolti nella genesi del danno; entrambi i ceppi possiedono un'isola patogenicità di 40 kB che da sola ne contiene più di quaranta. Questa isola di patogenicità è assente negli H. pylori non patogeni per l'essere umano rimanendo quindi asintomatici.[57]
Il gene CagA trascrive per una delle più importanti proteine dell'H. pylori, la CagA, molto diffusa tra i batteri del genere Helicobacter. I ceppi batterici che possiedono il gene CagA sono dotati della capacità di generare ulcere molto gravi e difficili da curare. La proteina CagA è trasportata all'interno delle cellule umane, dove la funzione normale del citoscheletro verrà annullata, alterando le regolari attività della cellula. La patogenica Cag contiene circa 30 geni, che collaborano per il quarto sistema di secrezione. Dopo la fissazione dell'H. pylori alle cellule epiteliali gastriche, la proteina CagA è iniettata in esse passando per il quarto sistema di secrezione. La proteina CagA è fosforilata sui residui di tirosina da una cellula collegata alla membrana cellulare che favorisce l'ingresso della sostanza. Nei ceppi patogenici dell'H. pylori è stata inoltre evidenziata la capacità di attivare l'EGFR (il recettore del fattore di crescita dell'epidermide), una proteina della membrana dotata di attività tirosina chinasica. L'attivazione dell'EGFR dall'H. pylori è associata a trasduzioni del segnale ed espressioni geniche all'interno delle cellule epiteliali che contribuiscono alla patogenesi. È stato inoltre provato che il dominio C-terminale della proteina CagA (amminoacidi 873–1002) può regolare la trascrizione genica della cellula ospite indipendentemente dalla fosforilazione delle tirosine.[57]
Note
modifica- ^ Catalogue of Life – Helicobacter pylori, su catalogueoflife.org. URL consultato il 3 giugno 2008 (archiviato dall'url originale il 2 febbraio 2009).
- ^ a b c GastroNet – Microbiologia, su gastronet.it. URL consultato il 14 maggio 2008 (archiviato dall'url originale il 9 maggio 2008).
- ^ a b Endoscopia e terapia dell'H. pylori, su web.tiscali.it. URL consultato il 16 maggio 2008.
- ^ a b c Alarcón-Rivera G, Vázquez-Jiménez G, de la Cruz-Patiño E, Abarca M, Leyva E, Delgado F, Ruíz-Juárez I, Grube-Pagola P, Roesch-Dietlen F, Remes-Troche JM, Comparative analysis between breath test, serological immunoassay and rapid-urease test for detection of Helicobacter pylori infection in Mexican patients with non-investigated dyspepsia, in Rev Gastroenterol Mex, ottobre 2011, PMID 22188957.
- ^ a b (EN) What are Helicobacter Pylori (H.Pylori) Breath Tests?, su med.monash.edu.au. URL consultato l'8 gennaio 2011.
- ^ a b Henry George Liddell; Robert Scott, A Greek-English Lexicon. Oxford University Press, Abridgen Editions, 1980. ISBN 0-19-910207-4
- ^ (EN) M. J. Blaser, An Endangered Species in the Stomach. Scientific American, Chicago, 2005. PMID 15715390
- ^ (DE) Giulio Bizzozero, Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut. Archiv für mikroskopische Anatomie, Monaco di Baviera, 1983.
- ^ (EN) Storia di H. pylori, su helico.com. URL consultato il 15 maggio 2008 (archiviato dall'url originale il 14 maggio 2008).
- ^ (EN) J. W. Konturek, Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer. Physiol Pharmacol, New York, 2003. PMID 15075463.
- ^ L'Helicobacter pylori e l'ulcera peptica, su consensus.nih.gov. URL consultato il 18 maggio 2008 (archiviato dall'url originale il 19 agosto 2011).
- ^ (EN) A. Pietroiusti; I. Luzzi; M. J. Gomez; A. Magrini; A. Bergamaschi; A. Forlini; A. Galante, Helicobacter pylori duodenal colonization is a strong risk factor for the development of duodenal ulcer. Roma, 2005. PMID 15801926
- ^ Infezione dall'H. pylori – Caratteristiche, su gut.bmj.com. URL consultato il 18 maggio 2008.
- ^ a b c d e f H. pylori su Epicentro, su epicentro.iss.it. URL consultato il 14 maggio 2008.
- ^ Premio Nobel per la Psicologia e per la Medicina, su nobelprize.org. URL consultato il 18 maggio 2008.
- ^ (EN) K. Mobley; L. T. Harry; L. George; J. Mendz; L. Stuart; H. Hazell, Helicobacter Pylori: Physiology and Genetics. ASM Press, 2001. ISBN 1-55581-213-9
- ^ T. Starzyńska; P. Malfertheiner, Helicobacter and digestive malignancies. Helicobacter, 2005. PMID 16925609
- ^ (EN) Jonathan Olson; Robert Maier, Molecular Hydrogen as an energy source for Helicobacter pylori. Science 298.5599, New York, 2002. PMID 12459589
- ^ Yonezawa H, Osaki T, Woo T, Kurata S, Zaman C, Hojo F, Hanawa T, Kato S, Kamiya S, Analysis of outer membrane vesicle protein involved in biofilm formation of Helicobacter pylori, dicembre 2011, PMID 21515394.
- ^ a b (ZH) W. Y. Chan; P. K. Hui; K. M. Leung; J. Chow; F. Kwok; C. S. Ng, Coccoid forms of Helicobacter pylori in the human stomach. Am J Clin Pathol, 1994. PMID 7524304
- ^ (EN) Y. Yamaoka; R. A. Alm, Helicobacter pylori Outer Membrane Proteins, Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press, 2008. ISBN 978-1-904455-31-8
- ^ (EN) S. Rust, Helicobacter Flagella, Motility and Chemotaxis, Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press, 2008. ISBN 978-1-904455-31-8
- ^ (EN) A. Marais; L Monteiro; F. Mégraud, Microbiology of Helicobacter pylori. Current topics in Microbiology and Immunology, Gastroduodenal disease and Helicobacter pylori: pathophysiology, diagnosis and treatment. Westblom, 1999.
- ^ (EN) K. Goodman; K. O'Rourke; R. Day; C. Wang; Z. Nurgalieva; C. Phillips; C. Aragaki; A. Campos; J. De La Rosa, Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life. Int. J Epidemiol, 2005. PMID 16076858
- ^ (EN) K. Goodman; M. Cockburn, The role of epidemiology in understanding the health effects of Helicobacter pylori. Epidemiology, 2001. PMID 11246592
- ^ (EN) J. E. Everhart; D. Kruszon-Moran; G. I. Perez-Perez; T. S. Tralka; G. McQuillan, Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the United States. J Infect Dis, 2000.
- ^ a b GastroNet – Epidemiologia, su gastronet.it. URL consultato il 14 maggio 2008 (archiviato dall'url originale il 13 maggio 2008).
- ^ (EN) Helicobacter pylori: informazioni varie, su digestive.niddk.nih.gov. URL consultato il 15 maggio 2008 (archiviato dall'url originale il 5 luglio 2006).
- ^ Robbins e Cotran, Le basi patologiche delle malattie
- ^ (EN) C. Montecucco; E. Papini; M. De Bernard; M. Zoratti, Molecular and cellular activities of Helicobacter pylori pathogenic factors. Springer-Verlag Berlin Heidelberg, 1999.
- ^ (EN) Jérôme Viala; Catherine Chaput; Ivo Boneca; Ana Cardona; Stephen Girardin; Anthony Moran; Rafika Athman; Sylvie Memet; Michel Huerre; Anthony Coyle; Peter Di Stefano; Philippe Sansonetti; Agnès Labigne; John Bertin; Dana Philpott; Richard Ferrero, Nod1 responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island. Nature Immunol, 2004. PMID 15489856
- ^ a b c d e A. Ponzetto; R. Pellicano; F. Mégraud, Helicobacter pylori. Edizioni La Minerva, 1999.
- ^ (EN) P. Spipponen, Update on the pathologic approach to the diagnosis of gastritis, gastric atrophy, and Helicobacter pylori and its sequelae. J Clin Gastroenterol, 2001.
- ^ a b c d e GastroNet – Aspetti clinici, su gastronet.it. URL consultato il 15 maggio 2008 (archiviato dall'url originale il 13 maggio 2008).
- ^ a b (EN) R. J. Hopkins; L. S. Girardi; E. A. Turney, Relationship between Helicobacter pylori eradication and reduced duodenal and gastric ulcer recurrence: A review. Gastroenterology, 1996.
- ^ (EN) N. J. Talley; D. Colin-Jones; K. L. Kock, Functional dyspespia: a clarification with guidelines for diagnosis and management. Gastroenterol, 1991.
- ^ Yahoo! salute – H. pylori, su it.health.yahoo.net. URL consultato il 16 maggio 2008 (archiviato dall'url originale l'11 dicembre 2008).
- ^ (EN) International Agency for Research on Cancer. World Health Organization, Infection with Helicobacter pylori. Schistosomes, liver flukes and Helicobacter pylori, 1994.
- ^ (EN) R. Fiocca; R. Luinetti; L. Villani; A. Chiaravalli; M. Cornaggia; G. Stella; M. Perego; E. Trespi; E. Solcia, High incidence of Helicobacter pylori colonization in early gastric cancer and the possible relationship to carcinogenesis. Eur J Gastroenterol Hepatol, 1994.
- ^ (EN) G. Nardone; S. Staibano; A. Rocco; E. Mezza; F. P. D'Armiento; L. Insabato; A. Coppola; G. Salvatore; A. Lucariello; N. Figura; G. De Rosa; G. Budillon, Effect of Helicobacter pylori infection and its eradication on cell proliferation, DNA status, and oncogene expression in patients with chronic gastritis. Gut, 1999.
- ^ (EN) P. Correa; W. Haenszel; C. Cuello; D. Zavala; E. Fontham; G. Zarama; Z. Zannenbaum; T. Collazos; B. Ruiz, Gastric precancerous process in a high risk population: Cohort follow-up. Cancer Res, 1990.
- ^ (EN) D. Palli, Gastric cancer and Helicobacter pylori: A critical evaluation of the epidemiological evidence. Helicobacter, 1997.
- ^ (EN) S. Tsuji; N. Kawai; M. Tsujii; S. Kawano; M. Hori, Review article: inflammation-related promotion of gastrointestinal carcinogenesis –a perigenetic pathway. Aliment Pharmacol Ther 18, 2003. PMID 12925144
- ^ dr. Gargiulo, prof. Vaira, Helicobacter pylori. Benedetto il giorno che t'ho incontrato, Mondadori editore
- ^ Prof. Vaira intervento su Ambiente gastro-intestinale e assorbimento dell'ormone tiroideo, al Convegno IPOTIROIDISMO: Novità, dubbi e certezze in tema di terapia con L-tiroxina, Università degli Studi di Torino, Sabato 22 novembre 2014
- ^ a b (EN) A. C. Wotherspoon; C. Doglioni; T. C. Diss; L. Pan; A. Moschini; M. De Boni; P. G. Isaacson, Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue after eradication of Helicobacter pylori. Lancet, 1993.
- ^ (EN) J. Danesh; A. Gasbarrini; F. Cremonini; G. Gasbarrini, Helicobacter pylori infection and extradigestive diseases. Curr Opin Gastroenterol, 2000.
- ^ a b GastroNet – Patologie extragastrodeudenali, su gastronet.it. URL consultato il 15 maggio 2008 (archiviato dall'url originale il 28 aprile 2008).
- ^ (EN) Cause d'infezione dell'H. pylori [collegamento interrotto], su jstor.org. URL consultato il 14 maggio 2008.
- ^ Diagnosi e cura dell'H. pylori, su dica33.it. URL consultato il 15 maggio 2008.
- ^ (EN) D. Vaira, Accuracy of breath tests using low doses of 13C-urea to diagnose Helicobacter pylori infection: a randomised controlled trial. Gut, 2006.
- ^ a b c (EN) Peter Malfertheiner; Francis Mégraud; Colm O'Morain, Guidelines for the Management of Helicobacter Pylori Infection Archiviato il 13 novembre 2008 in Internet Archive.. European Gastroenterology Review, 2005.
- ^ a b c d e V. M. Galan; A. A. Kishan; A. L. Silverman, Oral broccoli sprouts for the treatment of Helicobacter pylori infection: a preliminary report. Dig Dis Sci, 2004. PMID 15387326
- ^ Helicobacter pylori, su nutritionvalley.it. URL consultato il 17 maggio 2008 (archiviato dall'url originale il 29 febbraio 2008).
- ^ a b Mirbagheri Seyed Amir; Mehrdad Hasibi; Mehdi Abouzari; Armin Rashidi, Triple, standard quadruple and ampicillin-sulbactam-based quadruple therapies for H pylori eradication: A comparative three-armed randomized clinical trial. World Journal of Gastroenterology, 2006. PMID 16937475
- ^ Nista EC, Candelli M, Zocco MA, Cremonini F, Ojetti V, Finizio R, Spada C, Cammarota G, Gasbarrini G, Gasbarrini A., Levofloxacin-based triple therapy in first-line treatment for Helicobacter pylori eradication, in The American Journal of Gastroenterology, 2006, PMID 16968503.
- ^ a b c (EN) J. F. Tomb; O. White; A. R. Kerlavage; R. A. Clayton; G. G. Sutton; R. D. Fleischmann; K. A. Ketchum; H. P. Klenk; S. Gill; B. A. Dougherty; K. Nelson; J. Quackenbush; L. X. Zhou; E. F. Kirkness; S. Peterson; B. Loftus; D. Richardson; R. Dodson; H. G. Khalak; A. Glodek; K. McKenney; L. M. Fitzegerald; N. Lee; M. D. Adams; E. K. Hickey; D. E. Berg; J. D. Gocayne; T. R. Utterback; J. D. Peterson; J. M. Kelley; M. D. Cotton; J. M. Weldman; C. Fujii; C. Bowman; L. Watthey; E. Wallin; W. S. Hayes; J. M. Weidman; M. Borodovsky; P. D. Karp; H. O. Smith; C. M. Fraser; J. C. Venter, The complete genome sequence of the gastric pathogen Helicobacter pylori. Nature, 1997. PMID 9252185
- ^ (EN) Il genere Helicobacter, su genolist.pasteur.fr. URL consultato il 19 maggio 2008.
Bibliografia
modificaTesi e dissertazioni
modifica- (EN) Bronte-Tinkew, Dana Melanie, T-Space at The University of Toronto Libraries: Mechanism of Helicobacter pylori Induced Gastric Cancer: Role of the Signal Transducer and Activator of Transcription Pathway, su tspace.library.utoronto.ca, Jun 2010. URL consultato l'8 gennaio 2012.
- (EN) Demitrack, Elise, OhioLINK ETD: Mechanisms of Gastric Defense against Luminal Acid and Helicobacter pylori [collegamento interrotto], su etd.ohiolink.edu, Aug 2010. URL consultato l'8 gennaio 2012.
- (EN) Bellucci, Matteo, Molecular interactions: metal ions and protein chaperones in the urease system from Helicobacter pylori, su etd.lib.nsysu.edu.tw, Apr 2010. URL consultato l'8 gennaio 2012.
- (FR) Tosi, Tommaso, Etudes structurales de facteurs de virulence de la bactérie Helicobacter pylori (PDF), su tel.archives-ouvertes.fr. URL consultato l'8 gennaio 2012.
Testi
modifica- F. Pace e Sergio Vigneri, Helicobacter pylori, Springer, 1º giugno 1999, ISBN 978-88-470-0065-0.
- Medicina interna sistematica, Elsevier srl, 2010, pp. 648–, ISBN 978-88-214-3109-8.
- Giampiero Carosi, Carosi - Pauluzzi e Sergio Pauluzzi, Malattie infettive, PICCIN, 2007, pp. 184–, ISBN 978-88-299-1844-7.
- Panteghini, Interpretazione degli esami di laboratorio, PICCIN, 2008, pp. 399–, ISBN 978-88-299-1896-6.
- Mauro Moroni, Roberto Esposito e Fausto De Lalla, Malattie infettive, Elsevier srl, 2008, pp. 511–, ISBN 978-88-214-2980-4.
- Humphrey P. Rang, M. Maureen Dale e James M. Ritter, Farmacologia, Elsevier srl, 2008, pp. 391–, ISBN 978-88-214-3023-7.
- S. Fiorucci e F Pace, FANS e apparato digerente, Springer, 2000, pp. 26–, ISBN 978-88-470-0109-1.
- Rosalba Mattei, Manuale di nutrizione clinica, FrancoAngeli, 2001, pp. 263–, ISBN 978-88-464-3292-6.
- Thomas C. King, Patologia, Elsevier srl, 2008, pp. 221–, ISBN 978-88-214-3019-0.
- Francesco Mazzeo e Pietro Forestieri, Trattato di chirurgia oncologica, PICCIN, 2003, pp. 10–, ISBN 978-88-299-1654-2.
- (EN) R. Biselli; M. Fortini; P. M. Matricardi; T. Stroffolini; R. D'Amelio, Incidence of Helicobacter pylori infection in a cohort of Italian military students. Infection, Roma, 1999.
- (EN) J. Danesh; A. Gasbarrini; G. Gasbarrini; F. Cremonini, Helicobacter pylori infection and extradigestive diseases. Curr Opin Gastroenterol, Roma, 2000.
- (EN) P. Correa; W. Haenszel; C. Cuello; D. Zavala; E. Fonthnam; G. Zarama; Z. Zannenbaum; T. Collazos; B. Ruis, Gastric precancerous process in a high risk population: Cohort follow-up. Cancer Res, Londra, 2000.
- (EN) N. Vakil; D. Vaira, Non-Invasive Tests for the Diagnosis of H. pylori Infection, volume 4. Reviews in Gastroenterological Disorders, 2004.
- (EN) J. Danesh; P. Whincup; M. Walker; L. Lennon; A. Thompson; P. Appleby; C. Hawkey; J. C. Atherton, High prevalence of potentially virulent strains of Helicobacter pylori in the general male British population. Gut, 2000.
- (EN) C. Ecclissato; M. A. Marchioretto; S. Mendonca; A. P. Godoy; R. A. Guersoni; M. Deguer; H. Piovesan; J. G. Ferraz; J. Pedrazzoli, Increased primary resistance to recommended antibiotics negatively affects Helicobacter pylori eradication. Helicobacter, 2002.
- (EN) J. E. Everhart; D. Kruszon-Moran; G. I. Perez-Perez; T. S. Tralka; G. McQuillan, Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the United States. J Infect Dis, 2000.
- (EN) R. Fiocca; Luinetti; L. Villani; A. Chiaravalli; M. Cornaggia; G. Stella; M. Perego; E. Trespi, Solcia E. High incidence of Helicobacter pylori colonization in early gastric cancer and the possible relationship to carcinogenesis. Eur J Gastroenterol Hepatol, 1993.
- (EN) R. J. Hopkins; L. S. Girardi; E. A. Turney, Relationship between Helicobacter pylori eradication and reduced duodenal and gastric ulcer recurrence: A review. Gastroenterology, 1996.
- (EN) International Agency for Research on Cancer - World Health Organization, Infection with Helicobacter pylori. In: Schistosomes, liver flukes and Helicobacter pylori. IARC, 1994.
- (EN) I. D. Kyriazanos; I. Ilias; V. Gizaris; P. Hountis; V. Georgaklis; A. Dafnopoulou; K. Datsakis, Seroepidemiology of Helicobacter pylori infection in hellenic navy recruits. Eur J Epidemiol, 2001.
- (EN) L. Laine; R. J. Hopkins; L. S. Girardi, Has the impact of Helicobacter pylori therapy on ulcer recurrence in the United States been overstated? A meta-analysis of rigorously designed trials. Am J Gastroenterol, 1998.
- (EN) F. L. Lanza, A guideline for the treatment and prevention of NSAID-induced ulcers. Am J Gastroenterol, 1998.
- (EN) R. P. H. Logan; M. M. Walker MM, Epidemiology and diagnosis of Helicobacter pylori infection. BMJ, 2001.
- (EN) A. Marais; L. Monteiro; F. Mégraud, Microbiology of Helicobacter pylori. T. U. Westblom; S. J. Czinn; J. G. Nedrud.
- (EN) C. Montecucco; E. Papini; M. de Bernard; M. Zoratti, Molecular and cellular activities of Helicobacter pylori pathogenic factors. FEBS Letters, 1999.
- (EN) G. Nardone; S. Staibano; A. Rocco; E. Mezza; F. P. D'Armiento; L. Insabato; A. Coppola; G. Salvatore; A. Lucariello; N. Figura; G. De Rosa; G. Budillon, Effect of Helicobacter pylori infection and its eradication on cell proliferation, DNA status, and oncogene expression in patients with chronic gastritis. Gut, 1999.
- (EN) T. Ohkusa; K. Fujiki; I. Takashimizu; J. Kumagai; T. Tanizawa; Y. Eishi; T. Yokoyama; M. Watanabe, Improvement in atrophic gastritis and intestinal metaplasia in patients in whom Helicobacter pylori was eradicated. Ann Intern Med, 2001.
- (EN) D. Palli, Gastric cancer and Helicobacter pylori: A critical evaluation of the epidemiological evidence. Helicobacter, 1997.
- (EN) R. Pellicano; S. Peyre; N. Leone; A. Repici; C. De Angelis; R. Rizzi; M. Rizzetto; A. Ponzetto, The effect of the eradication of Helicobacter pylori infection on hemorrhage because of duodenal ulcer. J Clin Gastroenterol, 2001.
- (EN) A. Ponzetto; R. Pellicano; F. Mégraud, Helicobacter pylori. Edizioni Minerva Medica, Torino, 1999.
- (EN) P. Sipponen, Update on the pathologic approach to the diagnosis of gastritis, gastric atrophy, and Helicobacter pylori and its sequelae. J Clin Gastroenterol, 2001.
- (EN) N. J. Talley; D. Colin-Jones; K. L. Kock, Functional dyspespia: a clarification with guidelines for diagnosis and management. Gastroenterol Int, 1991.
- (EN) A. C. Tan; G. D. Hartog; C. J. Mulder, Eradication of Helicobacter pylori does not decrease the long-term use of acid-suppressive medication. Aliment Pharmacol Ther, 1999.
- (EN) J. M. Pajares Garcia; M. Quina; G. N. J. Tytgat, Noninvasive antigen-based assay for assessing Helicobacter pylori eradication: A European Multicenter Study. Am J Gastroenterol, 2000.
- (EN) A. C. Wotherspoon; C. Doglioni: T. C. Diss; L. Pan; A. Moschini; M. De Boni; P. G. Isaacson, Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue after eradication of Helicobacter pylori. Lancet, 1993.
- (EN) F.T. Bosman; F. Carniero; R.H. Hruban; Neil D.Theise; WHO classification of Tumours of the Digestive System. IARC 4th Ed. 2010
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Helicobacter pylori
- Wikispecies contiene informazioni su Helicobacter pylori
Collegamenti esterni
modifica- (EN) Helicobacter pylori, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- EpiCentro - Helicobacter pylori, su epicentro.iss.it.
- (EN) Search Results: Helicobacter pylori, su cdc.gov.
- (EN) Reference Search, su search.medscape.com.
- Helicobacter host/agente patogeno interazioni, su polygenicpathways.co.uk.
- (EN) Catalogue of Life: Helicobacter pylori, su catalogueoflife.org, 2012. URL consultato il 5 dicembre 2012.
| Controllo di autorità | Thesaurus BNCF 5364 · LCCN (EN) sh88002440 · BNF (FR) cb12165059q (data) · J9U (EN, HE) 987007536702205171 |
|---|
