Sintesi di Fischer dell'indolo
La sintesi dell'indolo di Fischer è una reazione chimica che produce l'eterociclo aromatico indolo. Utilizza come reagenti una fenilidrazina (se necessario sostituita) ed un'aldeide o un chetone ed è condotta in ambiente acido.[1][2]
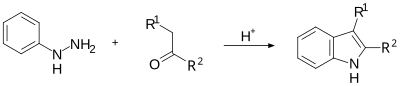
Tale reazione fu scoperta nel 1883 da Fischer. Oggi questa reazione è impiegata nella sintesi di alcuni composti anti-emicrania della classe dei triptani.
L'impiego di un catalizzatore acido è d'importanza cruciale. Acidi di Bronsted quali HCl, H2SO4 e l'acido p-toluensolfonico sono stati usati con successo. Anche acidi di Lewis quali il trifluoruro di boro, il cloruro di zinco, il cloruro di ferro ed il cloruro d'alluminio sono utili catalizzatori. Negli anni sull'argomento sono state pubblicate diverse review.[3][4]
Meccanismo di reazione
modificaNella prima fase si ha la formazione del fenilidrazone (un'immina) a partire dalla reazione della fenilidrazina con un chetone, in ambiente acido, che può essere isolato come composto stabile:
Il fenilidrazone segue un processo di tautomeria per diventare un'enammina (ammina α,β-insatura), che a sua volta si ri-arrangia, tramite trasposizione sigmatropica [3,3], formando un forte legame carbonio-carbonio e scindendo il debole legame azoto-azoto grazie al movimento degli elettroni nell'anello a sei membri.
Segue poi la “ri-aromatizzazione” dell'anello benzenico, grazie al movimento del protone idrogeno dal carbonio all'azoto. Questo processo porta alla formazione di un'ammina aromatica che attacca immediatamente le altre immine. Da qui si ricava un'amminale (o amminoacetale).
Infine, la decomposizione acido-catalizzata dell'amminale, in forma acetalica, con formazione di ammoniaca (NH3), permette la perdita di un protone idrogeno e la formazione di un indolo aromatico.
La sintesi indolica di Fischer è il metodo principale per produrre composti indolici, ma non è applicabile a tutti gli indoli. Se l'anello benzenico ha una sola posizione orto disponibile, la ciclizzazione deve avvenire in questa posizione. Gli altri sostituenti sono irrilevanti.
Se il carbonile può enolizzare solo su un lato, come nel caso di un'aldeide, il prodotto formato è ovvio.
Un altro metodo per ottenere un singolo indolo dalla sintesi di Fischer è utilizzare reagenti simmetrici come ad esempio:
Il primo modello di sostituzione è particolarmente importante in quanto molti importanti farmaci seguono questo modello. Inoltre anche la serotonina, che è un neurotrasmettitore, è un indolo con un gruppo ossidrilico (-OH) in posizione 5 e segue questo modello.
È facilmente intuibile che, riportandoci alla prima immagine, a reagire con la fenilidrazina, avente un gruppo OH in posizione para, con è un'aldeide ottenuta sostituendo R1 con (-CH2CH2NH2 ) e R2 semplicemente con (-H).
Studi con isotopi marcati hanno dimostrato che l'azoto arilico della fenilidrazina di partenza è quello incorporato nell'indolo.[5]
Note
modifica- ^ (EN) Emil Fischer, Friedrich Jourdan, Ueber die Hydrazine der Brenztraubensäure (abstract), in Berichte der deutschen chemischen Gesellschaft, vol. 16, 1883, p. 2241, DOI:10.1002/cber.188301602141. URL consultato il 13 marzo 2011.
- ^ (EN) Emil Fischer, Hess Otto, Synthese von Indolderivaten (abstract), in Berichte der deutschen chemischen Gesellschaft, vol. 17, 1884, p. 559, DOI:10.1002/cber.188401701155. URL consultato il 13 marzo 2011.
- ^ (EN) R. B. Van Order, Indole (abstract), in Chemical Reviews, vol. 30, n. 1, febbraio 1942, pp. 69-96, DOI:10.1021/cr60095a004. URL consultato il 13 marzo 2011.
- ^ (EN) B. Robinson, The Fischer Indole Synthesis (abstract), in Chemical Reviews, vol. 63, n. 4, agosto 1963, pp. 373-401, DOI:10.1021/cr60224a003. URL consultato il 13 marzo 2011.
- ^ (EN) C. F. H. Allen, The Use of N15 as a Tracer Element in Chemical Reactions. The Mechanism of the Fischer Indole Synthesis (abstract), in Journal of the American Chemical Society, vol. 65, n. 4, aprile 1943, pp. 611-612, DOI: 10.1021/ja01244a033. URL consultato il 13 marzo 2011.
Bibliografia
modifica- Clayden, J.; Greeves, N. ; Warren, S.; Wothers, P. 2001. Organic Chemistry. Oxford, Oxford University Press.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Sintesi di Fischer dell'indolo