1,5-cicloottadiene
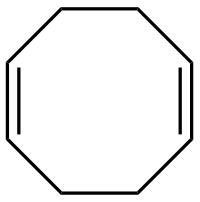
L'1,5-cicloottadiene è un composto organico di formula C8H12. Il nome viene generalmente abbreviato come COD o cod. È un diene ciclico; i due doppi legami hanno entrambi configurazione cis. Viene usato come utile precursore per altri composti organici, e anche come legante in chimica metallorganica.[1][2] In condizioni normali è un liquido incolore.
| 1,5-cicloottadiene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (1Z,5Z)-ciclootta-1,5-diene | |
| Nomi alternativi | |
| 1,5-cicloottadiene, COD, cod | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H12 |
| Massa molecolare (u) | 108,18 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 203-907-1 |
| PubChem | 8135 |
| SMILES | C1CC=CCCC=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,882 |
| Indice di rifrazione | 1,494 |
| Solubilità in acqua | 0,48 g/L a 20 °C |
| Temperatura di fusione | −69,5 °C (204 K) |
| Temperatura di ebollizione | 151 °C (424 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 2,22 (oral rat) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 38 °C (311 K) |
| Simboli di rischio chimico | |
| Frasi R | 10, 19, 36/38, 43 |
| Frasi S | 26, 36 |
Sintesi
modificaIl COD si può preparare per dimerizzazione del butadiene in presenza di un catalizzatore di nichel. Come prodotto indesiderato si forma anche vinilcicloesene. Nel 2005 ne sono state prodotte circa 10000 tonnellate.[3]
Reazioni organiche
modificaIl COD reagisce con il borano per formare il dimero 9-borabiciclo[3.3.1]nonano,[4] noto comunemente come 9-BBN, un reagente usato in chimica organica per condurre idroborazioni:
Il COD addiziona SCl2 o reagenti simili per formare il 2,6-dicloro-9-tiabiciclo[3.3.1]nonano:[5]
Il dicloruro formato si può trasformare nel diazide o diciano derivato con una sostituzione nucleofila facilitata dalla presenza dell'atomo di zolfo.[6]
Reattività come legante
modificaIn genere il COD si lega a metalli in basso stato di ossidazione utilizzando entrambi i doppi legami. Il complesso Ni(COD)2 è un precursore per vari complessi di nichel(0) e nichel(II). I complessi metallici con il COD sono interessanti perché sono abbastanza stabili da essere isolati, e spesso sono più stabili dei corrispondenti complessi di etilene. La stabilità dei complessi contenenti COD è attribuibile all'effetto della chelazione. I leganti COD possono essere facilmente sostituiti da altri leganti, come ad esempio da fosfine.
Ad esempio, Ni(COD)2 si ottiene per riduzione di acetilacetonato di nichel anidro in presenza di COD, usando trietilalluminio:[7]
- 1/3[Ni(C5H7O2)2]3 + 2COD + 2Al(C2H5)3 → Ni(COD)2 + 2Al(C2H5)2(C5H7O2) + C2H4 + C2H6
L'analogo composto Pt(COD)2 si prepara in modo più tortuoso con dilitio cicloottatetraene:[8]
- Li2C8H8 + PtCl2(COD) + 3C7H10 → [Pt(C7H10)3] + 2LiCl + C8H8 + C8H12
- Pt(C7H10)3 + 2COD → Pt(COD)2 + 3C7H10
I complessi di COD sono stati ampiamente studiati; molte ricerche sono descritte nei volumi 25, 26 e 28 della rivista Inorganic Syntheses. Il complesso di platino è stato usato in molte sintesi; ad esempio:
- Pt(COD)2 + 3C2H4 → Pt(C2H4)3 + 2COD
I complessi di COD sono utili come materiali di partenza per altre sintesi; ad esempio:
- Ni(COD)2 + 4CO(g) Ni(CO)4 + 2COD
Il prodotto Ni(CO)4 è molto tossico, e quindi è più conveniente generarlo nel recipiente di reazione anziché aggiungerlo dall'esterno.
Altri complessi del COD con metalli in basso stato di ossidazione sono ad esempio Mo(CO)4(COD), [RuCl2(COD)]n e Fe(CO)3(COD). Il COD è particolarmente importante nella chimica di coordinazione di rodio(I) e iridio(I), come esemplificato dal catalizzatore di Crabtree, [Ir(COD)(PCy3)(py)]+,[9] dal dimero [Rh(COD)Cl]2,[10] e dai complessi planari quadrati [M(COD)2]+ (M = Rh, Ir).
(E,E)-COD
modificaEsiste anche l'isomero trans-trans del 1,5-cicloottadiene. Il composto (E,E)-COD è fortemente tensionato ed è stato sintetizzato per la prima volta nel 1969 per fotoisomerizzazione del composto cis.[11] Un'altra sintesi successiva consiste in una doppia reazione di eliminazione da un anello di cicloottano.[12] Il composto è stato studiato per possibili utilizzi in click chemistry.[13]
Sicurezza
modificaIl COD è un composto infiammabile, ed è irritante per la pelle e gli occhi. Può causare reazioni allergiche sulla pelle. Non ci sono dati che indichino proprietà cancerogene.[14]
Note
modifica- ^ Buehler e Pearson 1970.
- ^ Crabtree 2005.
- ^ Schiffer e Oenbrink 2005.
- ^ Soderquist e Negron 1998.
- ^ Bishop 1998.
- ^ Diaz et al. 2006.
- ^ Schunn et al. 2007.
- ^ Crascall e Spencer 2007.
- ^ Crabtree 1979.
- ^ Giordano e Crabtree 1990.
- ^ Whitesides et al. 1969.
- ^ Boeckh et al. 1987.
- ^ Stöckmann et al. 2011.
- ^ Sigma-Aldrich, scheda di sicurezza di 1,5-cicloottadiene.
Bibliografia
modifica- R. Bishop, 9-Thiabicyclo[3.3.1]nonane-2,6-dione, in Org. Synth., Coll. Vol. 9, 1998, p. 692. URL consultato il 4 ottobre 2011 (archiviato dall'url originale il 5 giugno 2011).
- D. Boeckh, R. Huisgen, H. Noeth, Preparation and conformation of (E,E)-1,5-cyclooctadiene, in J. Am. Chem. Soc., vol. 109, n. 4, 1987, pp. 1248-1249, DOI:10.1021/ja00238a046. URL consultato il 6 ottobre 2011.
- C. A. Buehler, D. E. Pearson, Survey of organic synthesis, Wiley, 1970, ISBN 0-471-11671-8.
- R. Crabtree, Iridium Compounds in Catalysis, in Acc. Chem. Res., vol. 12, n. 9, 1979, pp. 331-337, DOI:10.1021/ar50141a005. URL consultato il 6 ottobre 2011.
- R. H. Crabtree, The organometallic chemistry of the transition metals, 4ª ed., Wiley, 2005, ISBN 0-471-66256-9.
- L. E. Crascall, J. L. Spencer, Olefin Complexes of Platinum, in Inorg. Synth., vol. 28, 2007, p. 126, DOI:10.1002/9780470132593.ch34. URL consultato il 6 ottobre 2011.
- D. D. Diaz, A. Converso, K. B. Sharpless, M. G. Finn, 2,6-Dichloro-9-thiabicyclo[3.3.1]nonane: Multigram Display of Azide and Cyanide Components on a Versatile Scaffold (PDF), in Molecules, vol. 11, 2006, pp. 212-218. URL consultato il 4 ottobre 2011.
- G. Giordano, R. H. Crabtree,, Di-μ-chloro-bis(η4-1,5-cyclooctadiene)dirhodium(I), in Inorg. Synth., vol. 28, 1990, pp. 88-90, ISBN 0-471-52619-3.
- T. Schiffer, G. Oenbrink, Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005.
- R. A. Schunn, S. D. Ittel, M. A. Cushing, Bis(1,5-Cyclooctadiene)Nickel(0), in Inorg. Synth., 2007, p. 94, DOI:10.1002/9780470132593.ch25. URL consultato il 6 ottobre 2011.
- J. A. Soderquist, A. Negron, 9-Borabicyclo[3.3.1]nonane dimer, in Org. Synth., Coll. Vol. 9, 1998, p. 95. URL consultato il 4 ottobre 2011 (archiviato dall'url originale il 6 giugno 2011).
- H. Stöckmann, A. A. Neves, H. A. Day, S. Stairs, K. M. Brindle, F. J. Leeper, (E,E)-1,5-Cyclooctadiene: a small and fast click-chemistry multitalent, in Chem. Commun., vol. 47, n. 25, 2011, pp. 7203-7205, DOI:10.1039/C1CC12161H. URL consultato il 6 ottobre 2011.
- G. M. Whitesides, G. L. Goe, A. C. Cope, Irradiation of cis,cis-1,5-cyclooctadiene in the presence of copper(I) chloride, in J. Am. Chem. Soc., vol. 91, n. 10, 1969, pp. 2608-2616, DOI:10.1021/ja01038a036. URL consultato il 6 ottobre 2011.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su 1,5-cicloottadiene