Triossido di cromo
Il triossido di cromo è il composto inorganico di formula CrO3, l'ossido del cromo esavalente in cui sono formalmente impegnati tutti gli elettroni d del cromo (specie d0).[2] Anche gli altri elementi del gruppo del cromo (gruppo 6) formano triossidi analoghi: triossido di molibdeno (MoO3) e triossido di tungsteno (WO3). A temperatura ambiente si presenta come un solido rosso scuro inodore, igroscopico e deliquescente.[3] Ne vengono prodotte ogni anno migliaia di tonnellate, principalmente per applicazioni di galvanostegia.[4]
| Triossido di cromo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di cromo | |
| Nomi alternativi | |
| ossido di cromo(VI)
anidride cromica (vecchio)
| |
| Caratteristiche generali | |
| Formula bruta o molecolare | CrO3 |
| Peso formula (u) | 99,99 g/mol |
| Aspetto | solido rosso scuro inodore |
| Numero CAS | |
| Numero EINECS | 215-607-8 |
| PubChem | 14915 |
| SMILES | O=[Cr](=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,7 (20 °C) |
| Solubilità in acqua | 61,7 g/100 mL (0 °C) 63 g/100 mL (25 °C) 67 g/100 mL (100 °C) |
| Temperatura di fusione | 197 °C (470 K) |
| Temperatura di ebollizione | 251 °C (524 K) con decomposizione |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 80, oral rat |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 271 - 350 - 340 - 361f - 330 - 301 - 311 - 372 - 314 - 317 - 334 - 335 - 410 |
| Consigli P | 201 - 273 - 280 - 301+330+331 - 304+340 - 305+351+338 - 309+310 [1] |
Il triossido di cromo è un composto del cromo nel suo stato di ossidazione più elevato, +6; al quale per esso corrispondono proprietà fortemente ossidanti, che però sono sostanzialmente assenti negli analoghi triossidi degli elementi che seguono il cromo nel suo gruppo, quello di molibdeno MoO3 e quello di tungsteno WO3,[5] proprietà che vengono largamente impiegate anche in chimica organica.[6]
Il triossido di cromo è molto tossico, corrosivo, cancerogeno e pericoloso per l'ambiente. In commercio è noto con il nome comune di acido cromico:[7] tale denominazione è deprecabile in quanto è chimicamente errata, perché l'acido cromico è, invece, il composto di formula molecolare H2CrO4. La vecchia denominazione di anidride cromica[8][9] è invece appropriata e razionale, in quanto il triossido di cromo è capace di dare acido cromico per addizione di acqua, e quindi poi i suoi sali, i cromati e bicromati, ed anche gli alogenuri di cromile CrO2X2, in chiara analogia all'anidride solforica e gli analoghi suoi prodotti (vide infra), denominazione che però non è riconosciuta dalla IUPAC:[10]
Struttura e proprietà
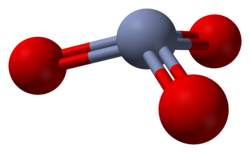
modificaIl triossido di cromo a temperatura e pressione ambiente è un solido cristallino covalente, non molecolare, di colore rosso scuro. In fase gassosa il composto è molto stabile termodinamicamente (ΔHƒ° = -292,88 kJ/mol)[11] e consiste di molecole di triossido di cromo. Calcoli teorici basati sulla teoria del funzionale densità assegnano al triossido di cromo una struttura piramidale (simmetria C3v), con l'atomo di cromo al vertice, piuttosto che una struttura planare (simmetria D3h), che sarebbe analoga a quella dell'anidride solforica SO3 e di quella selenica SeO3, che sono isoelettroniche di valenza. Nella molecola la distanza Cr-O calcolata è di 159,3 pm,[12] un valore che è significativamente minore di quello per un legame Cr-O singolo, pari a 174,8 pm, e questo è pertanto indice di legame multiplo tra il cromo e l'ossigeno.[13]
L'affinità elettronica sperimentale della molecola è di 3,66 eV (valore verticale), un valore elevato, che rende conto del suo alto potere ossidante,[12] che viene poi ereditato dai cromati CrO2−4 e bicromati Cr2O2−7; per quest'ultimo, il potenziale di riduzione è infatti alto: in ambiente acido, E°[Cr(VI) / Cr(III)] = 1,38 V.[14]
Nella fase gassosa, in dipendenza di temperatura e pressione, le molecole di triossido di cromo possono condensare a formare via via oligomeri (CrO3)n per condivisione di atomi di ossigeno, con il cromo che così aumenta il suo numero di coordinazione da 3 a 4. Allo stato solido si perviene per prosecuzione indefinita di questo processo di condensazione, fino a formare catene di tetraedri CrO4 che condividono due vertici.[15] In ciascun tetraedro l'atomo di cromo è legato a due ossigeni non condivisi con un legame formalmente doppio, e ad altri due ossigeni a ponte, da due vertici di ciascun tetraedro, ciascuno con legame formalmente singolo −O−[−Cr(=O)2−O]n.[16][17]
Altre specie binarie di cromo(VI) con l'ossigeno
modificaUna particolarità del triossido di cromo è la formazione di inusuali composti perossidici come CrO5 (ossido diperossido di cromo[18]).[19] La molecola è formata da un atomo di cromo centrale che lega un atomo di ossigeno con legame doppio e due unità perossidiche (−O−O−) che si chiudono ad anello triangolare sul cromo: O=Cr(O−O)2, con Cr pentacoordinato.
Si forma trattando un bicromato alcalino con acqua ossigenata in presenza di acido solforico:[19][20]
La molecola come tale è instabile, il composto è noto in soluzione acquosa, dove però si decompone lentamente se non viene stabilizzato dalla presenza di molecole donatrici all'ossigeno o all'azoto, con le quali forma addotti che, al tempo stesso, sono complessi di Cr(VI).[21] CrO5, oltre che un ossidante come il triossido di cromo, è infatti anch'esso un acido di Lewis e forma addotti di colore blu intenso con eteri e ammine terziarie ed eterocicliche (piridina), con Cr che diviene esacoordinato e che risultano ragionevolmente stabili:
Sulla formazione di questo complesso blu in soluzione eterea si basa un saggio di riconoscimento del cromo(VI) (saggio di Barresville).[22]
Sintesi e reattività
modificaIl triossido di cromo è preparato trattando con acido solforico soluzioni sature di cromato di sodio o di dicromato di sodio:[7]
Nel 1981 ne sono state prodotte circa 30000 tonnellate.[23]
Il triossido di cromo fonde a 197 °C e sopra questa temperatura si decompone perdendo ossigeno; si formano vari ossidi intermedi fino ad arrivare all'ossido verde triossido di dicromo (Cr2O3):[17]
Il triossido di cromo è un acido di Lewis e come tale reagisce con varie basi formando addotti. Con la piridina in soluzione di diclorometano, ad esempio, ne somma due molecole formando (C5H5N)2 • CrO3, dando luogo al noto reattivo di Collins, usato in ossidazioni organiche:[24]
Con l'acqua come base reagisce formando verosimilmente dapprima l'addotto H2O • CrO3, che poi si riarrangia rapidamente ad acido cromico O2Cr(OH)2 per migrazione di protone, analogamente a quanto fanno l'anidride solforica SO3 e quella selenica SeO3.[25][26] L'acido cromico H2CrO4 così formato in soluzione acquosa si dissocia poi parzialmente a ione idrogenocromato HCrO4−.In soluzioni acquose basiche si dissocia ulteriormente ed è quindi presente come classico ione cromato giallo (CrO42−). Abbassando il pH, lo ione cromato viene protonato e si formano le specie [HCrO4]− e acido cromico (H2CrO4), ma non in grande quantità, dato che si instaura un favorevole equilibrio di condensazione a formare lo ione dicromato [O3Cr−O−CrO3]2−, di colore rosso arancio, analogo e isostrutturale allo ione pirosolfato S2O72− (però, incolore):[15]
A seconda del pH si formano inoltre quantità alquanto minori degli ioni oligomeri [Cr3O10]2− e [Cr4O13]2−. Non si formano invece specie a più alta nuclearità simili ai poliossometallati che si osservano nella chimica di vanadio(V), molibdeno(VI) e tungsteno(VI),[17] per il fatto che il raggio ionico dei rispettivi metalli centrali è maggiore di quello di Cr(VI) e questo facilita quindi numeri di coordinazione più grandi.[5]
Con soluzioni acquose di acidi alogenidrici HX reagisce sommandone i rispettivi anioni, che sono basi di Lewis; con HCl, ad esempio, forma lo ione clorocromato, tetraedrico (analogo al clorosolfato SO3Cl−):[15]
Trattando il triossido di cromo con acido cloridrico gassoso si ottiene il cloruro di cromile CrO2Cl2, analogo al cloruro di solforile (SO2Cl2, incolore), come liquido rosso sangue:[27]
Questo può ottenersi più comunemente in laboratorio trattando un cromato (o bicromato) alcalino con acido solforico in presenza di cloruro di sodio o di potassio. In maniera simile può prepararsi il fluoruro di cromile CrO2F2 (analogo al fluoruro di solforile - SO2F2, incolore) dal triossido di cromo e acido fluoridrico, come cristalli di color magenta.[28] In entrambi questi alogenuri allo stato di vapore il cromo è tetraedrico, ma con simmetria C2v.[29]
Usi
modificaIl triossido di cromo è usato come ossidante in chimica organica.[30] Ad esempio, il reattivo di Jones - una soluzione di triossido di cromo in acido solforico e acetone - ossida alcoli primari e secondari rispettivamente ad acidi carbossilici e chetoni.[31]
Il triossido di cromo è utilizzato prevalentemente nelle cromature. In genere è impiegato assieme ad additivi che influenzano il processo di placcatura, ma non reagiscono con il triossido stesso. Il triossido reagisce con cadmio, zinco ed altri metalli per produrre film passivanti di cromato che resistono alla corrosione.
Sicurezza
modificaIl triossido di cromo è molto tossico, corrosivo, carcinogeno e pericoloso per l'ambiente.[32][33] La pericolosità è data dalla presenza del cromo nello stato di ossidazione +6. Gli analoghi composti del Cr(III) non sono particolarmente dannosi; per questo si usano sostanze riducenti per distruggere campioni di Cr(VI).
Il triossido di cromo è un ossidante molto forte, e può incendiare materiale combustibile e sostanze organiche (ad esempio l'etanolo) per semplice contatto. Per decomposizione rilascia ossigeno, aumentando il pericolo di incendio.
La legislazione italiana stabilisce che soluzioni di triossido di cromo sono da considerare tossiche per concentrazioni tra lo 0,25% e il 7%, e molto tossiche per concentrazioni uguali o superiori al 7%.[34]
Note
modifica- ^ scheda dell'ossido cromo (VI) su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Wiberg, Wiberg & Holleman p. 1849
- ^ (EN) PubChem, Chromium Trioxide, su pubchem.ncbi.nlm.nih.gov. URL consultato l'11 luglio 2024.
- ^ (EN) G. Anger et al., Chromium compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a07_067.
- ^ a b N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, pp. 1007-1010, ISBN 0-7506-3365-4.
- ^ (EN) Chromium Trioxide, su organic-chemistry.org. URL consultato l'11 luglio 2024.
- ^ a b (EN) Chromium Trioxide, su chemicalland21.com. URL consultato il 4 novembre 2024.
- ^ Paolo Silvestroni, Fondamenti di Chimica, Roma, LIBRERIA EREDI VIRGILIO VESCHI, 1968, p. 812.
- ^ (EN) chromium trioxide (CHEBI:48240), su ebi.ac.uk. URL consultato l'11 luglio 2024.
- ^ Nella nomenclatura IUPAC il termine anidride indica un composto organico con due gruppi acilici legati allo stesso ossigeno. Vedi: (EN) IUPAC Gold Book - acid anhydrides.
- ^ (EN) M. W. Chase, NIST-JANAF Themochemical Tables, 4ª ed., 1998, pp. 1–1951. URL consultato l'11 luglio 2024.
- ^ a b (EN) Hua-Jin Zhai, Shenggang Li e David A. Dixon, Probing the Electronic and Structural Properties of Chromium Oxide Clusters (CrO3)n − and (CrO3)n (n = 1–5): Photoelectron Spectroscopy and Density Functional Calculations, in Journal of the American Chemical Society, vol. 130, n. 15, 1º aprile 2008, pp. 5167–5177, DOI:10.1021/ja077984d. URL consultato il 4 novembre 2024.
- ^ Wiberg, Wiberg & Holleman p. 1852
- ^ Atkins, Overton e Weller p. 793
- ^ a b c Advanced inorganic chemistry, 6th ed, Wiley, 1999, pp. 751-753, ISBN 978-0-471-19957-1.
- ^ (EN) J. S. Stephens e D. W. J. Cruickshank, The crystal structure of (CrO3)∞, in Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry, vol. 26, n. 3, 31 marzo 1970, pp. 222–226, DOI:10.1107/S0567740870002182. URL consultato l'11 luglio 2024.
- ^ a b c (EN) C.E. Housecroft e A.G. Sharpe, Inorganic chemistry, 2ª ed., Harlow (England), Pearson Education Limited, 2005, ISBN 0-13-039913-2.
- ^ (EN) NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005 (PDF), su iupac.org, p. 295. URL consultato il 4 novembre 2024.
- ^ a b Binnewies, Finze e Jäckel p. 781
- ^ Qui chi si riduce è l'ossigeno dell'acqua ossigenata e chi si ossida non è il cromo, ma l'ossigeno del bicromato.
- ^ Riedel&Janiak p. 841
- ^ Lobbia&Novara p. 253
- ^ Hazardous Substances Data Bank, su toxnet.nlm.nih.gov. URL consultato il 15 dicembre 2010.
- ^ (EN) ALDEHYDES FROM PRIMARY ALCOHOLS BY OXIDATION WITH CHROMIUM TRIOXIDE: HEPTANAL, in Organic Syntheses, vol. 52, 1972, p. 5, DOI:10.15227/orgsyn.052.0005. URL consultato l'11 luglio 2024.
- ^ (EN) Edward R. Lovejoy, David R. Hanson e L. Gregory Huey, Kinetics and Products of the Gas-Phase Reaction of SO 3 with Water, in The Journal of Physical Chemistry, vol. 100, n. 51, 1º gennaio 1996, pp. 19911–19916, DOI:10.1021/jp962414d. URL consultato il 21 luglio 2024.
- ^ (EN) Guochun Lv, Xiaomin Sun e Chenxi Zhang, Understanding the catalytic role of oxalic acid in SO3 hydration to form H2SO4 in the atmosphere, in Atmospheric Chemistry and Physics, vol. 19, n. 5, 4 marzo 2019, pp. 2833–2844, DOI:10.5194/acp-19-2833-2019. URL consultato il 21 luglio 2024.
- ^ (EN) Harry H. Sisler e Logis E. Riarchi, Chromyl Chloride [Chromium(VI) Dioxychloride], vol. 2, 1ª ed., Wiley, gennaio 1946, pp. 205–207, DOI:10.1002/9780470132333.ch63, ISBN 978-0-470-13161-9. URL consultato l'11 luglio 2024.
- ^ (EN) Gary L. Gard e Stanley M. Williamson, Chromium Difluoride Dioxide (Chromyl Fluoride), vol. 24, 1ª ed., Wiley, 1986-01, pp. 67–69, DOI:10.1002/9780470132555.ch20, ISBN 978-0-471-83441-0. URL consultato l'11 luglio 2024.
- ^ (EN) Joanna Supeł, Ulrich Abram e Adelheid Hagenbach, Technetium Fluoride Trioxide, TcO 3 F, Preparation and Properties, in Inorganic Chemistry, vol. 46, n. 14, 1º luglio 2007, pp. 5591–5595, DOI:10.1021/ic070333y. URL consultato l'11 luglio 2024.
- ^ (EN) G. Cainelli e G. Cardillo, Chromium oxidations in organic chemistry (reactivity & structure), Springer, 1984, pp. 264, ISBN 0-387-12834-4.
- ^ (EN) K. Bowden, I.M. Heilbron, E.R.H. Jones e B.C.L. Weedon, 13. Researches on acetylenic compounds. Part I. The preparation of acetylenic ketones by oxidation of acetylenic carbinols and glycols, in J. Chem. Soc., 1946, pp. 39-45, DOI:10.1039/JR9460000039.
- ^ Scheda di sicurezza del triossido di cromo, su jtbaker.com. URL consultato il 15 dicembre 2010 (archiviato dall'url originale l'8 febbraio 2008).
- ^ (EN) Arstan Abdramanovich Mamyrbaev, Timur Agataevich Dzharkenov e Zina Amangalievna Imangazina, Mutagenic and carcinogenic actions of chromium and its compounds, in Environmental Health and Preventive Medicine, vol. 20, n. 3, 1º maggio 2015, pp. 159–167, DOI:10.1007/s12199-015-0458-2. URL consultato l'11 luglio 2024.
- ^ Ministero della salute, DECRETO 28 febbraio 2006. Ventinovesimo adeguamento al progresso tecnico della direttiva 67/548/CEE del Consiglio (direttiva 2004/73/CE della Commissione), concernente la classificazione, imballaggio ed etichettatura delle sostanze pericolose, in Gazzetta Ufficiale, 15 maggio 2006.
Bibliografia
modifica- (DE) Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103ª ed., De Gruyter, 2017, ISBN 978-3-11-026932-1. URL consultato l'11 luglio 2024.
- (EN) P. Atkins, T. Overton e J. Weller, Inorganic Chemistry, 5ª ed., New York, Freeman, 2010, ISBN 978-1-42-921820-7.
- (DE) Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3ª ed., Springer Spektrum, 2016, ISBN 978-3-662-45066-6.
- (DE) Erwin Riedel e Christoph Janiak, Anorganische Chemie, collana De Gruyter Studium, 10ª ed., De Gruyter, 2022, ISBN 978-3-11-069604-2.
- G. Gioia Lobbia e G. Novara, ANALISI QUALITATIVA E COMPLEMENTI DI CHIMICA, Bulgarini, 1988.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file sul Triossido di cromo
