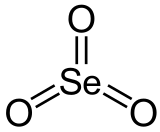
Triossido di selenio
Il triossido di selenio o ossido di selenio(VI) (chiamato anche "anidride selenica"[2][3] in testi meno recenti, in analogia ad anidride solforica) è l'ossido del selenio esavalente avente formula molecolare SeO3, in fase gassosa, e Se4O12 in fase solida. Si tratta di un solido bianco igroscopico e molto avido di acqua con la quale reagisce vigorosamente dando l'acido corrispondente, l'acido selenico H2SeO4.[4] In questo comportamento, e nella sua chimica in genere, il triossido di selenio somiglia molto più all'anidride solforica (SO3), che al suo omologo superiore triossido di tellurio (TeO3), il quale è un solido non molecolare,[5] la cui formula è pertanto solo una formula bruta.
| Triossido di selenio | |
|---|---|
 | |
| Nome IUPAC | |
| triossido di selenio | |
| Nomi alternativi | |
| anidride selenica, ossido di selenio(VI) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SeO3 |
| Massa molecolare (u) | 126,96 |
| Aspetto | solido bianco cristallino igroscopico |
| Numero CAS | Immagine_3D. |
| Numero EINECS | 237-385-1 |
| PubChem | 115128 |
| SMILES | O=[Se](=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,44 |
| Temperatura di fusione | 118 °C (391 K) |
| Temperatura di ebollizione | 165 °C (438 K) (decomposizione) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
Proprietà e struttura
modificaL'anidride selenica è un composto termodinamicamente stabile (ΔHƒ° = −184 kJ/mol),[6] sebbene parecchio meno dell'anidride solforica (-396 kJ/mol).[7] A differenza di quest'ultima, è però termodinamicamente instabile rispetto alla decomposizione nel diossido di selenio (SeO2). Tuttavia, a temperatura ambiente è cineticamente stabile: la decomposizione inizia soltanto sopra, a circa 160 °C (ΔHr° = −46 kJ/mol):[8]
Questo comportamento si inquadra nella tendenza all'instabilità della valenza massima[9] che si nota negli ultimi elementi del 4° periodo,[10] tendenza che il selenio condivide, in particolare, con i suoi vicini a sinistra e a destra, cioè con l'arsenico e specialmente con il bromo. Tale instabilità si manifesta anche nell'acido corrispondente H2SeO4 e nei suoi sali, i selenati, e tutti quanti questi composti sono ossidanti piuttosto forti, E°(SeO42– / SeO32–) = +1,15 V in ambiente acido; per confronto, questo valore è un po' superiore a quello della coppia Br2 / Br – (+1,09 V), ma inferiore a quello della coppia Cl2 / Cl – (+1,395 V).[11]
Allo stato solido questo ossido è formato da molecole discrete Se4O12, o (SeO3)4, ossia il tetramero ciclico di SeO3, che è un ciclo a 8 termini composto da 4 unità −O−Se(=O)2–; in esso il selenio è tetracoordinato e tetraedrico (Se sp3); questa forma somiglia da vicino alla forma γ-SO3 dell'anidride solforica allo stato solido, composta di molecole discrete S3O9, cioè il trimero (SO3)3.[12]
Il solido sublima a 100 °C e 40 mbar e queste molecole, nel passaggio in fase vapore, si dissociano parzialmente in monomeri SeO3, in cui il selenio è tricoordinato e la molecola è planare (Se sp2),[13] con simmetria D3h.[14]
Parametri strutturali
modificaIn questa molecola il legame Se=O è lungo 168,78 pm;[15] per confronto, il legame S=O in SO3 èdi 141,75 pm; la lunghezza maggiore nel caso del selenio è solo in parte giustificata dal fatto che il raggio covalente di Se (120 pm) è maggiore di quello di S (115 pm).[16] Nel solido, invece, le lunghezze dei legami Se–O nel ciclo sono di 175 pm e 181 pm, mentre quelle dei legami Se=O esociclici sono di 154 pm e 156 pm.[17]
Preparazione
modificaSeO3 è uno di quegli ossidi che non si possono preparare per interazione diretta dell'elemento con l'ossigeno molecolare: la reazione di O2 con il selenio porta, in pratica, solo fino al diossido di selenio;[18] questo fatto è un'altra manifestazione della citata riluttanza del selenio ad assumere la massima valenza, e quindi del potere ossidante del selenio esavalente.[10]
Può essere preparato per distillazione a 150-160 °C dell'acido selenico su anidride fosforica[19] la quale, come disidratante, è ancora più avida di acqua; tuttavia, la reazione è lenta.[8]
Può essere più facilmente preparato per azione dell'anidride solforica su un selenato alcalino:[20]
Reattività, analogie e confronti con SO3
modificaCome l'anidride solforica SO3, anche l'anidride selenica SeO3 è avidissima di acqua, e si comporta anch'essa da acido di Lewis. Il primo esempio è già la citata somma di H2O (la base di Lewis) a dare prima l'addotto H2O · SeO3, che poi si riarrangia immediatamente a H2SeO4 per migrazione di un protone.[21][22]
In analogia con SO3, anche SeO3 si scioglie nel suo acido H2SeO4 per dare l'acido piroselenico (diselenico) H2Se2O7 (e anche acidi poliselenici, con SeO3 in maggior quantità), e questo è isostrutturale e isoelettronico di valenza all'acido pirosolforico H2S2O7.[6]
Come la reazione con l'acqua, SeO3 fa una reazione analoga con l'acido fluoridrico liquido, dove si scioglie dando una soluzione limpida, formando l'acido fluoroselenico HSeO3F, del tutto simile all'acido fluorosolforico HSO3F:[19]
L'analoga reazione con acido cloridrico, anche se condotta a bassa temperatura (fino a -30 °C), si risolve invece in un'ossidazione del cloro e conseguente riduzione del Se per dare acido selenioso e questo costituisce ancora un esempio in cui si manifesta il potere ossidante di Se(VI):[23][24]
SeO3 reagisce con l'acido fluorosolforico per dare l'analogo acido fluoroselenico e anidride solforica:[25]
Più classicamente, SeO3 dà addotti con basi di Lewis come piridina e ammine terziarie in genere, ma anche con diossano ed altri eteri;[5] con il dimetil etere forma l'addotto con due molecole: (Me2O)2 • SeO3.[26]
Con ioni ossido provenienti dagli ossidi di metalli alcalini, ne somma una mole e dà direttamente i corrispondenti selenati salini, ad esempio quello di litio:
A differenza dell'anidride solforica, con un eccesso di ossido metallico reagisce sommandone 2 moli:[27]
in questo caso il selenio espande il numero di coordinazione da 4 a 5, con una struttura a bipiramide trigonale per lo ione SeO52–[17] ed è una manifestazione della tendenza all'aumento del numero di coordinazione che si ha scendendo lungo un gruppo (qui, S < Se < Te). L'analoga reazione con l'ossido di sodio porta invece a Na4SeO5, dove il selenio è ugualmente pentacoordinato, ma qui la struttura dello ione SeO52– è una piramide a base quadrata.[28]
Questo è uno dei diversi casi in cui si manifesta la quasi parità energetica tra la bipiramide trigonale e la piramide a base quadrata, due geometrie di pentacoordinazione in competizione e facilmente intercambiabili.[29]
Come reagisce con gli ossidi metallici, SeO3 reagisce anche con i loro fluoruri in soluzione di SO2 liquida (-25 °C) dando i fluoroselenati corrispondenti; con i fluoruri dei metalli alcalini (M = Li, Na, K, Rb, Cs) la reazione è:[20]
Questi fluoroselenati non risultano essere isostrutturali con i corrispondenti fluorosolfati, sono meno stabili termicamente e, inoltre, in acqua si decompongono.[20]
SeO3 reagisce con il tetrafluoruro di selenio fornendo il fluoruro di selenoile, analogo al fluoruro di solforile SO2F2, e biossido di selenio:[20]
Note
modifica- ^ Scheda del composto su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Stefano Masiero, Glossario di Chimica, Alpha Test, 2010.
- ^ DIZIONARIO ITALIANO OLIVETTI, su dizionario-italiano.it. URL consultato il 12 agosto 2022.
- ^ (DE) Erwin Riedel e Christoph Janiak, Anorganische Chemie, collana De Gruyter Studium, 10. Auflage, De Gruyter, 2022, p. 491, ISBN 978-3-11-069604-2.
- ^ a b (EN) Nils Wiberg, Egon Wiberg e Arnold Frederick Holleman, Inorganic Chemistry, Elsevier, 2001, ISBN 0123526515.
- ^ a b (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 780, ISBN 0-7506-3365-4.
- ^ (EN) M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 29 novembre 2023.
- ^ a b (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, pp. 780.-781, ISBN 0-7506-3365-4.
- ^ Cioè, quella valenza che coinvolge l'impiego nei legami della coppia elettronica 4s2.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi Strutture Reattività, Piccin, 1999, p. 912, ISBN 88-299-1470-3.
- ^ (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 804., ISBN 0-7506-3365-4.
- ^ (EN) Norman Neill Greenwood e Alan Earnshaw, Chemistry of the elements, 2ª ed., Butterworth-Heinemann, 1997, p. 703, ISBN 978-0-7506-3365-9.
- ^ SeO3, selenium trioxide, su colby.edu.
- ^ (EN) CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato l'8 giugno 2022.
- ^ (EN) N. J. Brassington, H. G. M. Edwards, D. A. Long e M. Skinner, The pure rotational Raman spectrum of SeO3, in Journal of Raman Spectroscopy, vol. 7, n. 3, 1978, pp. 158–160, DOI:10.1002/jrs.1250070310, ISSN 0377-0486.
- ^ (EN) Beatriz Cordero, Verónica Gómez e Ana E. Platero-Prats, Covalent radii revisited, in Dalton Transactions, n. 21, 14 maggio 2008, pp. 2832–2838, DOI:10.1039/B801115J. URL consultato il 29 novembre 2023.
- ^ a b (EN) Francesco A. Devillanova, Handbook of Chalcogen Chemistry: New Perspectives in Sulfur, Selenium and Tellurium, Royal Society of Chemistry, 2007, ISBN 978-08-540-4366-8.
- ^ (EN) Egon Wiberg e Arnold Frederick Holleman, Inorganic Chemistry, Elsevier, 2001, ISBN 0123526515.
- ^ a b F. A. Cotton e G. Wilkinson, Chimica Inorganica, 2ª ed., 1974, p. 496.
- ^ a b c d (EN) A. J. Edwards, M. A. Mouty e R. D. Peacock, The monofluoroselenates(VI), in Journal of the Chemical Society A: Inorganic, Physical, Theoretical, n. 0, 1º gennaio 1967, pp. 557–560, DOI:10.1039/J19670000557. URL consultato il 12 agosto 2022.
- ^ (EN) Edward R. Lovejoy, David R. Hanson e L. Gregory Huey, Kinetics and Products of the Gas-Phase Reaction of SO 3 with Water, in The Journal of Physical Chemistry, vol. 100, n. 51, 1º gennaio 1996, pp. 19911–19916, DOI:10.1021/jp962414d. URL consultato il 21 luglio 2024.
- ^ (EN) Guochun Lv, Xiaomin Sun e Chenxi Zhang, Understanding the catalytic role of oxalic acid in SO3; hydration to form H2SO4; in the atmosphere, in Atmospheric Chemistry and Physics, vol. 19, n. 5, 4 marzo 2019, pp. 2833–2844, DOI:10.5194/acp-19-2833-2019. URL consultato il 4 novembre 2024.
- ^ (EN) Max Schmidt e Irmgard Wilhelm, Chloroselensäure, in Chemische Berichte, vol. 97, n. 3, marzo 1964, pp. 876–879, DOI:10.1002/cber.19640970335. URL consultato il 12 agosto 2022.
- ^ (DE) A. F. Holleman, E. Wiberg e N. Wiberg, Anorganische Chemie, 103ª ed., DE GRUYTER, 2017, p. 722, ISBN 978-3-11-026932-1.
- ^ (EN) J. J. Zuckerman (a cura di), Inorganic Reactions and Methods, vol. 3, Wiley - VCH, 1989, p. 112, ISBN 0-471-18656-2.
- ^ (DE) L. Richtera, J. Taraba e Jiří Touzžín, The Reaction of Selenium Trioxide with Dialkyl Ethers, in Zeitschrift für anorganische und allgemeine Chemie, vol. 629, n. 4, aprile 2003, pp. 716–721, DOI:10.1002/zaac.200390121. URL consultato l'11 agosto 2022.
- ^ (DE) H. Haas e M. Jansen, Synthese und Charakterisierung von Tetralithiumpentaoxoselenat(VI), in Z. anorg. allg. Chem., 626: 1174-1178, 2000, DOI:10.1002/(SICI)1521-3749(200005)626:5<1174::AID-ZAAC1174>3.0.CO;2-R.
- ^ (DE) H. Haas e M. Jansen, <755::AID-ZAAC755>3.0.CO;2-L Na4SeO5, ein neues Pentaoxoselenat(VI) – Synthese, Charakterisierung und Vergleich mit isotypem Na4MoO5, Wiley, 2001, DOI:10.1002/1521-3749(200104)627:4<755::AID-ZAAC755>3.0.CO;2-L.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 499-505, ISBN 88-299-1470-3.
Bibliografia
modifica- I. Bertini e F. Mani, Chimica Inorganica, CEDAM, ISBN 88-13-16199-9.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file sul triossido di selenio