Cicloaddizione di Huisgen azide-alchino
La cicloaddizione di Huisgen azide-alchino è una cicloaddizione 1,3-dipolare tra una azide e un alchino terminale, o interno, per formare un 1,2,3-triazolo. Il primo a capire l'importanza di questa reazione organica fu il chimico tedesco Rolf Huisgen[1]. Il chimico statunitense Barry Sharpless ha considerato questa cicloaddizione come un esempio perfetto di click chemistry.[2]
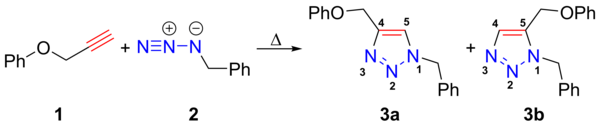
Nella reazione precedente[3] l'azide 2 reagisce efficientemente a 98 °C con l'alchino 1 per formare in 18 ore il triazolo 3 come miscela dei due composti 1,4 (3a) e 1,5 (3b).
La cicloaddizione 1,3 standard tra una azide 1,3-dipolare e un alchene dipolarofilo è stata largamente ignorata data la mancanza di reattività dovuta a olefine povere di elettroni e a reazioni secondarie di eliminazione. Si è ottenuto qualche successo con cicloaddizioni catalizzate senza metalli, come le reazioni fatte usando dipolarofili tipo olefine povere di elettroni[4] o alchini.
Le azidi non sono gli 1,3-dipoli più reattivi per questa reazione, ma sono preferite perché non danno reazioni collaterali e sono stabili nelle usuali condizioni di sintesi.
Catalisi con rame
modificaUna variante notevole della cicloaddizione 1,3-dipolare di Huisgen è quella catalizzata da rame(I), che fu descritta nel 2002 indipendentemente da Morten Meldal del Laboratorio Carlsberg in Danimarca[5] e da Valery Fokin e Barry Sharpless dello Scripps Research Institute.[6] Anche se la variante catalizzata da rame(I) forma un triazolo partendo da un alchino terminale e una azide, formalmente non è una cicloaddizione 1,3-dipolare, e quindi non dovrebbe essere chiamata cicloaddizione di Huisgen. Una denominazione più corretta è cicloaddizione azide-alchino catalizzata da rame(I), in breve CuAAC, usando l'acronimo inglese Copper(I)-catalyzed Azide-Alkyne Cycloaddition.
La reazione si può condurre usando fonti commerciali di rame(I) come bromuro o ioduro di rame(I), ma la reazione funziona molto meglio usando una miscela di un composto di rame(II) (ad esempio il solfato di rame) e un agente riducente (ad esempio l'ascorbato di sodio) in modo da produrre Cu(I) in situ. Dato che il Cu(I) è instabile in solventi acquosi, per migliorare la resa della reazione si usano leganti stabilizzanti come la tris-(benziltriazolilmetil)ammina (TBTA). La reazione può essere condotta in vari solventi e miscele tra acqua e altri solventi organici (parzialmente) miscibili tipo alcoli, DMSO, DMF, t-BuOH e acetone. L'acetonitrile va invece evitato come solvente, perché i nitrili coordinano molto efficacemente il Cu(I). Non è essenziale che i reagenti iniziali siano completamente solubili perché la reazione funzioni. In molti casi il prodotto può essere semplicemente filtrato dalla soluzione e non sono necessarie altre purificazioni.
L'utilità di questa reazione di click chemistry catalizzata con Cu(I) è stata dimostrata anche nella reazione di polimerizzazione di una bis-azide e un bis-alchino per formare un polimero a base di fluorene coniugato.[7] Il grado di polimerizzazione può superare facilmente 50. Con una molecola terminale come la fenilazide si possono facilmente ottenere gruppi terminali fenile.
La CuAAC trova svariati usi nella scienza dei materiali e delle superfici.[8] Sono state investigate molte varianti accoppiando polimeri con altri polimeri o piccole molecole. Tramite la CuAAC si può anche accoppiare il polistirene con l'albumina di siero bovino (BSA), ottenendo un bioibrido anfifilico.[9]
Meccanismo
modificaIl meccanismo della reazione è stato suggerito sulla base di calcoli di teoria del funzionale della densità (DFT).[10] Il rame è un metallo della prima serie di transizione, e ha configurazione elettronica [Ar] 3d10 4s1. La specie di Cu(I) generata in situ si lega al triplo legame dell'alchino terminale con un legame π. In presenza di una base l'idrogeno terminale, essendo il più acido, viene perso e si forma un intermedio Cu-acetiluro. Si è visto che la reazione è di secondo ordine rispetto al Cu. È stato suggerito che lo stato di transizione coinvolga due atomi di rame. I leganti L utilizzati sul rame sono labili e poco coordinanti. L'azide sposta un legante L e si forma un complesso rame-azide-acetiluro, dove azide e acetiluro sono coordinati ad atomi diversi di rame. Un atomo di rame è legato all'acetiluro, mentre il secondo serve ad attivare l'azide, coordinandosi con gli elettroni dell'atomo di azoto. A questo punto avviene la ciclizzazione, seguita da protonazione; il protone proviene dall'idrogeno che la base aveva tolto inizialmente dall'acetilene terminale. Infine il prodotto finale viene dissociato e il complesso catalizzatore è pronto per un altro ciclo di reazione.
La reazione è assistita dal rame, che coordinandosi all'alchino abbassa di 9,8 unità il pKa del legame C-H dell'alchino. Di conseguenza in appropriate condizioni la reazione può procedere anche in assenza di basi. Nella reazione non catalizzata l'alchino è scarsamente elettrofilo, e quindi ci sono barriere energetiche elevate che rallentano la reazione.[11]
Ruolo dei leganti
modificaI leganti L utilizzati sul complesso di rame sono in genere labili, cioè possono essere facilmente sostituiti. I leganti non hanno un ruolo diretto nella reazione, ma la loro presenza è comunque importante: servono a proteggere lo ione Cu(I) da reazioni di ossidazione o degradazione e servono a evitare la formazione di prodotti collaterali. I leganti possono inoltre fungere da accettori di protoni eliminando così la necessità di utilizzare altre basi.[12]
Catalisi con rutenio
modificaLa cicloaddizione 1,3 dipolare azide-alchino catalizzata da rutenio (RuAAC) porta ai 1,5-triazoli. A differenza della CuAAC dove reagiscono solo gli alchini terminali, nella RuAAC possono reagire alchini sia terminali che interni. Questo suggerisce che nel ciclo catalitico non siano coinvolti acetiluri di rutenio.
Meccanismo
modificaIl meccanismo proposto prevede che in un primo processo i leganti L del complesso siano rilasciati per formare un complesso attivato contenente l'alchino e l'azide. Segue quindi un accoppiamento ossidativo tra azide e alchino per formare una struttura ciclica comprendente anche il rutenio (rutenaciclo). Il nuovo legame C-N si forma tra il carbonio più elettronegativo e meno stericamente impedito dell'alchino e l'azoto terminale dell'azide. L'intermedio rutenaciclo dà quindi eliminazione riduttiva rilasciando come prodotto il triazolo aromatico e rigenerando il catalizzatore per un ciclo successivo.
Come catalizzatori si utilizzano comunemente Cp*RuCl(PPh3)2, Cp*Ru(COD) e Cp*[RuCl4]. Sono usati anche catalizzatori contenenti ciclopentadienile (Cp), ma i risultati migliori si ottengono con il legante pentametilciclopentadienile (Cp*). Questo potrebbe essere dovuto al maggior ingombro sterico del legante Cp* che facilita il rilascio dei leganti L.[13][14]
Note
modifica- ^ Huisgen 1961
- ^ Kolb et al. 2001
- ^ Development and Applications of Click Chemistry Gregory C. Patton, 8 November 2004, http://www.scs.uiuc.edu Online[collegamento interrotto]
- ^ Amantini et al. 2005
- ^ Tornøe et al. 2002
- ^ Rostovtsev et al. 2002
- ^ van Steenis et al. 2005
- ^ Evans 2007
- ^ Dirks et al. 2005
- ^ Himo et al. 2005
- ^ Bock et al. 2006
- ^ Rodionov et al. 2007
- ^ Zhang et al. 2005
- ^ Boren et al. 2008
Bibliografia
modifica- D. Amantini, F. Fringuelli, O. Piermatti, F. Pizzo, E. Zunino e L. Vaccaro, Synthesis of 4-Aryl-1H-1,2,3-triazoles through TBAF-Catalyzed [3 + 2] Cycloaddition of 2-Aryl-1-nitroethenes with TMSN3 under Solvent-Free Conditions, in J. Org. Chem., vol. 70, n. 16, 2005, pp. 6526–6529, DOI:10.1021/jo0507845. URL consultato il 18 novembre 2011.
- V. D. Bock, H. Hiemstra e J. H. van Maarseveen, CuI-Catalyzed Alkyne–Azide “Click” Cycloadditions from a Mechanistic and Synthetic Perspective, in Eur. J. Org. Chem., n. 1, 2006, pp. 51-68, DOI:10.1002/ejoc.200500483. URL consultato il 18 novembre 2011.
- B. C. Boren, S. Narayan, L. K. Rasmussen, L. Zhang, H. Zhao, Z. Lin, G. Jia e V. V. Fokin, Ruthenium-Catalyzed Azide−Alkyne Cycloaddition: Scope and Mechanism, in J. Am. Chem. Soc., vol. 130, n. 28, 2008, pp. 8923–8930, DOI:10.1021/ja0749993. URL consultato il 18 novembre 2011.
- A. J. Dirks, S. S. van Berkel, N. S. Hatzakis, J. A. Opsteen, F. L. van Delft, J. J. L. M. Cornelissen, A. E. Rowan, J. C. M. van Hest, F. P. J. T. Rutjes e R. J. M. Nolte, Preparation of biohybrid amphiphiles via the copper catalysed Huisgen [3 + 2] dipolar cycloaddition reaction, in Chem. Commun., 2005, pp. 4172-4174, DOI:10.1039/B508428H. URL consultato il 18 novembre 2011.
- R. A. Evans, The Rise of Azide–Alkyne 1,3-Dipolar ‘Click’ Cycloaddition and its Application to Polymer Science and Surface Modification, in Austr. J. Chem., vol. 60, n. 6, 2007, pp. 384-395, DOI:10.1071/CH06457. URL consultato il 18 novembre 2011.
- F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless e V. V. Fokin, Copper(I)-Catalyzed Synthesis of Azoles. DFT Study Predicts Unprecedented Reactivity and Intermediates, in J. Am. Chem. Soc., vol. 127, n. 1, 2005, pp. 210–216, DOI:10.1021/ja0471525. URL consultato il 18 novembre 2011.
- R. Huisgen, Centenary Lecture - 1,3-Dipolar Cycloadditions, in Proc. Chem. Soc., 1961, pp. 357-396, DOI:10.1039/PS9610000357. URL consultato il 18 novembre 2011.
- H. C. Kolb, M. G. Finn, K. B. Sharpless, <2004::AID-ANIE2004>3.0.CO;2-5 Click Chemistry: Diverse Chemical Function from a Few Good Reactions, in Angew. Chem. Int. Ed., vol. 40, n. 11, 2001, pp. 2004 ± 2021, DOI:10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5. URL consultato il 10 ottobre 2011.
- V. O. Rodionov, S. I. Presolski, D. D. Díaz, V. V. Fokin e M. G. Finn, Ligand-Accelerated Cu-Catalyzed Azide−Alkyne Cycloaddition: A Mechanistic Report, in J. Am. Chem. Soc., vol. 129, n. 42, 2007, pp. 12705–12712, DOI:10.1021/ja072679d. URL consultato il 18 novembre 2011.
- V. V. Rostovtsev, L. G. Green, V. V. Fokin e K. B. Sharpless, <2596::AID-ANIE2596>3.0.CO;2-4 A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective Ligation of Azides and Terminal Alkynes, in Angew. Chem. Int. Ed., vol. 41, n. 4, 2002, pp. 2596-2599, DOI:10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4. URL consultato il 18 novembre 2011.
- C. W. Tornøe, C. Christensen e M. Meldal, Peptidotriazoles on Solid Phase: [1,2,3]-Triazoles by Regiospecific Copper(I)-Catalyzed 1,3-Dipolar Cycloadditions of Terminal Alkynes to Azides, in J. Org. Chem., vol. 67, n. 9, 2002, pp. 3057–3064, DOI:10.1021/jo011148j. URL consultato il 18 novembre 2011.
- D. J. V. C. van Steenis, O. R. P. David, G. P. F. van Strijdonck, J. H. van Maarseveen e J. N. H. Reek, Click-chemistry as an efficient synthetic tool for the preparation of novel conjugated polymers, in Chem. Commun., 2005, pp. 4333-4335, DOI:10.1039/B507776A. URL consultato il 18 novembre 2011.
- L. Zhang, X. Chen, P. Xue, H. H. Y. Sun, I. D. Williams, K. B. Sharpless, V. V. Fokin e G. Jia, Ruthenium-Catalyzed Cycloaddition of Alkynes and Organic Azides, in J. Am. Chem. Soc., vol. 127, n. 46, 2005, pp. 15998–15999, DOI:10.1021/ja054114s. URL consultato il 18 novembre 2011.