Diene di Danishefsky
Il diene di Danishefsky (conosciuto anche come "diene di Kitahara") è un composto di organosilicio col nome formale di trans-1-metossi-3-trimetilsililossi-1,3-butadiene e prende il nome dal chimico Samuel J. Danishefsky.[1][2] Essendo un diene molto elettron ricco è un reagente versatile e molto reattivo nella reazione di Diels-Alder. Reagisce infatti rapidamente con alcheni elettrofili, come l'anidride maleica, e il gruppo metossi al suo interno promuove addizioni molto regioselettive. Si conosce la sua reattività con ammine,[3] aldeidi, alcheni e alchini.[2] Le sue reazione con immine[4] e nitro alcheni[5] sono state parimenti riportate in letteratura.
| Diene di Danishefsky | |
|---|---|
 | |
| Nome IUPAC | |
| trans-1-metossi-3-trimetilsililossi-1,3-butadiene | |
| Nomi alternativi | |
| Diene di Kitahara
(E)-1-metossi-3-trimetilsilil-1,3-butadiene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H16O2Si |
| Massa molecolare (u) | 172,30 g/mol |
| Numero CAS | |
| Numero EINECS | 629-035-5 |
| PubChem | 5366448 |
| SMILES | COC=CC(=C)O[Si](C)(C)C |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 0,89 (a 20 °C) |
| Temperatura di ebollizione | 68-69 °C a 0.0189 kPa |
| Indicazioni di sicurezza | |
| Frasi R | - |
| Frasi S | S23, S24/25 |
Venne sintetizzato per la prima volta per reazione tra trimetilsilil cloruro e 4-metossi-3-buten-2-one e cloruro di zinco, quindi è stato fatto reagire con l'anidride maleica:[6]
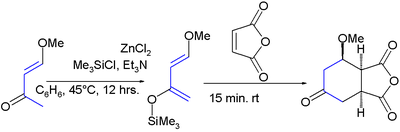
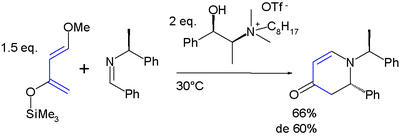
Questo diene ha due aspetti interessanti: i sostituenti promuovono addizione regiospecifica verso dienofili asimmetrici e l'addotto risultante è favorevole a ulteriori manipolazioni dei gruppi funzionali presenti. Tipicamente si ottiene un'alta regioselettività per reazione con alcheni asimmetrici evidenziando una forte preferenza per la relazione 1,2 tra il gruppo metossi e il carbonio più elettron-povero dell'alchene, come in questo esempio di reazione Aza-Diels-Alder con un'immina:[7][8]
In questa reazione il metossi viene eliminato portando alla formazione di un chetone α,β-insaturo. Si può considerare quindi che il silil etere sia un sintone per il gruppo carbonilico.
Sono state riportate molte applicazioni nella sintesi asimmetrica.[9][10][11][12][13][14][15][16][17][18][19][20]
Viene inoltre riportato l'uso di derivati fluorinati.[21]
Note
modifica- ^ Samuel J. Danishefsky, Kitahara, T, Useful diene for the Diels-Alder reaction, in J. Am. Chem. Soc., vol. 96, 1974, p. 7807-7808, DOI:10.1021/ja00832a031.
- ^ a b Laszlo Kurti,Barbara Czako, Strategic Applications of Named Reactions in Organic Synthesis, in Elsevier, 2005.
- ^ Yu Yuan, Xin Li e Kuiling Ding, Acid-Free Aza Diels−Alder Reaction of Danishefsky's Diene with Imines, in Organic Letters, vol. 4, n. 19, 1º settembre 2002, pp. 3309–3311, DOI:10.1021/ol0265822. URL consultato il 6 giugno 2016.
- ^ (EN) Catherine Loncaric, Kei Manabe e Shū Kobayashi, Alkaline salt-catalyzed aza Diels–Alder reactions of Danishefsky’s diene with imines in water under neutral conditions, in Chemical Communications, n. 5, 20 febbraio 2003, pp. 574–575, DOI:10.1039/b300880k. URL consultato il 6 giugno 2016.
- ^ (EN) Manabu Node, Kiyoharu Nishide e Hitoshi Imazato, Exo selective Diels–Alder reaction of nitroolefins with Danishefsky's diene, in Chem. Commun., n. 22, 1º gennaio 1996, pp. 2559–2560, DOI:10.1039/cc9960002559. URL consultato il 6 giugno 2016.
- ^ Preparation and Diels-Alder Reaction of a Highly Nuclerophilic Diene., in Org. Synth., Coll, vol. 61, 1990, p. 147.
- ^ Asymmetric aza-Diels-Alder reaction of Danishefsky's diene with imines in a chiral reaction medium Pegot B, Nguyen Van Buu O, Gori D, Vo-Thanh G Beilstein Journal of Organic Chemistry, 2006 Link Archiviato l'11 ottobre 2006 in Internet Archive.
- ^ Questo è un esempio di sintesi asimmetrica con un liquido ionico chirale come solvente. La resa riportata è del 66% con un 60% di eccesso diastereisomerico.
- ^ null Simonsen, null Svenstrup e null Roberson, Development of an unusually highly enantioselective hetero-Diels-Alder reaction of benzaldehyde with activated dienes catalyzed by hypercoordinating chiral aluminum complexes, in Chemistry (Weinheim an Der Bergstrasse, Germany), vol. 6, n. 1, 1º gennaio 2000, pp. 123–128. URL consultato il 6 giugno 2016.
- ^ null Yao, null Saaby e null Hazell, Catalytic enantioselective aza-Diels-alder reactions of imines--an approach to optically active nonproteinogenic alpha-amino acids, in Chemistry (Weinheim an Der Bergstrasse, Germany), vol. 6, n. 13, 3 luglio 2000, pp. 2435–2448. URL consultato il 6 giugno 2016.
- ^ G. Han, M. G. LaPorte e J. J. Folmer, Total syntheses of the Securinega alkaloids (+)-14,15-dihydronorsecurinine, (-)-norsecurinine, and phyllanthine, in The Journal of Organic Chemistry, vol. 65, n. 20, 6 ottobre 2000, pp. 6293–6306. URL consultato il 6 giugno 2016.
- ^ J. M. Janey, T. Iwama e S. A. Kozmin, Racemic and asymmetric Diels-Alder reactions of 1-(2-oxazolidinon-3-yl)-3-siloxy-1,3-butadienes, in The Journal of Organic Chemistry, vol. 65, n. 26, 29 dicembre 2000, pp. 9059–9068. URL consultato il 6 giugno 2016.
- ^ Patrick Bernardelli, Oscar M. Moradei e Dirk Friedrich, Total Asymmetric Synthesis of the Putative Structure of the Cytotoxic Diterpenoid (−)-Sclerophytin A and of the Authentic Natural Sclerophytins A and B, in Journal of the American Chemical Society, vol. 123, n. 37, 1º settembre 2001, pp. 9021–9032, DOI:10.1021/ja011285y. URL consultato il 6 giugno 2016.
- ^ Jing Wang, Jordi Morral e Chris Hendrix, A Straightforward Stereoselective Synthesis of d- and l-5-Hydroxy-4-hydroxymethyl-2-cyclohexenylguanine, in The Journal of Organic Chemistry, vol. 66, n. 25, 1º dicembre 2001, pp. 8478–8482, DOI:10.1021/jo015924z. URL consultato il 6 giugno 2016.
- ^ Yasuhiro Yamashita, Susumu Saito e Haruro Ishitani, Chiral Hetero Diels−Alder Products by Enantioselective and Diastereoselective Zirconium Catalysis. Scope, Limitation, Mechanism, and Application to the Concise Synthesis of (+)-Prelactone C and (+)-9-Deoxygoniopypyrone, in Journal of the American Chemical Society, vol. 125, n. 13, 1º aprile 2003, pp. 3793–3798, DOI:10.1021/ja028186k. URL consultato il 6 giugno 2016.
- ^ Haifeng Du e Kuiling Ding, Enantioselective Catalysis of Hetero Diels−Alder Reaction and Diethylzinc Addition Using a Single Catalyst, in Organic Letters, vol. 5, n. 7, 1º aprile 2003, pp. 1091–1093, DOI:10.1021/ol034143c. URL consultato il 6 giugno 2016.
- ^ Arun K. Ghosh, Packiarajan Mathivanan e John Cappiello, Asymmetric hetero Diels-Alder reactions of Danishefsky's diene and glyoxylate esters catalyzed by chiral bisoxazoline derived catalysts, in Tetrahedron: Asymmetry, vol. 7, n. 8, 1º agosto 1996, pp. 2165–2168, DOI:10.1016/0957-4166(96)00261-3. URL consultato il 6 giugno 2016.
- ^ Bei Zhao e Teck-Peng Loh, Asymmetric Hetero-Diels–Alder Reaction of Danishefsky’s Dienes with α-Carbonyl Esters Catalyzed by an Indium(III)–PyBox Complex, in Organic Letters, vol. 15, n. 12, 21 giugno 2013, pp. 2914–2917, DOI:10.1021/ol400841s. URL consultato il 6 giugno 2016.
- ^ Bin Wang, Xiaoming Feng e Yaozong Huang, A Highly Enantioselective Hetero-Diels−Alder Reaction of Aldehydes with Danishefsky's Diene Catalyzed by Chiral Titanium(IV) 5,5‘,6,6‘,7,7‘,8,8‘-Octahydro-1,1‘-bi-2-naphthol Complexes, in The Journal of Organic Chemistry, vol. 67, n. 7, 1º aprile 2002, pp. 2175–2182, DOI:10.1021/jo016240u. URL consultato il 6 giugno 2016.
- ^ (EN) Jianfeng Zheng, Lili Lin e Kai Fu, Asymmetric Hetero-Diels–Alder Reaction of Danishefsky’s Diene with α-Ketoesters and Isatins Catalyzed by a Chiral N,N′-Dioxide/Magnesium(II) Complex, in Chemistry – A European Journal, vol. 20, n. 44, 27 ottobre 2014, pp. 14493–14498, DOI:10.1002/chem.201404144. URL consultato il 6 giugno 2016.
- ^ Hideki Amii, Takeshi Kobayashi e Hiroshi Terasawa, Difluorinated Danishefsky's Diene: A Versatile C4 Building Block for the Fluorinated Six-Membered Rings, in Organic Letters, vol. 3, n. 20, 1º ottobre 2001, pp. 3103–3105, DOI:10.1021/ol0163631. URL consultato il 6 giugno 2016.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Diene di Danishefsky