Esametilfosforammide
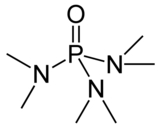
L'esametilfosforammide, spesso indicata con la sigla HMPA (derivante dall'inglese Hexamethylphosphoramide), è la triammide dell'acido fosforico dove tutti gli atomi di idrogeno sono sostituiti da gruppi metilici. La sua formula semistrutturale è quindi [(CH3)2N]3P=O o (Me2N)3P=O. A temperatura ambiente si presenta come un liquido incolore altobollente, fortemente igroscopico e solubile in acqua in ogni proporzione. È sospettata di essere carcinogenica e mutagenica.[3][4] Per tali motivi, pur essendo un ottimo solvente polare aprotico viene solo a volte impiegata come come tale o come reattivo nella sintesi organica.[5]
| Esametilfosforammide | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| esametilfosforammide | |
| Abbreviazioni | |
| HMPA | |
| Nomi alternativi | |
| triammide esametilfosforica esametilfosfammide ossido di tris(dimetilammino)fosfina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H18N3OP |
| Massa molecolare (u) | 179,20 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 211-653-8 |
| PubChem | 12679 |
| SMILES | CN(C)P(=O)(N(C)C)N(C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,024 |
| Indice di rifrazione | 1,45792 (20 °C) |
| Solubilità in acqua | completamente miscibile |
| Coefficiente di ripartizione 1-ottanolo/acqua | 0,28 |
| Temperatura di fusione | 7,2 °C (280,35 K) |
| Temperatura di ebollizione | 233 °C (506,15 K) |
| Tensione di vapore (Pa) a 298,15 K | 9 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 2.650 (orale, ratto) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 105 °C (378,15 K) |
| Temperatura di autoignizione | 230 °C (503,15 K) |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 350 - 340 [1] |
| Consigli P | 201 - 308+313 [2] |
Sintesi
modificaL'esametilfosforammide può essere preparata dalla reazione del cloruro di fosforile (ossicloruro di fosforo) con la dimetilammina:[6]
OPCl3 + 3 HN(CH3)2 → OP[N(CH3)2]3 + 3 HCl
Struttura e reattività
modificaLa molecola dell''esametilfosforammide può essere vista come derivante dall'unione del gruppo fosforile[7] (≡P=O ↔ ≡P+−O−), residuo trivalente molto polare dell'acido fosforico,[8] con tre gruppi dimetilamminici -N(CH3)2, andando così a costituire la struttura di una triammide dell'acido fosforico. Nella molecola l'atomo di fosforo è tetraedrico (ibrido sp3) come in altri derivati dell'acido fosforico. I gruppi amminici legati al fosforile, hanno una coppia solitaria su ciascun azoto; questo permette la presenza di altre tre forme di risonanza, identiche tra loro, del tipo:
>N−P=O ↔ >N+=P−O−
In tal modo aumenta il carattere polare dell'intera molecola, con l'ossigeno che acquisisce una significativa carica parziale negativa: il momento dipolare che ne risulta per la molecola è decisamente alto e ammonta a 5,54 D.[9] La carica negativa sull'atomo di ossigeno lo fa divenire un centro basico, sia nel senso di Brønsted, che in quello di Lewis. D'altra parte, l'esametilfosforammide rappresenta anche l'ossido della tris(dimetilammino)fosfina P(NMe2)3, che è già notevolmente basica. Inoltre, l'esametilfosforammide oltre ad essere molto polare, come solvente ha anche un'alta costante dielettrica: εr = 30,00 (20 °C);[10] questo fa sì che possa sciogliere anche alcuni sali.[11]
Similmente ad altri composti che contengono un legame azoto-fosforo l'esametilfosforammide viene idrolizzata dall'acido cloridrico acquoso formando il cloruro di dimetilammonio e acido fosforico.[12]
Per riscaldamento con le ammidi carbossiliche secondarie (o anche con le alchilarilchetossime) l'esametilfosforammide reagisce fornendo le corrispondenti ammidine:[13]
(Me2N)3P=O + RC(=O)NHR1 → → RC(=NR1)NMe2
Applicazioni
modificaL'HMPA è utilizzata come solvente per polimeri, gas e composti organometallici. Migliora la selettività delle reazioni di litiazione scindendo gli oligomeri dei composti organolitio (metillitio, butillitio). Data la sua natura aprotica, l'esametilfosforammide solvata selettivamente i cationi, lasciando gli anioni presenti in soluzione molto poco solvatati e quindi più parecchio più reattivi che in solventi protici; questo gli permette di accelerare le reazioni SN2, in particolare alcune più difficoltose. L'atomo di ossigeno nell'HMPA, in quanto notevole base di Lewis, coordina efficacemente il catione Li+.[14] L'esametilfosforammide funge da ligando in uno dei complessi perossidici del molibdeno [(O2)2MoO·HMPA·H2O] che viene utilizzato come ossidante nella sintesi organica.[15]
Reagenti alternativi
modificaIl dimetilsolfossido e la N,N-dimetilformammide possono essere spesso utilizzati come solventi in sostituzione dell'HMPA.[16] Sono entrambi forti accettori di legame idrogeno, e i loro atomi di ossigeno legano i cationi metallici. Altre alternative all'HMPA includono le tetraalchiluree,[17] le alchiluree cicliche come DMPU[18] e la chinuclidina N-ossido.[19]
Tossicità
modificaL'esametilfosforammide è tossica ed è stata dimostrata in grado di indurre il cancro nasale nei ratti.[14] L'HMPA può essere degradata a composti meno tossici per azione dell'acido cloridrico.
Note
modifica- ^ Scheda IFA-GESTIS, su gestis-en.itrust.de. URL consultato il 16 ottobre 2014 (archiviato dall'url originale l'11 novembre 2016).
- ^ Sigma Aldrich; rev. del 18.12.2014
- ^ (EN) PubChem, Hexamethylphosphoramide, su pubchem.ncbi.nlm.nih.gov. URL consultato il 12 maggio 2024.
- ^ (EN) Chi -Chu Lo e Pei -Min Chao, Replacement of carcinogenic solvent HMPA by DMI in insect sex pheromone synthesis, in Journal of Chemical Ecology, vol. 16, n. 12, 1º dicembre 1990, pp. 3245–3253, DOI:10.1007/BF00982095. URL consultato il 12 maggio 2024.
- ^ (EN) Robert R. Dykstra, Hexamethylphosphoric Triamide, John Wiley & Sons, Ltd, 15 aprile 2001, DOI:10.1002/047084289x.rh020, ISBN 978-0-471-93623-7. URL consultato il 12 maggio 2024.
- ^ (EN) B. B. Pavankumar, E. Veerashekhar Goud e R. Selvakumar, Function of substituents in coordination behaviour, thermolysis and ligand crossover reactions of phosphine oxides, in RSC Advances, vol. 5, n. 7, 15 dicembre 2014, pp. 4727–4736, DOI:10.1039/C4RA13645D. URL consultato il 12 maggio 2024.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 901-907, ISBN 88-299-1470-3.
- ^ fosforile in Vocabolario - Treccani, su treccani.it. URL consultato il 2 settembre 2021.
- ^ hexamethylphosphoramide, su www.stenutz.eu. URL consultato il 12 maggio 2024.
- ^ (EN) Hexamethylphosphoramide | 680-31-9, su ChemicalBook. URL consultato il 12 maggio 2024.
- ^ HEXAMETHYLPHOSPHORAMIDE: PURIFICATION AND TESTS FOR PURITY, su c. URL consultato il 12 maggio 2024 (archiviato dall'url originale il 12 agosto 2013).
- ^ (EN) Hexamethylphosphoramide, su www.chemeurope.com. URL consultato il 12 maggio 2024.
- ^ Willi Kantlehner, Synthesis of Iminium Salts, Orthoesters and Related Compounds, Elsevier, 1991, pp. 485–599, DOI:10.1016/b978-0-08-052349-1.00166-9, ISBN 978-0-08-052349-1. URL consultato il 12 maggio 2024.
- ^ a b Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons. DOI: 10.1002/047084289X.rh020
- ^ (EN) Michael H. Dickman e Michael T. Pope, Peroxo and Superoxo Complexes of Chromium, Molybdenum, and Tungsten, in Chemical Reviews, vol. 94, n. 3, 1994-05, pp. 569–584, DOI:10.1021/cr00027a002. URL consultato il 12 maggio 2024.
- ^ (EN) Andrew Jordan, Callum G. J. Hall e Lee R. Thorp, Replacement of Less-Preferred Dipolar Aprotic and Ethereal Solvents in Synthetic Organic Chemistry with More Sustainable Alternatives, in Chemical Reviews, vol. 122, n. 6, 23 marzo 2022, pp. 6749–6794, DOI:10.1021/acs.chemrev.1c00672. URL consultato il 13 maggio 2024.
- ^ Beck, A. K.; Seebach, D. "N,N'-Dimethylpropyleneurea" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, New York. DOI: 10.1002/047084289X.rd366
- ^ Triptikumar Mukhopadhyay, Dieter Seebach, Substitution of HMPT by the cyclic urea DMPU as a cosolvent for highly reactive nucleophiles and bases, in Helvetica Chimica Acta, vol. 65, n. 1, 1982, pp. 385–391, DOI:10.1002/hlca.19820650141.
- ^ (EN) Ian A. O’Neil, Duncan Wynn e Justine Y. Q. Lai, Quinuclidine N-oxide: a potential replacement for HMPA, in Chemical Communications, n. 1, 1º gennaio 1999, pp. 59–60, DOI:10.1039/A808779B. URL consultato il 13 maggio 2024.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Esametilfosforammide
Collegamenti esterni
modifica| Controllo di autorità | GND (DE) 4159805-2 |
|---|