Fluoruro di potassio
Il fluoruro di potassio è il sale di potassio dell'acido fluoridrico, di formula KF.
| Fluoruro di potassio | |
|---|---|
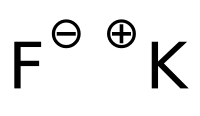 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | KF |
| Massa molecolare (u) | 58,10 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 232-151-5 |
| PubChem | 522689 |
| SMILES | [F-].[K+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,48 (20 °C) |
| Solubilità in acqua | 920 g/l (20 °C) |
| Temperatura di fusione | 860 °C (1.133 K) |
| Temperatura di ebollizione | 1.500 °C (1.773 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 302+312+332 - 410 |
| Consigli P | 261 - 280 - 301+310 - 311 [1] |
A temperatura ambiente si presenta come un solido bianco inodore, con un leggero sapore salino. È, come tutti i composti fluorurati, una sostanza tossica.
Posto in soluzione acquosa rende la stessa alcalina (la pKa dell'acido fluoridrico vale 3,17, rendendolo di fatto un acido debole).
Si può trovare naturalmente nel minerale carobbiite.
Preparazione
modificaIl fluoruro di potassio può essere estratto tramite raffinazione della carobbiite[2] (essendo però questa rara in natura il metodo trova scarsissima applicazione) oppure per neutralizzazione dell'acido fluoridrico con carbonato di potassio con conseguente creazione di difluoruro di potassio (previa essiccazione della soluzione):
Scaldando il difluoruro si spezza il legame a idrogeno presente tra il fluoro e l'acido fluoridrico permettendo la creazione di fluoruro di potassio[3]:
Fondamentale è l'uso di contenitori inerti al fluoro (come per esempio il Teflon), in quanto l'acido fluoridrico e il fluoruro intaccano porcellana e vetro, rendendoli solubili.
Altro metodo per ottenere direttamente fluoruro di potassio è una reazione acido-base tra idrossido di potassio (KOH) e acido fluoridrico (HF).[4]
Applicazioni
modificaQuesto composto è un importante agente fluorurante[5], e trova quindi applicazioni come intermedio per la produzione di pesticidi o come fluorurante organico (in questi casi viene abbinato a un criptando).
Sempre come agente fluorurante si usa per convertire i cloroalcani a fluoroalcani attraverso la reazione di Finkelstein.
Inoltre può essere utilizzato per lavorare il vetro.
Sicurezza
modificaQuesto composto è tossico se ingerito o inalato, e una dose sufficientemente alta può portare alla morte.
A contatto con la pelle provoca ustioni ed è potenzialmente corrosivo.
Per questi motivi il suo utilizzo deve essere attentamente monitorato.
Note
modifica- ^ Sigma Aldrich; rev. del 19.12.2012
- ^ (EN) Potassium fluoride, su potassiumfluoride.com.
- ^ (EN) Potassium fluoride on toxnet.nlm.nih.gov, su toxnet.nlm.nih.gov.
- ^ (EN) Potassium fluoride | 7789-23-3, su chemicalbook.com. URL consultato il 20 maggio 2017.
- ^ (EN) Uses of Potassium Fluoride, su potassiumfluoride.com. URL consultato il 20 maggio 2017 (archiviato dall'url originale il 6 giugno 2017).
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Fluoruro di potassio
| Controllo di autorità | GND (DE) 4418386-0 |
|---|