Tioaldeidi
Le tioaldeidi sono composti organosolforici (o zolforganici), cioè composti organici contenente legami carbonio-zolfo, aventi formula bruta CnH2nS, che recano nella loro struttura il gruppo funzionale tioformile, indicato con -CHS. Le tioaldeidi sono paragonabili ad aldeidi, RC(O) H, in cui un atomo di zolfo (S) ha sostituito l'atomo di ossigeno (O) nel doppio legame con il carbonio.

Il gruppo -C=S-H viene detto genericamente tiocarbonile o tiocarbonilico. Nelle tioaldeidi esso è legato a un atomo di idrogeno e ad un radicale alchilico o arilico; nella tioformaldeide, la tioaldeide più semplice, esso è legato a due atomi di idrogeno.[1]
A causa della poca stabilità del legame carbonio zolfo rispetto a quella del legame carbonilico, le tioaldeidi sono però molto più reattive delle aldeidi, non solo, esse sono anche più reattive dei relativi tiochetoni, a causa del fatto che la protezione sterica di cui godono è quella data da un solo gruppo sostituente. Per questo motivo generalmente le tioaldeidi non possono essere isolate in condizioni standard dato che tendono subito a polimerizzare; la già citata tioformaldeide (H2C=S), ad esempio, condensa formando il suo trimero ciclico chiamato 1,3,5-tritiano, mentre la tioacroleina (H2C=CHCH=S), formata dalla decomposizione dell'allicina presente nell'aglio, dimerizza attraverso una reazione di Diels-Alder, portando alla creazione di due vinilditiini isomeri.[2][3]
Nonostante la sua alta instabilità alle condizioni stardard terrestri, la tioformaldeide è invece stabile in condizioni decisamente più estreme, tanto che, grazie a tecniche di spettroscopia infrarossa, la sua presenza è stata riscontrata, assieme a quelle dei suoi isotopologhi mono- e di-deuterato, nelle nubi interstellari, come la nube di gas ad alta velocità chiamata CO-0.40-0.22.[4]
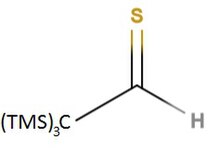
L'alta reattivià della tioaldeidi può essere diminuita di una certa misura attraverso una stabilizzazione cinetica o termodinamica. Nel primo caso, gruppi sostituenti piuttosto voluminosi in posizione α possono proteggere stericamente le tioaldeidi e permettere l'isolamento delle singola molecole, ne sono un esempio la 2,4,6-tri-terz-butil-tiobenzaldeide[5] e la tris(trimetilsilil) etanotiale.[6] Tra le tioaldeidi termodinamicamente stabilizzate si può invece citare il caso dell'aldeide viniloga 3-dimetilammino-propenetiale in cui la stabilizzazione si ha grazie al contributo della sua forma risonante.
 |
 |
 |
Sintesi
modificaEsistono vari metodi per la sintesi di tioformaldeidi, ognuno preferibile a seconda del tipo di composto che si vuole ottenere.[7]
Uno dei più comuni è la cicloinversione di composti eterociclici dello zolfo con un anello di quattro elementi attraverso fotolisi o termolisi. Ad esempio, sottoponendo a fotolisi, ad una temperatura di 10 K, delle molecole di triotiocarbonato di metilene isolate in una matrice di argon, si è riusciti per la prima volta, nel 1982, ad ottenere delle molecole di tioformaldeide stabili.[8]
Il primo ad ottenere una tioaldeide eterociclica stabile fu, nel 1960, Woodward che la ottenne come prodotto intermedio in una sintesi totale di clorofilla facendo reagire un sale di imminio con un idrogenosolfuro basico. Oggi questo metodo è stato esteso ed è diventato uno dei più comuni per ottenere tioaldeidi eterocicliche stabili, che si ottengono quindi dall'utilizzo di idrogenosolfuro di sodio in reazioni di Vilsmeier modificate. Di seguito la sintesi di un'aldeide eterociclica a partire da un pirrolo[2,1-b]-tiazolo. Dal trattamento di questo con ossicloruro di fosforo e dimetilformammide si ottiene il sale di Vilsmeier intermedio, e dalla razione di quest'ultimo con idrogenosolfuro di sodio la corrispondente tioaldeide.
Un altro metodo prevede la formazione di una tioaldeide attraverso la solforazione del suo corrispettivo carbonilico. Tra i vari reagenti solforizzanti, il più efficace ed utilizzato è l'esametildisilatiano.[9] Ad esempio, se si tratta una miscela di aldeidi e sililalleni con l'esametildisilatiano in presenza di cloruro di cobalto, si ottiene le corrispondenti tioaldeidi e i corrispondenti tioacilsilani α,β-insaturi i quali sono poi soggetti in minor parte ad una reazione cicloadditiva che restituisce dei 6-silil-4H-1,3-ditiini 2-sostituiti.
Note
modifica- ^ Thioaldehydes, su IUPAC Gold Book, IUPAC. URL consultato il 19 settembre 2017.
- ^ H. W. Kroto, B. M. Landsberg, R. J. Suffolk e A. Vodden, The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone, (CH3)2CS, in Chem. Phys. Lett., vol. 29, n. 2, 1974, pp. 265-269, Bibcode:1974CPL....29..265K, DOI:10.1016/0009-2614(74)85029-3.
- ^ E. Block, Garlic and Other Alliums: The Lore and the Science, Royal Society of Chemistry, 2010, ISBN 0-85404-190-7. URL consultato il 19 settembre 2017.
- ^ Tomoharu Oka, Reiko Mizuno, Kodai Miura e Shunya Takekawa, Signature of an Intermediate-Mass Black Hole in the Central Zone of our Galaxy, in The Astrophysical Journal Letters, vol. 816, n. 1, The American Astronomical Society, 28 dicembre 2015, pp. L7, Bibcode:2016ApJ...816L...7O, DOI:10.3847/2041-8205/816/1/L7, arXiv:1512.04661. URL consultato il 14 settembre 2017.
- ^ Renji Okazaki, Akihiko Ishii, Nobuo Fukuda, Hiroyuki Oyama e Naoki Inamoto, Synthesis of 2,4,6-tri-t-butylthiobenzaldehyde, the first stable thiobenzaldehyde, in Journal of the Chemical Society, Chemical Communications, n. 20, 1982, pp. 1187-88, DOI:10.1039/C39820001187. URL consultato il 19 settembre 2017.
- ^ Renji Okazaki, Akihiko Ishii e Naoki Inamoto, First isolation of a stable aliphatic thioaldehyde, tris(trimethylsilyl)ethanethial, in Journal of the American Chemical Society, Chemical Communications, vol. 109, n. 4, 1987, pp. 279-80, DOI:10.1021/ja00235a046. URL consultato il 19 settembre 2017.
- ^ S. J. Collier, Thioaldehydes, in Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 27: Heteroatom Analogues of Aldehydes and Ketones, Georg Thieme Verlag, 14 maggio 2014, pp. 177-80.
- ^ M. Torres, I. Safarik, A. Clement e O. P. Strausz, The generation and vibrational spectrum of matrix isolated thioformaldehyde and dideuterothioformaldehyde (PDF), in Canadian Journal of Chemistry, vol. 60, n. 10, 1982, pp. 1187-1191, DOI:10.1139/v82-176. URL consultato il 17 settembre 2017.
- ^ A. Capperucci, A. DeglInnocenti, P. Scafato e P. Spagnolo, Synthetic Applications of Bis(trimethylsilyl)sulfide: Part II. Synthesis of Aromatic and Heteroaromatic o-Azido-Thioaldehydes, in Chemistry Letters, vol. 24, n. 2, 1995, p. 147, DOI:10.1246/cl.1995.147.
Voci correlate
modificaCollegamenti esterni
modifica- (EN) thioaldehyde, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4313246-7 |
|---|