Tricloruro di arsenico
Il tricloruro di arsenico è il cloruro dell'arsenico trivalente, As(III), avente formula AsCl3. A temperatura ambiente AsCl3 si presenta come un liquido incolore, denso (d = 2,205 g/mL), leggermente oleoso, che fuma all'aria per l'umidità che ne idrolizza i vapori. È molto tossico e irritante.
| Tricloruro di arsenico | |
|---|---|
 | |
| Nomi alternativi | |
| cloruro di arsenico(III) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | AsCl3 |
| Massa molecolare (u) | 181,28 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 232-059-5 |
| PubChem | 24570 |
| SMILES | Cl[As](Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,15 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | −16 °C (257 K) |
| Temperatura di ebollizione | 130,2 °C (403,4 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 48 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 300 - 310 - 331 - 314 - 350 - 410 |
| Consigli P | 273 - 280 - 301+310 - 302+352 - 304+340 - 361 [1] |
Struttura molecolare e proprietà
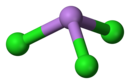
modificaAsCl3 è un composto molecolare che si forma dai suoi elementi esotermicamente, ΔHƒ° = -305,0 kJ/mol.[2] Da indagini di spettroscopia rotazionale nella regione delle microonde risulta che la molecola è a forma di piramide trigonale, con l'atomo di As al vertice; il legame As-Cl è lungo 216,1 pm e l'angolo Cl-As-Cl è di 98,4° e questo angolo è un po' più stretto (100,1°) che nell'analogo tricloruro di fosforo.[3] La simmetria molecolare appartiene al gruppo puntuale C3v.[4] Anche allo stato liquido e solido la struttura di AsCl3 è ancora molecolare, con lievi variazioni, come accade anche per AsF3 e AsBr3, ma a differenza del triioduro AsI3 (solido non molecolare).[2]
AsCl3 è una molecola piuttosto polare (μ = 1,59 D[5]) e il liquido viene utilizzato come solvente non acquoso:[2] a 20 °C ha bassa viscosità (η = 1,23 cP), ha una apprezzabile conduttività (k = 1,4×10–7 ohm–1cm–1) e discreta costante dielettrica, εr = 12,8.[6]
In rimarchevole differenza dal tricloruro di fosforo, il tricloruro di arsenico è piuttosto sorprendente nel resistere all'ossidazione ad As(V): solo il fluoro riesce facilmente dando AsF5 (molto stabile) e la formazione dell'ossitricloruro di arsenico AsOCl3 è stata realizzata dopo svariati tentativi solo nel 1976 trattando AsCl3 con ozono;[7] anche il pentacloruro AsCl5 è anch'esso molto instabile, a marcata differenza di PCl5 (omologo inferiore) e SbCl5 (omologo superiore), e si decompone sopra a circa -50 °C.[8] Questo comportamento dell'arsenico è comune anche agli ultimi elementi del quarto periodo, in particolare selenio e bromo.[9]
AsCl3 è solubile in cloroformio, tetracloruro di carbonio e in etere;[10] è anche solubile in AsF3, ma in tal caso si formano composti di scambio cloro-fluoro: AsFCl2 e AsF2Cl.[11]
In acqua si scioglie idrolizzandosi rapidamente fino a acido arsenioso e acido cloridrico:
- AsCl3 + 3 H2O → As(OH)3 + 3 HCl ↑
Viene preparato per reazione dell'anidride arseniosa As2O3 con acido cloridrico concentrato:
- As2O3 + 6 HCl → 2 AsCl3 + 3 H2O
i prodotti della reazione vengono separati per distillazione.
Si può anche preparare per interazione diretta di arsenico elementare e cloro gassoso a 80-85 °C:[12]
- 2 As + 3 Cl2 → 2 AsCl3
Reagisce alcoli e fenoli dando i corrispondenti esteri dell'acido arsenioso; con il fenolo, ad esempio, dà il trifenilarsenito:
- AsCl3 + PhOH → As(OPh)3 + 3 HCl
con alcoli e/o alcossidi alcalini in minore quantità molare forma alogeno esteri:
- AsCl3 + EtOH → EtOAsCl2 + HCl
- AsCl3 + 2 EtONa → (EtO)2AsCl + 2 NaCl
AsCl3 è importante composto di partenza in chimica organometallica per la sintesi di arsine (AsR3), che sono comuni leganti per metalli in bassi stati di ossidazione, analoghi alle fosfine; ad esempio, con sodio metallico e clorobenzene si ottiene la trifenilarsina:[13]
- AsCl3 + 6 Na + 3 C6H5Cl → As(C6H5)3 + 6 NaCl
Note
modifica- ^ Scheda del composto su GESTIS [1] consultata il 16.03.2023.
- ^ a b c N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 559, ISBN 0-7506-3365-4.
- ^ P. Kisliuk e C. H. Townes, The Microwave Spectra and Molecular Structure of Phosphorus and Arsenic Trichloride, in The Journal of Chemical Physics, vol. 18, n. 8, 1º agosto 1950, pp. 1109–1110, DOI:10.1063/1.1747872. URL consultato il 26 agosto 2022.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 3 giugno 2022.
- ^ arsenic trichloride, su www.stenutz.eu. URL consultato il 3 giugno 2022.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 561, ISBN 0-7506-3365-4.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 571, ISBN 0-7506-3365-4.
- ^ (EN) Konrad Seppelt, Arsenic Pentachloride, AsCl5, in Angewandte Chemie International Edition in English, vol. 15, n. 6, 1976-06, pp. 377–378, DOI:10.1002/anie.197603771. URL consultato il 26 agosto 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi Strutture Reattività, Piccin, 1999, p. 912, ISBN 88-299-1470-3.
- ^ (EN) PubChem, Arsenic trichloride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 26 agosto 2022.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 563, ISBN 0-7506-3365-4.
- ^ (EN) Sabina C. Grund, Kunibert Hanusch e Hans Uwe Wolf, Arsenic and Arsenic Compounds, Wiley-VCH Verlag GmbH & Co. KGaA, 15 ottobre 2008, pp. a03_113.pub2, DOI:10.1002/14356007.a03_113.pub2, ISBN 978-3-527-30673-2. URL consultato il 3 giugno 2022.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv4p0910.
Bibliografia
modifica- N. N. Greenwood, A. Earnshaw. Chimica degli elementi, Vol I. Piccin. ISBN 88-299-1022-8
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Tricloruro di arsenico