Acido folico
L'acido folico (o acido pteroil-monoglutammico), noto anche come vitamina M, vitamina B9,folina o folacina, prende il nome dal latino folium (foglia),[2] è stato scoperto nel 1939, dopo una serie di studi relativi alla terapia di una forma di anemia nei polli provocata artificialmente. L'acido folico come tale non è attivo, ma è il precursore della forma attiva, il tetraidrofolato; si tratta quindi di un profarmaco.[3]
| Acido folico | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
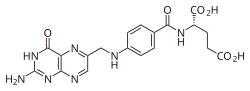
| acido (S)-2-(4-((2-ammino-4-idrossipteridin-6-il)metilammino)benzammido)pentanedioico | |
| Nomi alternativi | |
| acido pteroil-L-glutammico vitamina B9 vitamina M folacina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C19H19N7O6 |
| Massa molecolare (u) | 441,403 |
| Aspetto | polvere giallo arancione |
| Numero CAS | |
| Numero EINECS | 200-419-0 |
| PubChem | 6037 e 135398658 |
| DrugBank | DBDB00158 |
| SMILES | C1=CC(=CC=C1C(=O)NC(CCC(=O)O)C(=O)O)NCC2=CN=C3C(=N2)C(=O)N=C(N3)N |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 0,0016 g/L |
| Temperatura di fusione | 250 °C (523,15 K) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
Questa sostanza fu isolata prima dal fegato e dai vegetali, e venne chiamata "fattore di Wills", dal nome della sua scopritrice;[4][5][6] successivamente venne caratterizzata chimicamente[7][8] e si vide inoltre che favoriva la proliferazione di alcuni microrganismi in terreni di coltura.[9][10][11][12]
L'acido folico è una vitamina idrosolubile del gruppo B[13] necessaria per tutte le reazioni di sintesi, riparazione e metilazione del DNA;[14] per il metabolismo dell'omocisteina (rimetilazione),[15][16][17] e di altre importanti reazioni biochimiche, specialmente quando sono implicati intensi periodi di divisione cellulare in caso di crescita rapida. Per questo motivo sia i bambini sia gli adulti necessitano di acido folico per produrre normalmente i globuli rossi e prevenire forme di anemia.[3][18]
L'acido folico è più stabile al calore[19][20][21] dei folati alimentari presenti negli alimenti[22][23][24] e per questo motivo viene usato in moltissimi paesi per fortificare le farine alimentari.[25][26][27] Questa pratica ha ridotto in modo marcato l'incidenza delle malformazioni neonatali, particolarmente di quelle a carico del sistema nervoso centrale come le disfunzioni del tubo neurale (DTN)[28][29][30] e altri tipi di malformazioni del cranio[31][32] e cardiache.[33][34][35][36]
Negli anni oltre 26 800[37] studi hanno verificato le potenzialità terapeutiche e/o preventive dell'acido folico in amplissima varietà di situazioni cliniche in virtù del suo noto pleiotropismo farmacologico.[38][39] Spesso questi studi hanno dimostrato la validità dell'uso dell'acido folico in indicazioni diverse da quelle approvate quali la prevenzione dei difetti del tubo neurale (DNT) e le anemie.[40][41][42][43] In alcuni ambiti, come la prevenzione dei tumori o la prevenzione delle patologie cardiovascolari e altre patologie, l'utilizzo dell'acido folico va considerato off-label e sperimentale, poiché ancora oggetto di un acceso e non concluso dibattito scientifico.
Gli usi medici approvati dall'AIFA dell'acido folico sono in caso di aumentata richiesta, insufficiente assorbimento, ridotta utilizzazione o insufficiente apporto dietetico.[44] Viene usato anche in associazione ai farmaci antitumorali come MTX e 5FU e altri antifolici in genere; in questi ultimo caso spesso è preferito il metabolita attivo dell'acido folico, l'acido folinico.[45]
Alle donne che decidono di concepire è fortemente raccomandata l'assunzione di 400 µg al giorno di acido folico, per prevenire l'insorgenza di malformazioni fetali; in casi selezionati, a scopo profilattico si raccomandano dosaggi più elevati: 4-5 mg al giorno.[46] La prevenzione delle malformazioni fetali e dei DNT prevede l'assunzione di acido folico alle dosi raccomandate un mese prima e fino tre mesi o più dopo il concepimento;[46] spesso queste dosi raccomandate non sono raggiunte dalle popolazioni per una scarsa propensione al consumo di vegetali e frutta, per l'assunzione di cibi conservati e per i metodi di cottura.[46]
A scopo preventivo, la tollerabilità e la sicurezza di impiego sono assolute fino a una dose giornaliera nell'adulto di 1 mg (UL (µg/d)).[47]
Storia
modificaÈ stata Lucy Wills, una delle prime donne ricercatrici di ematologia al mondo, a descrivere l'anemia macrocitica in donne indiane gravide di Bombay; queste rispondevano alla terapia con un preparato commerciale chiamato Marmite: la ricerca successiva consentì di individuare l'acido folico.[senza fonte]
L'acido folico, prima che venisse chiamato in questa maniera[non chiaro], fu denominato da William J. Darby "vitamina M" (M da monkey, scimmia, l'animale su cui venne testato).
Inoltre si comprese che esso era essenziale per la crescita del Lactobacillus casei e per questo motivo fu anche chiamato "fattore del L. casei". La sulfanilamide si rivelò capace di inibire il metabolismo batterico dell'acido para-amminobenzoico, che è il fattore essenziale per la crescita del L. casei, contenuto nella molecola dell'acido folico. Un altro gruppo di ricerca lo chiamò invece "vitamina Bc" (c da chicks, pulcino) perché preveniva l'anemia nei pulcini.
Il nome acido folico fu coniato nel 1941 dal ricercatore statunitense Henry K. Mitchell che lo isolò nei vegetali a foglia larga.
Nel 1943 fu ottenuto in forma pura l'acido pteroglutammico mentre la struttura fu definita nel 1946.
La storia dei successi clinici dovuti alla terapia con l'acido folico inizia nel 1920, quando il deficit di folati fu inizialmente correlato all'anemia macrocitica; solamente intorno alla metà del XX secolo, con la scoperta e la sintesi dell'acido folico, si capì che l'anemia perniciosa era un'entità separata dall'anemia macrocitica.
Negli anni sessanta si comprese il ruolo dei folati nel trasferire le unità monocarboniose e con questo si comprese come il deficit di assunzione dei folati con la dieta era la causa facilmente prevedibile dei difetti del tubo neurale. Solo nel 1990 con studi ben progettati si definì il ruolo preventivo dell'acido folico nei confronti dei DNT.
I risultati di questi studi indicarono che la supplementazione preconcezionale con acido folico riduceva l'occorrenza e la ricorrenza del rischio di DNT del 70%, fatto che ha aiutato le autorità sanitarie di molti paesi a definire una politica di sanità pubblica che rendeva obbligatoria la supplementazione delle farine alimentari con l'acido folico; specie dopo il fallimento di strategie di supplementazione su base volontaria.
Negli USA questa decisione è stata presa nel 1998, decisione che ha comportato una significativa riduzione della prevalenza dei DTN nei neonati, anche quelli con polimorfismo genetico per gli enzimi che regolano la produzione di omocisteina. In Europa la decisione di fortificare con acido folico gli alimenti in modo obbligatorio da parte delle autorità sanitarie dei vari paesi non è stata attuata. Questo scelta nasce dal fatto che sussisterebbero ipotetici rischi di aumento di patologie neoplastiche; il condizionale nasce dal fatto che non vi sono prove statisticamente convincenti in tal senso sull'uomo;[48][49] rischi che per altro l'EFSA non conferma né esclude, pertanto in Europa la supplementazione con acido folico è fortemente raccomandata solamente nelle donne in età fertile che non attuino scelte anticoncezionali, ed eventualmente nei soggetti con aumento patologico di omocisteina.
Caratteristiche chimiche
modificaL'acido folico si compone strutturalmente dell'unione di tre molecole: 6-metilpterina, acido p-aminobenzoico (PABA) e acido glutammico.
La 6-metilpterina e il PABA formano una molecola di acido pteroico, da cui il nome di acido pteroilglutammico a seguito del legame col glutammato. L'acido folico è insolubile nei solventi organici ed è inattivato dalla luce e dalle radiazioni ultraviolette. Il legame con il glutammato è essenziale per la sua attività biologica. L'acido folico viene assunto dall'organismo solamente sotto la forma di acido pteroilmonoglutammico, ovvero con una sola molecola di glutammato legata al PABA. Poiché nella dieta si può ingerire anche dell'acido pteroilpoliglutammico, per poterlo rendere assimilabile si utilizzano degli enzimi (pteroilpoliglutammato idrolasi) che scindono i legami peptidici che legano tra loro le molecole di glutammato. L'assorbimento dell'acido folico avviene prevalentemente nel digiuno prossimale ed è un processo, influenzato dal pH, passivo ad alte concentrazioni di folato e attivo a concentrazioni fisiologiche. La forma attiva dell'acido folico è l'acido tetraidrofolico, che viene ottenuto per riduzione enzimatica. Tale processo avviene attraverso due reazioni di riduzione della 6-metilpterina catalizzate dalla diidrofolato reduttasi. La prima reazione porta alla formazione di acido diidrofolico successivamente ridotto ad acido tetraidrofolico.
Il tetraidrofolato interviene in reazioni di trasferimento di unità monocarboniose a diversi livelli di ossidazione e funge da trasportatore intermedio. Le unità monocarboniose possono essere:
- gruppo metilico (-CH3),
- gruppo metilenico (-CH2-),
- gruppo formilico (-CHO),
- gruppo formiminico (-CHNH).
Il gruppo monocarbonioso si può legare all'azoto N5 della 6-metilpterina o a quello N10 del PABA, talvolta a entrambi. Le forme che si possono ottenere tramite l'aggiunta di queste unità sono intercambiabili attraverso specifiche reazioni enzimatiche.
I folati intervengono nei processi metabolici coinvolti nella sintesi delle purine e della deossitimidina (dTMP), nella formazione della metionina a partire dall'omocisteina, nel catabolismo dell'istidina e nella interconversione tra glicina e serina. La formazione della metionina dalla omocisteina avviene tramite l'enzima omocisteina metiltrasferasi che utilizza la vitamina B12 come coenzima e il 5-metiltetraidrofolato come donatore di un gruppo metilico che viene prelevato da una serina che, a seguito di ciò, diventa una glicina. Per formare dTMP si ricorre al N5, N10 metilentetraidrofolato che trasferisce un gruppo metilico a una molecola di desossiuridinamonofosfato (dUMP). Nella reazione, catalizzata dalla timidilato sintasi, il metilentetraidrofolato funge da donatore sia del gruppo metilenico sia dei due elettroni necessari per ridurlo a gruppo metilico, ossidandosi a diidrofolato.
Stabilità dei folati nei cibi
modificaI folati sono molecole idrosolubili e possono subire importanti perdite nell'acqua di cottura rispetto ai cibi crudi; infatti, nei liquidi di cottura si riscontrano disciolte importanti quantità di folati. La perdita dei folati dopo cottura per ebollizione è del 50-80% nei vegetali a foglia verde e nei legumi.[50]
Al contrario, la presenza nei cibi di sostanze riducenti come l'acido ascorbico (vitamina C) determinano un incremento della quota di acido folico trattenuto nei cibi durante la cottura.[51] La perdita dei folati contenuti nei cibi può incrementare per la presenza di metalli come lo ione Fe++.[52]
Alcuni additivi alimentari comuni, come il nitrito di sodio, comportano la distruzione dei folati alimentari.[53]
I metodi di conservazione dei cibi tramite le radiazioni ionizzanti possono indurre una distruzione totale o parziale del contenuto vitaminico dei cibi anche se l'acido folico sembra aumentare, probabilmente per rottura dei legami con i poliresidui glutammici dei folati.[54]
La perdita durante la cottura dei cibi è in funzione anche della concentrazione di ossigeno presente;[55][56] la stabilità dei folati, infatti, cresce in modo inversamente proporzionale alla quantità di ossigeno nell'ambiente.[57][58]
In uno studio svedese del 2007 si documenta come i folati, contenuti in sei tipi diversi di lattuga, mantengono concentrazioni variabili da 30 a 198 µg/100g. Il contenuto dei folati decresce del 14% dopo conservazione a 4 °C per 8 giorni e del 2-40% dopo conservazione a 22 °C per 2-4h, a seconda che i campioni siano stati conservati come foglie intere, o piccoli pezzi strappati o tagliati.[59]
I folati sono molto stabili in ambienti secchi e in assenza di luce e ossigeno. La perdita di stabilità dei folati è legata alla rottura del legame tra il C9-N10 che unisce il gruppo pteridinico e il gruppo PABA presente nelle molecole di folato, al contrario questo legame risulta più stabile all'ossidazione nella molecola di acido folico per la presenza di un solo residuo glutammico[60]; questo spiega la maggiore resistenza dell'acido folico alle condizioni di stress cui vengono sottoposti gli alimenti durante la cottura e/o conservazione.
Un altro elemento, riguardo alla stabilità dei folati contenuti nei cibi, è legato al tipo di cottura oltre che alla natura del cibo stesso. Infatti, McKillop 2002[61] documenta come la stabilità dei folati dipenda dalla natura dell'alimento. Gli alimenti animali mantengono più a lungo la stabilità dei folati nella cottura e così anche le patate. Mentre per i vegetali a foglia verde le modalità di cottura sono molto importanti per la stabilità dei folati in essi contenuti; infatti, è preferibile cuocere per ebollizione, per brevi periodi e assumere il brodo di cottura ed evitare di tagliare/triturare il vegetale prima della cottura stessa; inoltre salare alla fine della cottura (il sale favorisce le perdite vitaminiche). Infine, cuocere con un coperchio ed evitare lunghi ammolli delle verdure prima della cottura.
L'aggiunta di acido folico ai derivati di cereali, garantisce la stabilità delle farine ottenute durante la conservazione delle stesse, poiché l'acido folico subisce solo piccole perdite durante la cottura al forno[In contraddizione con un'altra affermazione che segue.].[62] Infatti per questo motivo l'acido folico è usato nella fortificazione alimentare obbligatoria in diversi paesi del mondo. La stabilità nelle farine in generale è molto alta rispetto a quella naturale dei folati naturali contenuti in molti alimenti.
Il latte è relativamente povero di folati, ma questi sono resistenti alla pastorizzazione, inoltre la fermentazione del latte incrementa i livelli di folati presenti. Esso può rappresentare insieme alle farine un substrato ideale per la fortificazione: infatti le perdite del 5MTHF, la forma biologicamente attiva dell'acido folico, sono relativamente modeste, sono circa il 20%, dopo il processo di pastorizzazione UHT[63][64][65][66]. Opportune tecniche di degassazione del latte, o dei liquidi alimentari in genere, inoltre, possono incrementare la ritenzione dei folati in forma biologicamente attiva sottraendo l'ossigeno.
Fonti alimentari
modifica| Prodotto | Contenuto medio (μg/100g)[67] |
|---|---|
| Lattuga a foglia larga | 1 700 |
| Corn flakes, germe di grano, soia, lievito di birra | 1 500 - 1 200 |
| Fegato di pollo | 800 |
| Muesli | 650 |
| Fegato di manzo | 560 |
| Fiocchi di crusca, mais | 550 - 400 |
| Tuorlo d'uovo | 320 - 200 |
| Spinaci bolliti, zucchine | 290 - 180 |
| Cavoletti di Bruxelles | 270 |
| Barbabietole rosse | 260 |
| Funghi secchi | 250 |
| Asparagi, broccoli, carciofi | 240 - 180 |
| Patate bollite | 90 |
| Pomodoro in conserva | 70 |
| Arance | 60 |
| Fagioli | 50 |
| Cioccolato | 40 |
| Fave, lenticchie | 50 - 40 |
L'acido folico è presente nelle frattaglie (rene, fegato), come folati nelle verdure a foglia verde (lattuga, spinaci, broccoli), nei legumi e nelle uova. La sua presenza è scarsa nella frutta e nel latte. Parte dell'acido folico (circa il 50% o anche più) si può perdere durante la cottura in quanto termolabile[In contraddizione con un'altra affermazione che precede.].
In alcuni alimenti possono esistere delle sostanze inibitrici della pteroilpoliglutammato idrolasi, o altre ancora non conosciute, in grado di diminuire l'assorbimento di acido folico.
L'acido folico è la forma più stabile dei folati. Si trova raramente negli alimenti come tale, mentre costituisce sia il composto utilizzato nella fortificazione degli alimenti, sia il composto più frequentemente impiegato nei supplementi vitaminici. La forma di acido folico comunemente presente nei cibi è chiamata folato; questa è una miscela complessa di composti di poliglutammato coniugato (cioè più molecole di glutammato legato con un legame γ-carbossilico al gruppo PABA e pteridinico della molecola di acido folico). La maggior parte dei folati presenti nei cibi sono molecole pteroilpoliglutammatiche che contengono da 1 a 6 molecole di glutammato.
Questi composti tendono a essere resistenti all'idrolisi di enzimi nel tratto gastrointestinale. Tuttavia i coniugasi, un gruppo di enzimi zinco-dipendenti intracellulari altrimenti detti i folil-poliglutammato idrolasi o glutammato carbossipeptidase II (GCPII), sono in grado di eliminare i gruppi di glutammato prima dell'assorbimento intestinale, rompendo il legame γ-carbossilico. L'azione dell'enzima coniugasi è necessaria per ottenere l'acido folico o acido pteroilmonoglutammico, che è la forma normalmente assorbita dall'intestino; successivamente l'acido folico viene ridotto ulteriormente nel fegato in 5MTHF (5-metil-tedra-idro-folato) ed è questa la forma attiva della stessa vitamina, responsabile delle notevoli attività biologiche conosciute. Il 5MTHF è altrimenti chiamato acido folinico o (acido N5-formil-5, 6, 7, 8-tetraidro pteroglutamico).
Nei cibi i folati esistono in varie combinazioni di residui poliglutammici diversi (tri, tetra, penta, epta) legati alla molecola di acido folico (Seyoum 1998).[68] Alcuni cibi con elevata percentuale di folati sono le frattaglie (fegato) di animali, il lievito di birra, i fiocchi di cereali, i vegetali a foglia larga (spinaci, broccoli, asparagi, lattuga), in generale anche frutta, latte, uova. Anche qualche tipo di batterio intestinale è in grado di formare dei folati.
La biodisponibilità dei folati naturali dei cibi è minore di quella dell'acido folico sintetico del 50%; questa stima, che è usata per il calcolo della RDA giornaliere, è probabilmente calcolata per difetto.[69] La biodisponibilità dei folati dipende dalla maggior presenza della loro forma in monoglutammati, piuttosto che poliglutammati.[70] L'acido folico è generalmente ben assorbito; tuttavia, il processo di conversione nella forma di coenzima metabolicamente attivo è relativamente complesso; come detto, l'assorbimento di questi folati naturali avviene per la presenza di enzimi coniugasi (γ-glutamil-carbossi peptidasi o GCPII), poiché i folati, essendo poliglutammati, sono inizialmente de-coniugati nelle cellule della parete intestinale diventando monoglutammati. I folati alimentari sono assorbiti principalmente nel digiuno e nel terzo prossimale dell'intestino tenue, anche se possono essere assorbiti per tutta la sua lunghezza.[71] Una delle cause di scarso assorbimento è dovuta al fatto che le GCPII hanno un optimum di pH 6–7[72]; quindi l'assunzione di cibi che possono alterare il pH intestinale può determinare un'incompleta deconiugazione dei folati poliglutammici in acido folico monoglutammico.
L'assorbimento dei folati è accelerato dal glucosio e dal galattosio, mentre è compromesso da alcuni fattori alimentari:[73] acidi organici, sotto forma di ioni come il citrato, il malato, l'ascorbato e il fitato, sostanze naturalmente presenti nel succo di arancia, hanno un leggero effetto inibitorio sull'azione delle GCPII;[74]; lo stesso per gli acidi nucleici quando ingeriti in grandi quantità.[75] È stato osservato che sostanze come la salazosulfopiridina e l'etanolo inibiscono competitivamente la GCPII.[76]
Circa il 90% dell'acido folico (monoglutammato) viene assorbito dagli esseri umani quando viene ingerito a digiuno, infatti, tale percentuale è marcatamente ridotta in presenza di molti alimenti, indipendentemente dal fatto che l'acido folico sia stato assunto come tale o come derivato dei folati alimentari.[77]
È stato inoltre documentato che mutazioni geniche del gene che codifica le GCPII possono determinare una perdita parziale dell'attività dello stesso enzima, con una conseguente perdita di efficacia dell'azione deconiugante dell'enzima sui residui glutammici dei folati e con una conseguente riduzione dell'assorbimento degli stessi[78]. Tuttavia questa mutazione è molto rara nelle popolazioni[79]. In generale, va detto che la capacità di metabolizzazione da parte delle GCPII è ampiamente eccedente la necessità di deconiugazione dei poliglutammati (folati) assunti con la dieta[72]. Tra i fattori legati alla natura dei cibi che influenzano l'assorbimento dei folati vi è l'incompleto rilascio degli stessi dalle strutture cellulari di certe piante, per la presenza di legami covalenti tra le molecole del cibo e i folati presenti negli stessi; infatti, alcuni studi hanno dimostrato che la pre-digestione con trattamenti enzimatici o fisici degli spinaci migliora la biodisponibilità dei folati presenti negli stessi[80]. Va detto però che la presenza di fibre non influenza l'azione delle GCPII[81].
Fortificazione alimentare
modificaLa fortificazione obbligatoria consiste nell'aggiunta di acido folico alle farine alimentari. Attualmente sono 37 i paesi che la praticano.[82] Nessun paese europeo ha implementato una fortificazione obbligatoria delle farine di grano con acido folico, anche se questa pratica è oggetto di ampio dibattito in sede comunitaria; infatti nessun paese ha sviluppato un progetto in tal senso, a dispetto di un possibile vantaggioso profilo di rischi/benefici per la popolazione femminile in età fertile che non sempre assume con l'alimentazione la dose giornaliera raccomandata di acido folico.
Al contrario in USA e Canada questa pratica è già iniziata nel 1998 e anche in molti paesi sudamericani, mentre la Nuova Zelanda e l'Australia hanno iniziato dal 2009[83]. Per meglio comprendere le dimensioni del problema della necessità o meno della fortificazione delle farine alimentari arricchendole con acido folico, è stato prodotto un documento da parte dell'EFSA (ESCO Report on Analysis of Risks and Benefits of Fortification of Food with Folic Acid) che mostra una serie di dati scientifici e quindi le conclusioni cui è pervenuta l'EFSA sui rischi e benefici della supplementazione obbligatoria con acido folico:[48] questo rapporto di fatto è la linea guida per l'uso della stessa vitamina,[84] in esso si legge: «La relazione ha anche esplorato il rapporto tra acido folico e rischio di tumore e ha concluso che i dati attuali sono troppo limitati per permettere una valutazione quantitativa completa del rischio acido folico-tumore e che gli sviluppi scientifici in questo settore devono essere monitorati con attenzione».
Nelle conclusioni del rapporto si legge anche:
- Il benefico nella prevenzione dei DTN è acclarato, mentre non è ancora definitivo il giudizio sulla prevenzione primaria con l'acido folico nella prevenzione dei rischi cardiovascolari, nei tumori e nel decadimento cognitivo.
- La dose compresa tra 200 e 400 µg/d è la dose consigliata negli adulti come dose giornaliera, mentre nelle donne in età fertile che non escludono la possibilità di una gravidanza si raccomanda un'assunzione di 400 µg/d.
- La fortificazione volontaria per le donne in età fertile è fortemente raccomandata in Europa, mentre non è implementata obbligatoriamente in alcun paese europeo.
- Studi condotti su modelli animali indicano che l'acido folico potrebbe incrementare il rischio di tumori del colon-retto; gli studi condotti sull'uomo hanno tuttavia prodotto risultati contraddittori. La totalità degli studi non sembra infatti comunque mostrare che l'acido folico incrementa il rischio di tumori. I dati sono modesti per durata e potenza statistica.
- La valutazione statistica dell'ipotetico rischio di tumori con acido folico è complicata dal fatto che il metabolismo dei folati è sottoposto a un complesso controllo poligenetico.
- I dati prodotti sul declino cognitivo sono insufficienti per trarre conclusioni.
- L'assunzione giornaliera di acido folico non dovrebbe superare il livello di 1 mg/d.
- La fortificazione obbligatoria dovrà eventualmente tener presente delle differenti quantità di folati assunti con i diversi tipi di alimenti (fonti naturali piuttosto che alimenti fortificati), anche in funzione dell'uso pediatrico, e deve essere inoltre possibile realizzare un sistema di monitoraggio come si fa attualmente per i DTN.
- I dati attualmente disponibili non sono sufficienti a quantificare il rischio di tumore dovuto all'assunzione di acido folico. Testualmente: There is currently insufficient data to allow a full quantitative risk assessment of folic acid and cancer risk.
- Occorrono nuovi dati per valutare meglio il rapporto rischio/beneficio che può derivare dalla fortificazione obbligatoria con acido folico.
Alcolismo
modificaL'alcolismo per vari motivi crea stati carenziali di vitamine del gruppo B, e anche dell'acido folico; in particolare sono due le modalità con cui si instaura la carenza di acido folico nell'alcolismo:[85]
- l'alcol diminuisce la formazione delle forme attive di (MTHF) partendo dall'acido folico,
- l'alcol diminuisce l'accumulo nel fegato e il rilascio dallo stesso.
In un simposio sul ruolo della S-adenosilmetionina, della betaina, e dei folati nel trattamento della malattie alcol correlate, organizzato dal National Institute on Alcohol Abuse and Alcoholism in collaborazione con l'Office of Dietary Supplements and the National Center for Complementary and Alternative Medicine of the National Institutes of Health di (Bethesda, MD) sono emerse alcune conclusioni:[86] il deficit di folati può accelerare o promuovere le malattie alcol correlate per l'incremento della concentrazione dell'omocisteina epatica e della S-adenosil omocisteina (SAH); inoltre vi è anche un decremento del glutatione, della SAME e del rapporto SAME/SAH, per una sovraregolazione dei marker da stress del reticolo endoplasmatico, con un incremento di importanti geni pro-infiammatori come: l'AP-1 e il gene caspasi-12 e con decremento della DNA-metilazione complessiva. Inoltre, si ha anche un incremento della perossidazione lipidica con un incremento nella circolazione delle VLDL.
La correzione dell'incremento di omocisteina patologica determina un'attenuazione dei fenomeni di apoptosi e della sintesi di acidi grassi.
Il deficit di acido folico viene attribuito a tre cause:
- diminuzione dell'apporto con la dieta di cibi ricchi di acido folico,
- diminuzione dell'assorbimento intestinale di acido folico per deficit dei trasportatori di membrana degli enterociti,
- diminuzione dei depositi epatici di acido folico e parallela perdita per via urinaria dello stesso.
Ruolo biologico nell'umano
modificaL'acido folico è fondamentale per la replicazione in vivo del materiale genico in quanto ricopre un ruolo chiave nella biosintesi di purine e pirimidine (costituenti del DNA e dell'RNA) oltre che di aminoacidi, sia nell'organismo umano sia nell'organismo batterico: nell'uomo viene assimilato dalla dieta e non sintetizzato; per contro, viene sintetizzato dai batteri ma non assimilato.
Tale differenza è alla base del meccanismo d'azione di antibiotici quali sulfamidici e trimetoprim. I primi agiscono inibendo l'enzima diidro-pteroato-sintetasi, che unisce la 6-metilpteria all'acido para-amino-benzoico a formare l'acido folico; il trimetoprim inibisce l'enzima diidrofolato-reduttasi, che ha il compito, tramite l'impiego di due molecole di NADPH, di convertire l'acido folico, nella sua forma bioattiva, l'acido tetraidrofolico.
Gli antagonisti dell'acido folico sono dei chemioterapici molto efficaci nella terapia dei tumori e lo sono stati molto in passato come immunosoppressori. Farmaci come metotrexato e trimetrexato sono stati per decenni i farmaci cardine nel trattamento delle leucemie e di molti tumori solidi.
L'acido folico è un farmaco privo di effetti collaterali, le eventuali interazioni farmacologiche note sono con poche classi di farmaci: antiepilettici, antitumorali attivi sul ciclo dell'acido folico, antimalarici.
È stata pubblicata una ricerca che mostra come la supplementazione con acido folico non comporta la modifica della misura dell'INR e dei dosaggi conseguenti dell'anticoagulante, pur aumentando l'eliminazione di un metabolita del warfarin.[87]
L'acido folico, a dosi elevate, può sopperire alla mancanza relativa di vitamina B12 e innescare ugualmente la sintesi del timidilato necessario per la sintesi corretta del DNA. La conversione del metil-malonil-coenzima A in succinil-coenzima A richiede necessariamente la presenza di vitamina B12; in sua assenza si ha accumulo del metil-malonato, ritenuto responsabile delle alterazioni neurologiche (neuropatia da carenza di B12).
Nei paesi dove è obbligatoria la supplementazione con acido folico, la ricerca di tipo ematochimico per la folatemia plasmatica come causa di anemia può essere una perdita di tempo e denaro.[88]
Nelle sindromi da malassorbimento si potrà avere inizialmente anemia megaloblastica da carenza di acido folico e solo successivamente, dopo un tempo relativamente lungo, anche da carenza di vitamina B12. La carenza di acido folico da malassorbimento è evenienza più frequente della carenza di vitamina B12 perché le scorte di acido folico si esauriscono in un tempo relativamente breve (circa un mese), mentre le scorte di vitamina B12 richiedono anni per esaurirsi. Uno studio epidemiologico del 2010 dimostra che negli anziani con più alti livelli circolanti di acido folico e suoi metaboliti si osserva un miglioramento dei dati clinici di anemia e marginalmente con un decremento degli indici di macrocitosi, in soggetti con normale stato vitaminico di vitamina B12, e un miglioramento degli indici dello stato cognitivo.[89]
L'escrezione dell'acido folico nel latte umano è di 40 µg/d, ciò comporta un incremento di assunzione per la nutrice di 60 µg/d.
Gli ftalati, sostanze chimiche presenti anche nelle lacche per capelli, mostrano di modificare epigeneticamente il DNA (con meccanismi di controllo e regolazione dell'espressione del DNA stesso e della espressione dei geni). La carenza di acido folico è implicata negativamente in questi processi di regolazione genomica o epigenetica.[90]
Mutazione C677>T
modificaL'enzima 5,10-metiltetridrofolato reduttasi (5,10-MTHFR) è un enzima dipendente dall'acido folico che esiste in forma polimorfica. L'azione dell'enzima 5,10-MTHFR regola l'espressione fenotipica del DNA che il metabolismo dell'omocisteina. Questo enzima è noto per influenzare lo sviluppo delle malattie cardiovascolari.
Il gene che codifica questo enzima esibisce comunemente una sostituzione dalla citosina con la timina (C > T) sul nucleotide 677; viene indicato 677 C>T MTHFR, o C677T MTHFR. Il gene della MTHFR è situato sul cromosoma 1 in posizione p36.3 e consiste di 11 esoni; più esattamente il gene dell'enzima MTHFR è localizzato tra le due basi pari: 11.769.246 e 11.788.568 del cromosoma 1.[91]
La sostituzione del nucleoside C677>T codifica nelle proteine un'alanina a valina. Le possibili combinazione dei genotipi che codificano l'enzima sono CC (wild type o selvaggio), CT (eterozigote) e TT (recessivo). Nelle popolazioni la frequenza dell'allele 677C è stato calcolato è pari a 0,63; mentre la mutazione 677T è pari 0,37. Calcolandola con l'equazione di Hardy-Weinberg si ottiene nelle popolazioni una frequenza per la forma genotipica omozigote mutata TT bassa.
La variante genetica C677>T è notoriamente responsabile di una più alta incidenza di spina bifida o DNT, sindrome di Down, complicazioni della gravidanza come la preeclampsia, gli aborti spontanei ricorrenti e diminuzione del peso alla nascita dei neonati. Inoltre, è anche causa di aumento del rischio cardiovascolare, mentre al contrario potrebbe diminuire il rischio di cancro al colon dipendente dall'alimentazione.
Questi effetti si giustificano con la capacità di avere elevati livelli di 5,10-MTHFR che hanno un ruolo critico nella duplicazione della biosintesi dei nucleotidi. Infatti, a fronte di un corretto apporto nutrizionale di acido folico la presenza ottimale di 5,10-MTHFR protegge dal rischio di un non corretto sviluppo embriogenetico così come dallo sviluppo di molte malattie degenerative.
Al contrario uno scarso apporto di acido folico e la conseguente ridotta produzione dell'enzima 5,10-MTHFR che interviene nella corretta conversione dalla dUMP a dTMP, determina un aumento della mis-incorporazione dell'uracile nel DNA con un aumento dell'instabilità genomica. Ricerche dimostrano che i processi che intervengono nella morte cellulare programmata (apoptosi), sono strettamente correlati con la presenza dell'acido folico circolante che è responsabile dell'integrità del genoma umano.
Il ruolo centrale dei folati circolanti nella corretta elaborazione del DNA, è influenzato dai nutrienti assunti con la dieta e questi esercitano un ruolo decisivo di selezione sulla pressione evolutiva dell'uomo durante il periodo periconcezionale. Infatti anche la fertilità, oltre che l'embiogenesi, è influenzata dai livelli di folati circolanti. Paradossalmente la supplementazione con acido folico sulle popolazioni potrebbe determinare nelle stesse una maggiore presenza di genotipi mutanti, che al contrario in assenza di adeguate quantità di acido folico con la dieta darebbero origine a un minor successo riproduttivo.
Utilizzo clinico
modificaL'acido folico è usato come supplemento vitaminico nelle anemie da carenza, nei convalescenti di malattie debilitanti croniche e nelle donne gravide.
La carenza di acido folico è assai diffusa, soprattutto nei paesi sottosviluppati. Le cause di ciò sono molteplici e vanno dalle malattie infettive, alle terapie farmacologiche, alla gravidanza, al malassorbimento. Tutto ciò si traduce in problemi nella sintesi di DNA e RNA. Gli elementi più coinvolti da questo problema sono le cellule a ricambio rapido, come quelle del midollo osseo.
La sintomatologia da carenza di acido folico si manifesta attraverso un'anemia macrocitica cui si può accompagnare leucopenia e trombocitopenia, alterazioni della cute e delle mucose e disturbi gastrointestinali (malassorbimento e diarrea).
Durante la gravidanza, carenze di acido folico possono provocare problemi nella differenziazione del tubo neurale, forse per alterazione dei microtubuli, e portare, così, allo sviluppo di una spina bifida o di anencefalia. Pertanto in caso di familiarità di difetti del tubo neurale occorre aumentare le dosi di acido folico fino a 5 mg.[92]
L'Organizzazione mondiale della sanità (OMS) consiglia l'assunzione quotidiana di 200 µg di folati per gli adulti, di 50 µg per i bambini, 400 µg in gravidanza al fine di prevenire la comparsa di spina bifida e, nell'allattamento, 300 µg.
Non sono noti effetti tossici da folati fino a una dose di 5 mg/d. Si consiglia di non eccedere nell'assunzione di folati in quanto possono mascherare i sintomi dell'anemia perniciosa da carenza di vitamina B12, evento che può comparire soprattutto in anziani e vegani, in quanto non consumano nessun alimento di provenienza animale.
Utilizzo clinico in relazione con l'acido folinico
modificaL'acido folinico nella sua forma attiva levogira è indicato solo nella terapia con metotrexato ad alte dosi nei tumori e nelle leucemie. Ciò perché il metotrexato blocca l'azione enzimatica della di-idro-folatoreduttasi che serve a trasformare l'acido folico a di-idrofolato e quindi a tetra-idrofolico. L'acido folinico consente di saltare la reazione enzimatica che richiede di-idro-folatoreduttasi e produrre 5-10-metilene-THF, precursore del metabolismo dell'acido folico.
Il razionale dell'impiego dell'acido folinico rispetto all'acido folico in assenza di farmaci come il metotrexato che bloccano la trasformazione folico > folinico, fa riferimento al fatto che esso supererebbe il blocco enzimatico dovuto all'eventuale presenza di polimorfismo genetico dell'enzima 5MTHFR. Va però ricordato che il blocco dell'enzima non è mai totale;[93] di conseguenza la terapia o supplementazione alimentare con acido folico garantisce anche in caso di polimorfismo con mutazione omozigotica C677T (TT) per l'enzima, una quantità sufficiente a mantenere i livelli di folato circolante nell'intervallo di normalità.
Va anche ricordato che tutta la letteratura mondiale fa sempre riferimento all'acido folico nella prevenzione dei DTN e nei casi di iperomocisteinemia. In clinica, malgrado l'ampio uso di acido folinico, non v'è alcuna conferma sulla superiorità di questo sul suo precursore; mancanza di superiorità che mal si concilia per gli aspetti di farmacoeconomia rispetto al più comune acido folico.
Un aspetto da tener presente nella scelta tra acido folico e acido folinico, secondo l'Istituto Superiore di Sanità consiste nel problema confondente della profilassi con acido folinico che, oltre a non costituire un uso del farmaco coerente con le indicazioni OMS, introduce un ulteriore elemento di incertezza nella definizione della resistenza (e quindi della sensibilità) all'acido folico.[94]
L'uso dell'acido folinico è correttamente giustificato solo quando viene usato, insieme al metotrexato ad alte dosi, nella terapia dei tumori; poiché l'efficacia dell'acido folinico rispetto all'acido folico nei trattamenti a basse dosi con il metotrexato nell'artrite reumatoide e nelle malattie autoimmuni non ha mostrato chiari vantaggi per l'acido folinico, vantaggi che giustifichino il problema del suo costo elevato, come chiaramente suggerito da una revisione sistematica.[95]
Inoltre, ancora, l'impiego di acido folinico non sembra neppure scontato[non chiaro] nel trattamento di pazienti dializzati.[96]
Uno studio in vitro effettuato da Rozen nel 1997 del Department of Human Genelics, Pediatries & Biology, alla McGill University di Montréal,[93] chiarisce come in presenza di mutazione genica dell'enzima MTHFR (metil-tetraidrofolatoreduttasi) permanga comunque un'attività residua dello stesso enzima. Questo ha un valore decisivo nella scelta delle terapie vitaminiche con acido folico piuttosto che con acido folinico. Infatti l'attività dell'enzima mostra di essere modificata in funzione delle temperature (termolabilità): a 37 °C l'attività residua dell'enzima nelle forme omozigoti (TT) è pari a: 40-50% rispetto ai controlli; a 46 °C l'attività residua dell'enzima nelle forme omozigoti (TT) è pari a: 35% rispetto ai controlli.
Nelle donne in terapia con antagonisti dell'acido folico è più opportuno somministrare l'acido folinico piuttosto che l'acido folico a dosaggi elevati[97].
Impieghi clinici in ambito cardiovascolare
modificaA conferma della relazione lineare tra i livelli circolanti di omocisteina e lo stato dei folati circolanti, lo studio di Motulsky del 1996,[98] antecedente alla fortificazione obbligatoria delle farine con acido folico negli USA (1998), indica che la fortificazione potrebbe prevenire circa 50 000 morti annue per cause cardiovascolari. È infatti noto come l'iperomocisteinemia plasmatica sia causa di effetti patologici sull'endotelio: aterosclerosi, ipertensione, trombosi, danno al tessuto connettivo, neurotossicità, embriotossicità.
Una metanalisi condotta presso la The Johns Hopkins School of Medicine di Baltimora non raccomandava la supplementazione con acido folico nella prevenzione cardiovascolare.[99]
Successivamente un gruppo di ricercatori dell'University of Oxford raggruppati nel the B-Vitamin Treatment Trialists' Collaboration, pubblica una metanalisi di 37 485 pazienti studiati per un periodo di 5 anni.[100] Le conclusioni riguardano aspetti cardiovascolari e tumorali. I risultati confermano una riduzione del 25% dei livelli di omocisteina plasmatica come conseguenza della supplementazione degli alimenti con acido folico. Però gli eventi avversi di tipo cardiovascolare intesi come riduzione di eventi: vascolari maggiori, vascolari cardiaci e stroke non mostrano una riduzione statisticamente significativa e così anche la mortalità complessiva per questo tipo di eventi. Inoltre, non vi è stato un aumento significativo di eventi tumorali, della mortalità per tumori e di tutte le cause di mortalità durante l'intero periodi di esame (5 anni).
Le conclusioni degli autori sono che la supplementazione dietetica con acido folico è in grado di abbassare i livelli di omocisteina plasmatica; ma non ha mostrato effetti significativi nell'arco di 5 anni sugli eventi cardiovascolari o sul incidenza di cancro o sulla mortalità generale nelle popolazioni studiate.
Stroke
modificaUna metanalisi di otto studi randomizzati, ha valutato 16 841 uomini e donne rispetto al rischio di stroke in presenza di alti livelli di omocisteina plasmatica.[101] La ricerca dimostra che la supplementazione con acido folico riduce significativamente il rischio di stroke del 18%, con risultati anche migliori nei soggetti che hanno assunto l'acido folico per più di 36 mesi.
Inoltre, i livelli di omocisteina dopo l'assunzione di acido folico quando si riducono più del 20%, sono in grado di produrre una riduzione del 23% nel rischio relativo di ictus. Anche se lo studio mostra che l'efficacia della supplementazione con acido folico nella prevenzione primaria versus la prevenzione secondaria dell'ictus non è risultata conclusiva; l'analisi ha trovato che l'acido folico è in grado di ridurre il rischio di ictus in prevenzione primaria. Due studi dell'agosto 2010 sembrano però sconfessare l'utilità nella prevenzione delle malattie cardiovascolari[102] e nello stroke[103] dell'acido folico
Una metanalisi del giugno 2010 condotta su 13 RCT per un totale di 39 005 pazienti trattati pubblicata su Stroke[104] ha dimostrato che: la supplementazione con acido folico non ha dimostrato un importante effetto nel prevenire l'ictus; tuttavia, i potenziali benefici in prevenzione primaria nell'ictus lieve, soprattutto quando l'acido folico è combinato con vitamine del gruppo B e in pazienti di sesso maschile, meritano ulteriori indagini. Questo studio lascia aperto il dibattito scientifico circa il ruolo preventivo dell'acido folico rispetto al trattamento in prevenzione primaria e/o secondaria della malattie ischemiche cerebrali.
Impieghi clinici in ambito ginecologico
modificaDifetti del tubo neurale
modificaI difetti del tubo neurale sono una causa prevedibile di morbilità e mortalità neonatale; l'assunzione di acido folico è ormai documentato in modo incontrovertibile è in grado di prevenire questa malformazioni devastanti per le famiglie e per la società.[105] Una metanalisi di tre studi dimostra la possibilità di riduzione di questa patologia grazie all'utilizzo dell'acido folico del 70% in caso di ricorrenza di gravidanza (prevenzione secondaria), in prevenzione primaria questa riduzione è del 62%; mentre la prevenzione della mortalità perinatale da DTN secondo questa ricerca si attesta al 13%.[106]
La maturazione e lo sviluppo dei vari apparati avvengono in differenti settimane: qualunque alterazione dei normali processi di duplicazione cellulare che dovesse intervenire entro i tempi relativi, si può tradurre in un danno d'organo a sviluppo completato.
La genesi dei difetti del tubo neurale dipende dall'incompleta chiusura del tubo neurale; l'insorgenza del difetto avviene tra il 17º e il 29º giorno di gestazione, quando ancora non è avvenuta la completa chiusura del tubo neurale. Molto spesso la donna in questo periodo della gestazione non ha ancora coscienza della gravidanza in corso, e per questo motivo inizia l'uso dell'acido folico solo dopo che il danno embrionale si è instaurato. Da ciò si evince l'importanza di massicce campagne promozionali che invitino a un'assunzione a scopo preventivo dell'acido folico in tutte le donne che non fanno uso di contraccezione:[92]
- tra le donne italiane le percentuali di assunzione di acido folico in modo corretto oscillano tra il 13 e il 33%;
- tra le donne immigrate le percentuali di assunzione di acido folico in modo corretto oscillano tra l'1 e il 14%;
- la probabilità di assumere l'acido folico in modo corretto in prevenzione è maggiore tra le donne primipare;
- la probabilità di assumere l'acido folico in modo corretto in prevenzione è maggiore tra le donne grado di istruzione più alto.
Questi dati presentati dimostrano l'importanza di un'opera di divulgazione attiva tra le donne; divulgazione focalizzata sul ruolo preventivo dell'integrazione alimentare con acido folico ai dosaggi consigliati a partire da un mese prima del concepimento fino ad almeno tre mesi dopo lo stesso.
La frequenza dei DTN è anche in funzione dello stato genetico dei genitori:
- Il genotipo del padre, qualunque esso sia, non ha alcun ruolo nella genesi della dei DTN e di altri difetti congeniti.
- Nelle madri omozigoti C677T (TT) il rischio di avere un bambino con DTN è due volte maggiore, mentre nelle madri eterozigoti C677T (CT) il rischio scende a 1,2 volte.
- Nei bambini omozigoti C677T (TT) il rischio di DTN è 1,8 volte maggiore, mentre in quelli eterozigoti C677T (CT) il rischio scende a 1,2.
- Il rischio di DTN aumenta di sei volte quando è in forma omozigote per madre e feto.
Il polimorfismo MTHFR-C677T è molto comune nella popolazione caucasica. Circa il 45-50% della popolazione è eterozigote per la mutazione e il 15-18% è portatore in omozigosi.[107] La frequenza dell'allele C677T nelle popolazioni varia: è elevata in Italia e tra gli ispanici, mentre è bassa fra i neri.[108] In Europa gli omozigoti C67T (TT) vanno da un minimo dell'8% della Germania al 18% dell'Italia. Secondo altri autori il genotipo C677T (TT) è particolarmente comune nel Nord della Cina (20%), nel Sud Italia (26%), e in Messico (32%).[109]
Dati prodotti per gli anni 2005-2006 da parte del CDC's National Ambulatory Medical Care Survey (NAMCS) e dal National Hospital Ambulatory Medical Care Survey (NHAMCS) indicano che negli USA si stimano circa 29 milioni di gravidanze non protette adeguatamente per la carenza di acido folico[110].
Secondo una pubblicazione di Shookhoff JM, della Georgetown University Medical Center, Washington, DC, le modificazioni epigenetiche dovute alla dis-regolazione del RNA sono correlate a un deficit di acido folico;[111] queste modificazioni epigenetiche dell'espressione genica è noto hanno un ruolo decisivo nella genesi dei DTN.[90][112]
Alla luce di questi risultati è auspicabile che la supplementazione con acido folico venga continuata per tutta la gravidanza; in modo anche da poter sfruttare i vantaggi sul controllo dei livelli plasmatici di omocisteina circolante delle gravide al fine di prevenire contestualmente molte altre patologie ostetrico e/o ginecologiche, quali aborto spontaneo, abruptio placentae, preeclampsia, IUGR, morte fetale tardiva, sindrome di Down.
La somministrazione di acido folico per la prevenzione dei difetti del tubo neurale nel nascituro, va effettuata nel periodo che precede il concepimento fino alla 12ª settimana di gestazione; non è efficace se il trattamento viene iniziato dopo la quarta settimana di gravidanza. Si raccomanda di proseguire la supplementazione di folati a partire dall'inizio del secondo trimestre, quando termina l'organogenesi e inizia l'accrescimento fetale, e per tutta la restante parte della gravidanza per ridurre il rischio di anemia megaloblastica durante la fase finale della gestazione e il puerperio[97].
Prevenzione del parto pretermine
modificaLa supplementazione con acido folico nella gravidanza avanzata (terzo trimestre) non è associata con una significativa modifica del peso del nascituro; si associa con una riduzione percentuale dei parti pretermine, quando però il supplemento è assunto quotidianamente per tutto il terzo trimestre.[113]
Prevenzione del basso peso alla nascita
modificaIn paesi in via di sviluppo la supplementazione nelle donne con preparati multivitaminici è stata in grado di garantire mediamente un modesto ma significativo aumento di peso del nascituro specie nelle donne con alto indice di BMI.[114][115]
Diabete in gravidanza
modificaL'acido folico migliora gli indici di sopravvivenza neonatali e le funzioni endoteliali nelle donne diabetiche in gravidanza.[116][117]
Impieghi clinici in ambito genito-urinario
modificaDialisi
modificaNei pazienti dializzati è dimostrabile un aumento importante dell'omocisteina plasmatica; questo aumento totale del livello di omocisteina potrebbe essere un fattore di rischio per eventi cardiovascolari e della mortalità totale nei pazienti con malattia renale terminale che non hanno ricevuto questa vitamina o la fortificazione degli alimenti con l'acido folico. L'integrazione di acido folico può essere un potenziale importante fattore di riduzione delle malattie cardiovascolari in questa particolare popolazione di pazienti[118].
Nel marzo 2010 sono stati pubblicati i risultati di una ricerca condotta a Magdeburgo i cui risultati sembrano sconfessare l'utilità della supplementazione con acido folico e vitamine del gruppo B in questi soggetti sia sulla mortalità totale sia sugli eventi cardiovascolari in genere; pur evidenziandosi una riduzione dei patologici livelli di omocisteina plasmatica[119].
Questo dato conferma altri dati precedentemente pubblicati[120][121]; anche in popolazioni esclusivamente femminili di soggetti dializzati[122].
Ricercatori del Geriatric Research, Education, and Clinical Center, Veterans Affairs Boston Healthcare System, Boston utilizzando alte dosi di acido folico (40 mg/d) sono riusciti a dimostrare una riduzione significativa dei livelli di omocisteina, ma non si sono viste modifiche significative dei parametri riferiti agli aspetti cognitivi dei pazienti con malattia renale cronica ed ESRD[123].
Prevenzione dell'infertilità
modificaInfertilità maschile
modificaDiversi studi dimostrano l'utilità di una terapia adiuvante con l'acido folico nel maschio[124]. Infatti v'è una relazione tra subfertilità maschile e femminile con lo stato nutrizionale e vitaminico dei soggetti[125][126]; in particolare questa relazione è nota con gli alimenti ad azione antiossidante[127][128].
È dimostrata una relazione tre le alterazioni geniche per gli enzimi del metabolismo dell'acido folico e lo stato di subfertilità di maschi[129]. Nella oligospermia e/o astenospermia vi è un aumento patologico della omocisteina che è causa diretta o indiretta di alterazioni della spermatogenesi[130]. Nella oligoastenoteratozoospermia l'acido folico vanta un ruolo terapeutico insieme ad altri farmaci[131].
Inoltre, ricercatori indiani dimostrano che la mutazione del gene C677T (gene che codifica l'enzima chiave del cicli dei folati 5-MTHFR) è un fattore di rischio per l'infertilità idiopatica maschile[132]; dimostrando che i noti polimorfismi genetici per l'acido folico hanno un ruolo etiopatogenetico nell'infertilità maschile.
Una metanalisi Cochrane del 2010 condotta su dieci studi mostra che la supplementazione con acido folico e altri antiossidanti è in grado di migliorare gli indici di qualità dello sperma e i conseguenti effetti sulla fertilità, ma l'argomento richiede più robusti RCT per confermare questi dati scientifici[133].
Infertilità femminile
modificaDiversi studi dimostrano l'utilità di una terapia adiuvante con l'acido folico nella donna[134][135][136][137].
Uno studio mette in relazione la produzione di autoanticorpi verso il recettore per l'acido folico (FR) in donne con una subfertilità di dodici volte inferiore rispetto alle donne che non producono questi autoanticorpi; gli autoanticorpi agiscono impedendo il corretto assorbimento dell'acido folico[138].
In uno studio del 2010 si documenta l'utilità della supplementazione preventiva con acido folico in donne che devono sottoporsi a tecniche di fecondazione assistita (IVF)[139].
Vaginosi batterica
modificaUna ricerca condotta negli USA nel 2007 presso l'University of Alabama, Tuscaloosa su 1 521 donne (per l'86% afro-americane), mostra una correlazione inversa tra lo sviluppo di vaginosi batterica e l'assunzione di acido folico con la dieta; le conclusioni dello studio sono: Una maggiore assunzione di grassi nella dieta è associata ad aumentato rischio e gravità di vaginosi batterica, mentre la maggiore assunzione con la dieta di folati, vitamina A e calcio può diminuire il rischio di gravi vaginosi batteriche.[140]
Una ricerca canadese del 2001 trova un nesso di causalità tra la vaginosi batterica e la scarsa assunzione dei folati con la dieta, nei confronti del rischio di parto pretermine. Il nesso di causalità è giustificato da una parte con un aumento dell'omocisteina sierica, dovuta alla carenza di folati nella dieta come causa di vasculopatia deciduale. Dall'altra parte la vaginosi, conseguenza di comportamenti non salutari, che è causa di coriamnioniti che portano allo sviluppo di parto pretermine; quando entrambi presenti questi fattori, il rischio di parto pretermine è reale.[141]
Dissezione spontanea dell'arteria cervicale
modificaLa dissezione spontanea dell'arteria cervicale, che irrora la cervice uterina, è un evento raro che riconosce cause di tipo trombotico; essa è anche correlata al cattivo stato nutrizionale dei folati e del conseguente aumento della omocisteina plasmatica[142][143][144][145]; in questa patologia vi è anche come causa eziologica la variante genetica C677T che giustifica gli elevati livelli di omocisteina plasmatica circolanti presenti come causa di patologia dell'arteria cervicale.[146]
Ovaio policistico
modificaLa supplementazione di 400 µg/d o più di acido folico, come adiuvante alle terapie, migliora le risposte terapeutiche; inoltre, è dimostrata l'utilità dell'acido folico in associazione alle terapie ormonali normalmente usate[147].
Si è pure dimostrata l'utilità di questa vitamina in associazione alla terapia a base di metformina[148]. La spiegazione può essere ricercata nella capacità dell'iperomocisteina di determinare una resistenza all'insulina e ad alti livelli di androgeni[149][150].
La terapia standard dell'ovaio policistico prevede l'uso del mio-inositolo (MYO) e della metformina; la supplementazione di questi due farmaci con 400 mcg/die di acido folico migliora le percentuali di risposta alla terapia.[151]
Impieghi clinici in ambito osteo-muscolare
modificaOsteoporosi
modificaL'iperomocisteina plasmatica è riconosciuta essere un fattore di rischio indipendente per l'osteoporosi;[152][153][154] l'acido folico è stato dimostrato ridurre in modo dose-dipendente l'iperomocisteina.
Inoltre il Bone Mass Density migliora con l'assunzione di acido folico.[155][156][157][158] studi indicano una riduzione significativa delle fratture di anca e femore correlate all'assunzione di acido folico.[159][160][161]
Impieghi clinici in ambito dermatologico
modificaInvecchiamento cutaneo
modificaLa salute della pelle è funzione anche dello stato nutrizionale dei folati assunti; per il mantenimento dell'omeostasi delle cellule epiteliali, sottoposte a stress da UV, occorre incrementare l'assunzione di questa vitamina normalmente inattivata e degradata dall'esposizione solare. La perdita di acido folico si traduce in un arresto del ciclo cellulare dei cheratinociti in (S-fase), con un aumento conseguente del danno al DNA per aumento dell'incorporazione di uracile e conseguente perdita di vitalità cellulare.[162]
In una formulazione topica, associato alla creatina, l'acido folico ha mostrato di migliorare le caratteristiche biomeccaniche della pelle sottoposta a stress da UV.[163]
Impieghi clinici in ambito gastroenterologico
modificaCeliachia
modificaNella malattia celiaca la comune carenza di acido folico non trattata comporta un aumento dei livelli di omocisteina plasmatica[164]
Tra i controlli ematochimici di routine per la gestione della malattia celiaca si raccomandano: emoglobina, la ferritina e i livelli di folato plasmatici insieme alla transglutaminasi tissutale e al test degli anticorpi[165]. Sappiamo che la mancata diagnosi di enteropatia glutino dipendente è associata con deficienze vitaminiche, osteoporosi, e ricorrenti aborti prematuri. Saibeni et al.[166] hanno dimostrato che l'iperomocisteinemia contribuisce alla ricorrenza di complicazioni comuni nella malattia celiaca in soggetti di nuova diagnosi. Inoltre in soggetti adulti con una lunga storia di malattia celiaca la supplementazione di vitamine del gruppo B ha mostrato di normalizzare l'iperomocisteinemia plasmatica, con un conseguente miglioramento generale dello stato di benessere dei soggetti; suggerendo così che la supplementazione vitaminica deve essere consigliata in soggetti che assumono alimenti privi di glutine[167].
Il cardine per il corretto trattamento della malattia celiaca è l'aderenza a una dieta priva di glutine, cosa che è in grado di eliminare i sintomi della malattia in pochi mesi. Questo comporta però che i pazienti devono essere valutati per l'osteoporosi, le disfunzioni della tiroide, e le carenze di acido folico, vitamina B12, per le vitamine liposolubili e il ferro, e in modo mandatorio trattati adeguatamente in caso di carenze[168].
Sono quattro le linee guida internazionali che affrontano il ruolo dei folati nella celiachia:
- World Gastroenterology Organisation (WGO-OMGE): Celiac disease. Parigi (Francia); 2007.[169]
- National Institute for Health and Clinical Excellence (NICE). Coeliac disease. Recognition and assessment of coeliac disease. Londra (Regno Unito); 2009. (Clinical guideline; no. 86).[170]
- American Gastroenterological Association Institute (AGA). AGA Institute medical position statement on the diagnosis and management of celiac disease. Gastroenterology 2006 Dec;131(6):1977-80.[171]
- American Dietetic Association (ADA). Celiac disease (CD). Evidence-based nutrition practice guideline. Evidence based nutrition practice guideline. Chicago (IL); 2009.[172]
Tutte suggeriscono lo screening di routine per la carenza di ferro e dei folati ematici.
Malattie infiammatorie croniche intestinali
modificaElias Zintzaras mette in relazione il polimorfismo genetico dell'enzima MTHFR Nella forma MTR A2756G con la prevalenza delle malattie infiammatorie croniche dell'intestino in particolare con la IBD.[173]
Uno studio Cochrane di tipo metanalisi del 2009 chiarisce il ruolo dell'acido folico nella terapia orale per la prevenzione degli effetti collaterali da somministrazione di MTX (metotrexato) nella malattia di Crohn.[174]
Impieghi clinici in ambito neurologico
modificaIn generale bassi livelli di 5-MTHF nel liquor sono causa di ritardo psicomotorio, discinesia, atassia cerebellare e diplegia spastica[175]; l'assunzione di acido folico corregge il deficit liquorale.[176]
Malattia di Parkinson
modificaSono stati pubblicati circa 700 lavori che riguardano l'uso di acido folico nella malattia di Parkinson; questi studi chiariscono che:
- Nei pazienti con malattia di Parkinson gli elevati livelli di omocisteina non sono correlati con i livelli di folato e vitamina B12 circolanti, mentre si correlano con l'uso della levodopa[177]; questo può determinare importanti complicanze cardiovascolari in questi soggetti.
- Elevati livelli di iperomocisteinemia nel Parkinson sono causa di deterioramento neurologico[178][179], poiché il metabolismo della L-DOPA induce un aumento dei livelli plasmatici di omocisteina cosa che è motivo di aggravamento dei processi neurodegenerativi della patologia[180].
Non è stata però provata una relazione tra i polimorfismi genetici dell'enzima chiave del metabolismo dell'acido folico: 5-MTHFR, e lo stato cognitivo dei pazienti con malattia di Parkinson[181].
- Tra i pazienti con malattia di Parkinson si osservano più elevati tassi di incidenza di depressione e demenza nei soggetti con concomitante aumento patologico della omocisteina, rispetto ai pazienti con omocisteina normale[182].
- L'uso addizionale di acido folico può ridurre la progressione della malattia di Parkinson e migliorare il profilo di rischio nei confronti della malattia cardiovascolare in pazienti trattati con levodopa e con farmaci inibitori le COMT[183][184].
Corea di Huntington
modificaStudi ormai datati degli anni 1980 metterebbero in relazione i livelli di folato con la malattia di Huntington[185][186]. Più recentemente Wu J. 2006 sconfesserebbe il ruolo protettivo dell'acido folico nel trattamento della malattia di Huntington[187]; anche se è nota una correlazione tra alcuni tipi di alterazioni genomiche folato dipendenti e malattie neurologiche degenerative[188].
Terapia con antiepilettici
modificaL'acido folico potrebbe non essere in grado di ridurre il rischio di lesioni della spina bifida provocate dall'acido valproico, però può essere importante nel ridurre la gravità delle lesioni della spina bifida nei soggetti sensibili.[189]
Impieghi clinici in ambito psichiatrico
modificaIn psichiatria, in generale, la carenza di acido folico è correlata a diversi disturbi psichiatrici. Secondo diversi autori una certa percentuale di pazienti psichiatrici potrebbero trovare giovamento dalla terapia a base di acido folico[190][191][192][193].
Le cause, anche per motivi genetici, sono da ricondurre a un deficit dei folati plasmatici come spesso evidenziato nei pazienti psichiatrici. Inoltre, nei pazienti psichiatrici generalmente i sintomi sono più gravi in coloro che mostrano una carenza di acido folico plasmatico.
Spesso l'uso di farmaci che diminuiscono l'assorbimento dell'acido folico, come l'acido valproico o il litio sono causa di iperomocisteinemia patologica.
La carenza di acido folico, inoltre, determina un deficit di un suo metabolita: S-adenosilmetionina, che ha un ruolo cruciale nei meccanismi biochimici di formazione dei neurotrasmettitori cerebrali e non solo questi[190].
Autismo
modificaCostituiscono fattori di rischio episodi familiari di autismo o di altri disordini pervasivi dello sviluppo,[194] si ha un alto rischio in caso di parto pretermine e[195] con un peso, alla nascita, notevolmente inferiore la media.[196]
In effetti, esiste una certa letteratura scientifica che correla l'autismo con il deficit gestazionale di tipo nutrizionale e/o genetico di acido folico[197][198], e inoltre altri studi suggeriscono un ruolo terapeutico per l'uso di questa vitamina nei soggetti autistici.[199]
Secondo Currenti della New York State University, tra i fattori che nel tempo sono stati sospettati come ipotetica causa di autismo, vi sarebbero: autoanticorpi materni, infezioni gestazionali, esposizione a metalli pesanti, fattori epigenetici, vaccinazione antirosolia, morbillo, parotite, esposizione a campi elettromagnetici[200].[non chiaro] Una review fatta su 18 studi diversi indica che non può essere fatta con certezza una correlazione tra deficit di acido folico durante la gravidanza come eziologia dell'autismo, così come è da verificare con studi fatti appositamente, se la correzione del deficit di acido folico possa essere di giovamento in bambini con autismo[201].
In un'indagine epidemiologica, condotta su 111 bambini autistici cinesi dai 2 ai 9 anni, mostra che una minoranza di essi avevano una correlazione con deficit di alimentari, però la maggior parte di essi aveva deficit con le RDI (Dosi giornaliere raccomandate) delle vitamine: A, B6 e C, acido folico, calcio e zinco; rivelando questo deficit di assunzione una correlazione con il disturbo autistico[202].
Schizofrenia
modificaTra le cause fisiopatologiche note della schizofrenia correlate a un deficit e/o alterata funzione dell'acido folico vi sono: alterazioni della metilazione del DNA[192][203], anormalità nella trasmissione glutaminergica[204][205], alterazioni della funzione mitocondriale[206][207], deficit di folati[208][209] e iperomocisteinemia materna[210].
Una ricerca indica una correlazione tra l'aumento di IL-6 e TNF-α con i livelli di omocisteina patologici dovuti alla mutazione genica C577>T dell'enzima MTHFR[211].
Goff, et al. 2004 mettono in relazione la comparsa della sintomatologia schizofrenica con un deficit di attività della glutamato carbossipeptidasi II (GCPII), enzima chiave per l'assorbimento dell'acido folico[212]. Mentre, un gruppo di ricerca del Massachusetts General Hospital and Harvard Medical School, di Boston, mette in relazione i sintomi negativi della schizofrenia con il deficit di acido folico dovuto al deficit dell'enzima MTHFR[213].
L'uso dell'acido folico nell'ambito della terapia complementare e alternativa (CAM), sembra avere un ruolo definito e interessante, certamente meritevole di ulteriori sviluppi di ricerca[214].
Studi dell'aprile 2010 indicano il ruolo della carenza dell'acido folico nella genesi dei sintomi della schizofrenia in soggetti nati da madri con una bassa folatemia circolante durante il periodo periconcezionale.[215][216]
Depressione
modificaAd agosto 2010 sono 445 in totale le pubblicazioni (tutti i tipi) che correlano l'acido folico con la depressione.[217][218][219][220][221][222][223][224][225][226][227]
L'acido folico, infatti è noto, è fondamentale per la sintesi dei principali neurotrasmettitori noradrenalina, serotonina e dopamina, che sono carenti in corso di depressione. La carenza di acido folico è associata con le manifestazioni della depressione[228], specie quella caratterizzata da deficit cognitivi.[229]
L'acido folico ha un ruolo nella terapia della depressione: il suo uso infatti, secondo diversi autori, può trovare un vantaggioso utilizzo nei casi di: sintomi iniziali, in caso di remissione parziale, in pazienti con sintomatologia residua, o come terapia di potenziamento[230] insieme alle terapie farmacologiche a base di antidepressivi.[231]
Secondo uno studio giapponese il basso livello di folati circolanti è causa di depressione negli uomini.[232]
Uno studio australiano randomizzato in doppio cieco condotto su 300 anziani documenta del miglioramento della risposta all'antidepressivo citalopram aggiungendo 2 mg di acido folico insieme ad altre vitamine del gruppo B[233].
Uno studio olandese dimostra su 4 044 donne che: i sintomi depressivi erano associati a più breve età gestazionale e un basso peso alla nascita. I risultati di questa ricerca sottolineano l'importanza dell'assunzione dell'acido folico in particolare nelle donne che soffrono di sintomi depressivi[234].
Una linea guida del 2009 della British Association for Psychopharmacology guidelines[235], sostiene l'importanza di correggere lo stato della folatemia plasmatica dei pazienti depressi perché è noto che: il basso livello dei folati plasmatici riduce la risposta agli antidepressivi, e la supplementazione con acido folico migliora la risposta agli stessi antidepressivi pur con meccanismi non meglio noti.[236][237][238]
Nel gennaio del 2010 si è concluso uno studio australiano: il The B-VITAGE trial che ha coinvolto oltre 300 pazienti anziani affetti da depressione maggiore secondo il DSM IV. Il protocollo prevedeva l'aggiunta alla terapia antidepressiva a base di citalopram (20–40 mg) con vitamina B12 (0,4 mg) più B6 (25 mg) e acido folico (2 mg), oppure il placebo. Lo studio conclude sostenendo che la supplementazione vitaminica migliora la risposta all'antidepressivo[225].
Questo dato viene confermato successivamente da Skarupski KA, et al., 2010, su una popolazione di anziani che sono stati seguiti per oltre sette anni, dimostrando il ruolo preventivo della supplementazione con folati e vitamine del gruppo B[239].
Lazarou et al., 2010, dopo aver fatto un riesame della letteratura scientifica prodotta fino all'agosto del 2010, sostiene che pur non potendo suggerire di routine la supplementazione nei soggetti con depressione o disturbi dell'umore, questa può essere consigliata singolarmente ai soggetti con deficit di folati ematici o nei soggetti non responsivi alle comuni terapie antidepressive[240].
Un'analisi dettagliata delle sei metanalisi ci dà alcune certezze circa l'impiego dell'acido folico nei pazienti con disturbi dell'umore.
La ricerca di Taylor MJ et al. del 2004 conclude dicendo che: le evidenze disponibili sono limitate ma queste suggeriscono che l'acido folico può avere un ruolo potenziale come terapia complementare insieme ad altri trattamenti per la depressione. Oggi, però, non è chiaro se questo vale per le persone con normali livelli di folati circolanti o per quelle con deficit di folati[241].
La ricerca di Kuo HK et al. del 2005 conclude dicendo che: l'acido folico decresce i livelli di iperomocisteina che sono associati a una serie di patologie della terza età tra cui la depressione[242].
La ricerca di Lewis SJ et al. del 2006 conclude dicendo che: il deficit genetico causato dalla mutazione del gene che codifica la variante termolabile dell'enzima MTHFR CC677TT, dal momento che questo genotipo influenza il funzionamento della via metabolica dei folati, il folato o suoi derivati potrebbero essere causalmente correlati al rischio di depressione[243].
La ricerca prima di Gilbody S et al. del 2007 conclude dicendo che: la meta-analisi condotta dimostra un'associazione tra la variante MTHFR CC677TT e la depressione, la schizofrenia e il disturbo bipolare, indicando la possibilità di utilizzo dell'acido folico nella terapia e prevenzione di queste patologie psichiatriche[244].
La ricerca seconda condotta da GildodyS et al. sempre del 2007 conclude dicendo che: i livelli di folato sono più bassi nei soggetti con depressione. Si stanno accumulando prove scientifiche che il basso status di folati è associato con la depressione. Gran parte di questa prova viene da studi di caso-controllo. Occorrono però nuovi studi di coorte e soprattutto RCT studi randomizzati controllati per verificare il beneficio terapeutico dell'acido folico: essi dovranno confermare o smentire l'eventuale relazione causale[245].
Infine la ricerca di Almeida OP et al. del 2008 conclude dicendo che: esiste una relazione di tipo triangolare tra genotipo MTHFR, livelli di omocisteina e depressione, più elevati sono livelli di omocisteina più aumenta il rischio di depressione. La diminuzione di 0,19 mg/L di omocisteina del siero potrebbe ridurre del 20% la probabilità di depressione. Servono però ulteriori dati che confermino come la relazione tra omocisteina e depressione sia veramente causale[246].
Disturbo bipolare
modificaRicerche suggeriscono che una riduzione dei folati negli eritrociti si verifica in entrambe le fasi dei disturbi bipolari[247]. Si riconoscono due cause di alterazioni dei livelli di acido folico nei pazienti affetti da disturbo bipolare:
- Le mutazioni genetiche dell'enzima MTHFR (Metil-tetraido-folato-reduttasi), che trasforma l'acido folico in acido folinico, sembrano essere implicate nella genesi del disturbo, come conseguenza dell'aumento patologico dei livelli di omocisteina e una conseguente diminuzione dei folati circolanti nel plasma di questi pazienti[248].
- L'uso di acido valproico e altri farmaci stabilizzanti dell'umore è ben noto, crea seri problemi di prevenzione di malformazioni congenite nelle donne fertili affette da disturbo bipolare[249]; problemi che possono essere prevenuti con dosaggi elevati di acido folico[250].
Impieghi clinici in ambito degli organi di senso
modificaDegenerazione maculare età correlata
modificaUn supplemento nutrizionale con acido folico, piridossina e cianocobalamina diminuisce il rischio di sviluppare la degenerazione maculare retinica del 34%.[251][252][253][254][255][256]
Glaucoma
modificaRicerche condotte presso l'Università di Tor Vergata mostrerebbero un ruolo preventivo dell'acido folico nel glaucoma pseudoesfoliativo; poiché l'aumento dell'omocisteina in corso di glaucoma può essere corretto con la terapia con acido folico, è questo un fattore modificabile che si somma allo stress vascolare della pseudoesfoliazione.[257] Questo dato è confermato da altre ricerche.[258][259][260]
Perdita dell'udito
modificaAl contrario di alti livelli di assunzione di vitamina C ed E, beta-carotene e B12, l'assunzione di alte dosi di acido folico in soggetti con 60 anni o più riduce il rischio di perdita dell'udito.[261]
Uno studio australiano mette in relazione gli aumentati livelli di omocisteina con la perdita dell'udito correlata con l'età.[262] Inoltre, la perdita di folati cerebrali sembra correlata con tutta una serie di manifestazioni cliniche, tra cui la perdita dell'udito.[175]
Impieghi clinici in ambito oncologico
modificaUno studio mette in relazione l'assunzione di adeguati livelli di folati con la dieta e il rischio di cancro al polmone; suggerendo il ruolo preventivo di questi nei confronti dei deficit di metilazione dei geni di soggetti fumatori che sviluppano cancro ai polmoni.[263]
Studi clinici ed epidemiologici suggeriscono che la supplementazione e i livelli ematici di folato sono inversamente correlati all'incidenza di cancro colorettale, con una potenziale riduzione del rischio fino al 40% fra la popolazione con i livelli nel sangue più alti e quelli più bassi[264]. Nei tessuti epiteliali normali una deficienza di folato sembra predisporli ai neoplasmi, laddove come detto una supplementazione ne arresta la crescita; viceversa, nella progressione di neoplasmi preesistenti, la deficienza di folato ha un effetto inibitorio della crescita, mentre la supplementazione ne appare un fattore promotore.
Da un lato si ipotizza un ruolo protettivo nella prevenzione primaria di forme di tumore; dall'altro prove indicano che potrebbe essere causa di induzione di forme tumorali silenti. Un Report EFSA dell'aprile 2010 (Folic acid: an update on scientific developments)[265] conclude: Attualmente i dati a disposizione sono insufficienti per consentire una completa valutazione quantitativa del rischio di acido folico e cancro o per determinare se esiste una relazione dose-risposta o una soglia del livello di assunzione di acido folico associato con un potenziale rischio di cancro del colon-retto. Le evidenze attuali non mostrano un'associazione tra l'alta assunzione di acido folico e il rischio di cancro ma nemmeno si può escludere il rischio con assoluta certezza. Ciò rende necessario studiare l'epidemiologia dei tumori nelle popolazioni sottoposte a fortificazione per la prevenzione dei DTN per determinare in modo meccanicistico il rischio/benefico.
Successivamente nell'ottobre del 2010 un gruppo di ricercatori dell'University of Oxford UK raggruppati nel the B-Vitamin Treatment Trialists' Collaboration, pubblica una metanalisi di otto RCT per un totale di 37 485 pazienti studiati per un periodo di cinque anni. Le conclusioni riguardano gli aspetti cardiovascolari e gli aspetti tumorali. Le conclusioni degli autori sono: la supplementazione dietetica con acido folico è in grado di abbassare i livelli di omocisteina plasmatica; ma non ha mostrato effetti significativi nell'arco di 5 anni sugli eventi cardiovascolari o sull'incidenza di cancro o sulla mortalità generale nelle popolazioni studiate.
I risultati confermano una riduzione del 25% dei livelli di omocisteina plasmatica come conseguenza della supplementazione degli alimenti con acido folico. Però gli eventi avversi di tipo cardiovascolare non si sono modificati in modo significativo. Interessante notare come nello stesso tempo non vi è stato un aumento significativo di eventi tumorali, della mortalità per tumori e di tutte le cause di mortalità durante l'intero periodi di esame (5 anni).
Questo studio indirettamente dimostrerebbe che la supplementazione con acido folico, pur non proteggendo dall'incidenza dei tumori, non fa neppure aumentare la stessa in un'ampia popolazione come quella esaminata.
Un dato negativo è stato pubblicato da (Figueiredo JC et al, J Natl Cancer Inst 2009) dove si mette in relazione il rischio d'insorgenza di tumore alla prostata e assunzione di folati con le fonti alimentari rispetto ai supplementi addizionati con acido folico[266].
Giovannucci et al. 2010 riferisce di dati se pur preliminari, che indicherebbero un aumento della morbilità e mortalità nei soggetti che assumono supplementi vitaminici quando portatori di tumore alla prostata[267].
Displasia cervicale
modificaIl 75% delle donne sessualmente attive s'infetta con il virus HPV (papilloma virus)[268]. L'acido folico nella (neoplasia intraepiteliale cervicale) ha dimostrato di ridurre gli indici di progressione della displasia cervicale CIN. La fortificazione, obbligatoria in USA, con l'acido folico ha mostrato di cambiare l'espressione della DNA-metiltransferasi, un enzima che regola la corretta duplicazione cellulare e che sembra essere coinvolto nella evoluzione in senso pro-carcinogenetico della cervice uterina[269], infatti gli alti livelli di folati circolanti proteggono dall'ipometilazione del DNA che sembra essere l'evento iniziale del carcinoma della cervice[270][271]. Per questi motivi la supplementazione con acido folico viene suggerita nella prevenzione dal rischio di cancro della cervice uterina da HPV in soggetti esposti a questo virus[272], specie in quelle donne che hanno un CIN ≥ 2 ed esposte a ceppi di HPV-16[273].
Un altro aspetto studiato riguarda l'effetto protettivo dell'acido folico da mettere in relazione con il polimorfismo genetico per l'enzima MTHFR[274]. Pur tuttavia studi, ormai datati, non confermano la capacità dell'acido folico di far regredire lo stato del CIN nelle donne[275]; anche se negli USA l'American Cancer Society, il National Cancer Institute, e le U.S. Dietary Guidelines suggeriscono l'assunzione di adeguati livelli di acido folico e di vitamina C[276]. Infine, un lavoro della Shanxi Medical University, Taiyuan - China del 2006 conferma che la presenza di bassi livelli di acido folico sono correlati con lo sviluppo di cancro della cervice uterina in presenza del virus HPV-16[277].
Secondo alcune ricerche, la progressione della displasia cervicale è da mettere in relazione allo stato di relativa immunodepressione cellulare che si riscontra in caso di carenza di acido folico[278].
Flatley JE et al. 2009 correlano lo stato dei folati circolanti con il rischio di sviluppo di displasia cervicale per l'influenza del virus HPV sui geni DAPK, CDH1, HIC1 e altri, sono questi potenziali biomarker oncologici regolati dalla iper-metilazione del DNA; infatti, l'iper-metilazione è inversamente proporzionale ai livelli plasmatici circolanti di acido folico[279][280][281].
In definitiva le abitudini alimentari e l'assunzione di acido folico possono assumere un ruolo protettivo nei confronti delle infezioni da papilloma virus.[282][283]
Note
modifica- ^ Sigma Aldrich; rev. del 25.06.2013
- ^ Vocabolario Treccani - fòlico
- ^ a b H. Czeczot, [Folic acid in physiology and pathology], in Postepy Hig Med Dosw (Online), vol. 62, 2008, pp. 405-19, PMID 18772846.
- ^ H. Bastian, L. Wills, Lucy Wills (1888-1964): the life and research of an adventurous independent woman., in J R Coll Physicians Edinb, vol. 38, n. 1, aprile 2008, pp. 89-91, PMID 19069045.
- ^ DA. Roe, L. Wills, Lucy Wills (1888-1964). A biographical sketch., in J Nutr, vol. 108, n. 9, settembre 1978, pp. 1379-83, PMID 355606.
- ^ L. Wills, PW. Clutterbuck; BD. Evans, The Lancet, 311-314; A new factor in the production and cure of certain macrocytic anaemias., in Nutr Rev, vol. 37, n. 2, febbraio 1979, pp. 49-51, PMID 107494.
- ^ HK. Mitchell, EE. Snell; RJ. Williams; HK. Mitchell; EE. Snell; RJ. Williams, Journal of the American Chemical Society, Vol. 63, 1941: The concentration of "folic acid" by Herschel K. Mitchell, Esmond E. Snell, and Roger J. Williams., in Nutr Rev, vol. 46, n. 9, settembre 1988, pp. 324-5, PMID 3067148.
- ^ B. Shane, KJ. Carpenter; EL. Stokstad, E. L. Robert Stokstad (1913-1995)., in J Nutr, vol. 127, n. 2, febbraio 1997, pp. 199-201, PMID 9039818.
- ^ AH. JOHNSON, DJ. HUTCHISON, FOLIC ACID METABOLISM IN ANTIFOLIC-RESISTANT MUTANTS OF STREPTOCOCCUS FAECALIS., in J Bacteriol, vol. 87, aprile 1964, pp. 786-91, PMID 14137614.
- ^ . Hollinsheadja, Microbial growth on C1 compounds. The role of folat in the metabolism of Pseudomonas AM1., in Biochem J, vol. 99, n. 2, maggio 1966, pp. 389-95, PMID 4957628.
- ^ CS. Genther, JH. Roszmann; CC. Smith; RL. Kisliuk, Folate replacement by tetrahydrohomopteroate in triazine-resistant bacteria., in J Bacteriol, vol. 107, n. 2, agosto 1971, pp. 576-7, PMID 5000309.
- ^ OA. HOLTERMANN, SE. MERGENHAGEN; HR. MORGAN, Factors related to psittacosis virus (strain 6BC) growth. V. Folic acid-like factor in infected cells., in Proc Soc Exp Biol Med, vol. 100, n. 2, febbraio 1959, pp. 370-2, PMID 13634141.
- ^ JM. Scott, Folate and vitamin B12., in Proc Nutr Soc, vol. 58, n. 2, maggio 1999, pp. 441-8, PMID 10466189.
- ^ M. Fenech, The role of folic acid and Vitamin B12 in genomic stability of human cells., in Mutat Res, vol. 475, n. 1-2, aprile 2001, pp. 57-67, PMID 11295154.
- ^ S. Brustolin, R. Giugliani; TM. Félix, Genetics of homocysteine metabolism and associated disorders., in Braz J Med Biol Res, vol. 43, n. 1, gennaio 2010, pp. 1-7, PMID 19967264.
- ^ M. Righetti, [Folate metabolism dysfunction], in G Ital Nefrol, vol. 25, n. 1, pp. 32-41, PMID 18264916.
- ^ W. Herrmann, Significance of hyperhomocysteinemia., in Clin Lab, vol. 52, n. 7-8, 2006, pp. 367-74, PMID 16955635.
- ^ M. Dugdale, Anemia., in Obstet Gynecol Clin North Am, vol. 28, n. 2, giugno 2001, pp. 363-81, PMID 11430182.
- ^ MD. Lucock, M. Priestnall; I. Daskalakis; CJ. Schorah; J. Wild; MI. Levene, Nonenzymatic degradation and salvage of dietary folate: physicochemical factors likely to influence bioavailability., in Biochem Mol Med, vol. 55, n. 1, giugno 1995, pp. 43-53, PMID 7551825.
- ^ FY. Tripet, UW. Kesselring, [The stability of folic acid in solid the state as a function of temperature and humidity], in Pharm Acta Helv, vol. 50, n. 10, 1975, pp. 318-22, PMID 1197354.
- ^ B. Janković, S. Mentus, Thermal stability and nonisothermal kinetics of Folnak degradation process., in Drug Dev Ind Pharm, vol. 36, n. 8, agosto 2010, pp. 980-92, DOI:10.3109/03639041003628890, PMID 20521866.
- ^ RG. Cooper, TS. Chen; MA. King, Thermal destruction of folacin in microwave and conventional heating., in J Am Diet Assoc, vol. 73, n. 4, ottobre 1978, pp. 406-10, PMID 701671.
- ^ KA. Ristow, JF. Gregory; BL. Damron, Thermal processing effects on folacin bioavailability in liquid model food systems, liver, and cabbage., in J Agric Food Chem, vol. 30, n. 5, pp. 801-6, PMID 6815251.
- ^ MN. Riaz, M. Asif; R. Ali, Stability of vitamins during extrusion., in Crit Rev Food Sci Nutr, vol. 49, n. 4, aprile 2009, pp. 361-8, DOI:10.1080/10408390802067290, PMID 19234945.
- ^ RJ. Berry, L. Bailey; J. Mulinare; C. Bower, Fortification of flour with folic acid., in Food Nutr Bull, vol. 31, 1 Suppl, marzo 2010, pp. S22-35, PMID 20629350.
- ^ MA. Lawrence, W. Chai; R. Kara; IH. Rosenberg; J. Scott; A. Tedstone, Examination of selected national policies towards mandatory folic acid fortification., in Nutr Rev, 67 Suppl 1, maggio 2009, pp. S73-8, DOI:10.1111/j.1753-4887.2009.00164.x, PMID 19453684.
- ^ O. Dary, Nutritional interpretation of folic acid interventions., in Nutr Rev, vol. 67, n. 4, aprile 2009, pp. 235-44, DOI:10.1111/j.1753-4887.2009.00193.x, PMID 19335717.
- ^ CDC Grand Rounds: additional opportunities to prevent neural tube defects with folic acid fortification., in MMWR Morb Mortal Wkly Rep, vol. 59, n. 31, agosto 2010, pp. 980-4, PMID 20703205.
- ^ H. Blencowe, S. Cousens; B. Modell; J. Lawn, Folic acid to reduce neonatal mortality from neural tube disorders., in Int J Epidemiol, 39 Suppl 1, aprile 2010, pp. i110-21, DOI:10.1093/ije/dyq028, PMID 20348114.
- ^ RM. Pitkin, Folate and neural tube defects., in Am J Clin Nutr, vol. 85, n. 1, gennaio 2007, pp. 285S-288S, PMID 17209211.
- ^ CY. Johnson, J. Little, Folate intake, markers of folate status and oral clefts: is the evidence converging?, in Int J Epidemiol, vol. 37, n. 5, ottobre 2008, pp. 1041-58, DOI:10.1093/ije/dyn098, PMID 18583393.
- ^ PM. Ueland, S. Hustad, Homocysteine and folate status in an era of folic acid fortification: balancing benefits, risks, and B-vitamins., in Clin Chem, vol. 54, n. 5, maggio 2008, pp. 779-81, DOI:10.1373/clinchem.2008.103218, PMID 18443174.
- ^ PJ. Lupo, E. Goldmuntz; LE. Mitchell, Gene-gene interactions in the folate metabolic pathway and the risk of conotruncal heart defects., in J Biomed Biotechnol, vol. 2010, 2010, p. 630940, DOI:10.1155/2010/630940, PMID 20111745.
- ^ R. Ionescu-Ittu, AJ. Marelli; AS. Mackie; L. Pilote, Prevalence of severe congenital heart disease after folic acid fortification of grain products: time trend analysis in Quebec, Canada., in BMJ, vol. 338, 2009, pp. b1673, PMID 19436079.
- ^ AL. Moens, CJ. Vrints; MJ. Claeys; JP. Timmermans; HC. Champion; DA. Kass, Mechanisms and potential therapeutic targets for folic acid in cardiovascular disease., in Am J Physiol Heart Circ Physiol, vol. 294, n. 5, maggio 2008, pp. H1971-7, DOI:10.1152/ajpheart.91503.2007, PMID 18375715.
- ^ AC. Antony, In utero physiology: role of folic acid in nutrient delivery and fetal development., in Am J Clin Nutr, vol. 85, n. 2, febbraio 2007, pp. 598S-603S, PMID 17284762.
- ^ Analisi quantitativa fatta su Pubmed il 14 0tt. 2010
- ^ LS. Borman, RF. Branda, Nutritional folate deficiency in Chinese hamster ovary cells. I. Characterization of the pleiotropic response and its modulation by nucleic acid precursors., in J Cell Physiol, vol. 140, n. 2, agosto 1989, pp. 335-43, DOI:10.1002/jcp.1041400220, PMID 2745567.
- ^ MR. Hayden, SC. Tyagi, Homocysteine and reactive oxygen species in metabolic syndrome, type 2 diabetes mellitus, and atheroscleropathy: the pleiotropic effects of folate supplementation., in Nutr J, vol. 3, maggio 2004, p. 4, DOI:10.1186/1475-2891-3-4, PMID 15134582.
- ^ RJ. Schulz, SC. Bischoff; B. Koletzko; M. Adolph; J. Arends; K. Bauer; HK. Biesalski; SC. Bischoff; I. Blumenstein; G. Bockenheimer-Lucius; HJ. Boehles, Gastroenterology - Guidelines on Parenteral Nutrition, Chapter 15., in Ger Med Sci, vol. 7, 2009, pp. Doc13, DOI:10.3205/000072, PMID 20049077.
- ^ AT. Shamban, Current and new treatments of photodamaged skin., in Facial Plast Surg, vol. 25, n. 5, dicembre 2009, pp. 337-46, DOI:10.1055/s-0029-1243083, PMID 20024876.
- ^ P. Klivenyi, L. Vecsei, Novel therapeutic strategies in Parkinson's disease., in Eur J Clin Pharmacol, vol. 66, n. 2, febbraio 2010, pp. 119-25, DOI:10.1007/s00228-009-0742-4, PMID 19834698.
- ^ SA. Currenti, Understanding and determining the etiology of autism., in Cell Mol Neurobiol, vol. 30, n. 2, marzo 2010, pp. 161-71, DOI:10.1007/s10571-009-9453-8, PMID 19774457.
- ^ Home Page [collegamento interrotto], su torrinomedica.it.
- ^ Levofolene, su torrinomedica.it.
- ^ a b c www.iss.it (PDF), su iss.it (archiviato dall'url originale il 24 settembre 2011).
- ^ Linus Pauling Institute at Oregon State University, su lpi.oregonstate.edu.
- ^ a b (EN) ESCO Report on Analysis of Risks and Benefits of Fortification of Food with Folic Acid, in EFSA Supporting Publications, vol. 6, n. 8, 2009, pp. 3E, DOI:10.2903/sp.efsa.2009.EN-3. URL consultato il 5 maggio 2020 (archiviato dall'url originale il 15 maggio 2018).
- ^ A temporal association between folic acid fortification and an increase in colorectal cancer rates may be illuminating important biological principles: a hypothesis, Cancer Epidemiol Biomarkers Prev. 2007 Jul;16(7):1325-9, PMID 17626997
- ^ (EN) . Hurdle ADF, Barton D & Searles IH (1968) A method for measuring folate in foods and its application to a hospital diet. American Journal of Clinical Nutrition 21, 1202–1207. PMID 5686248
- ^ (EN) . Reddy MB, Love M. The impact of food processing on the nutritional quality of vitamins and minerals. Adv Exp Med Biol. 1999;459:99-106. PMID 10335371
- ^ (EN) . Day, B. P. F. and Gregory, J. F. III, Thermal stability of folic acid and 5-methyltetrahydrofolic acid in liquid model food systems, J. Food Sci., 48, 581, 1983. PMID
- ^ (EN) Wogan, G. N., Paglialunga, S., Archer, M. C., and Tannenbaum, S. R., Carcinogenicity of nitrosation products of ephedrine, sarcosine, folic acid and creatinine, Cancer Res., 35, 1981, 1975. PMID 167941
- ^ (EN) .Andrews LS, Ahmedna M, Grodner RM, Liuzzo JA, Murano PS, Murano EA, Rao RM, Shane S, Wilson PW. Food preservation using ionizing radiation. Rev Environ Contam Toxicol. 1998;154:1-53. PMID 9414630
- ^ (EN) . Hawkes, J. G. and Villota, R., Folates in foods: reactivity, stability during processing, and nutritional implications, Crit. Rev. Food Sci. Nutr., 28, 439, 1989. PMID 2692610
- ^ (EN) Ruddick, J. E., Vanderstoep, J., and Richards, J. F., Kinetics of thermal degradation of methyltetrahydrofolic acid, J. Food Sci., 45, 1019, 1980. PMID
- ^ (EN) Gregory, J. F., III, Chemical and nutritional aspects of folate research: analytical procedures, methods of folate synthesis, stability, and bioavailability of dietary folates, in Advances in Food and Nutrition Research, vol. 33, Kinsella, J. E., Ed., Academic Press, New York, 1989, PMID 2697230
- ^ (EN) Mnkeni, A. P. and Beveridge, T., Thermal destruction of 5-methyltetrahydrofolic acid in buffer and model food systems, J. Food Sci., 48, 595, 1983. PMID
- ^ (EN) . M. Johansson et al., Folates in lettuce: a pilot study. Scandinavian Journal of Food & Nutrition, Volume 51, Issue 1 2007, pages 22 - 30. PMID
- ^ (EN) Murphy M, Keating M, Boyle P, Weir DG & Scott JM (1976) The elucidation of the mechanism of folate catabolism in the rat. Biochemical and Biophysical Research Communications 71, 1017–1024. PMID 971297
- ^ (EN) McKillop et al., The effect of different cooking methods on folate retention in various foods that are amongst the major contributors to folate intake in the UK diet. British Journal of Nutrition (2002), 88, 681–688. PMID 12493090
- ^ (EN) Keagy, P. M., Stokstad, E. L. R., and Fellers, D. A., Folacin stability during bread processing and family flour storage, Cereal Chem., 52, 348, 1975. PMID
- ^ (EN) . Ford, J. E., The influence of the dissolved oxygen in milk on the stability of some vitamins towards heating and during subsequent exposure to sunlight, J. Dairy Res., 34, 239, 1967. PMID
- ^ (EN) . Chen, T. S. and Cooper, R. G., Thermal destruction of folacin: effect of ascorbic acid, oxygen, and temperature, J. Food Sci., 44, 713, 1979. PMID 701671
- ^ (EN) . Andersson, I. and Öste, R., Loss of ascorbic acid, folacin and vitamin B12, and changes in oxygen content of UHT milk. I. Introduction and methods, Milchwissenschaft, 47, 223, 1992. PMID
- ^ de Jong RJ, Verwei M, West CE, van Vliet T, Siebelink E, van den Berg H, Castenmiller JJ. Bioavailability of folic acid from fortified pasteurised and UHT-treated milk in humans. Eur J Clin Nutr. 2005 Aug;59(8):906-13. PubMed PMID 15928685
- ^ Alimenti che contengono Acido folico (Vit. B9 o M o Folacina), su www.valori-alimenti.com. URL consultato il 5 maggio 2020.
- ^ (EN) Elias Seyoum and Jacob Selhub. Properties of Food Folates Determined by Stability and Susceptibility to Intestinal Pteroylpolyglutamate Hydrolase Action. J. Nutr. 128: 1956–1960, 1998. PMID 9808649
- ^ (EN) .Winkels R. M., et al., Bioavailability of food folates is 80% of that of folic acid. Am J Clin Nutr 2007; 85:465–73. PMID 17284745
- ^ (EN) .CLIFFORD A. J. et al., Bioavailability of Food Folates and Evaluation of Food Matrix Effects with a Rat Bioassay J. Nutr. 121: 445-453, 1991. PMID 2007897
- ^ Halsted CH, The intestinal absorption of folates, in Am. J. Clin. Nutr., vol. 32, n. 4, aprile 1979, pp. 846–55, PMID 34996.
- ^ a b (EN) .Halsted C. H. The intestinal absorption of dietary folates in health and disease. J Am Coll Nutr. 1989 Dec;8(6):650-8. PMID 2695555
- ^ Kelly P, McPartlin J, Goggins M, Weir DG, Scott JM, Unmetabolized folic acid in serum: acute studies in subjects consuming fortified food and supplements, in Am. J. Clin. Nutr., vol. 65, n. 6, giugno 1997, pp. 1790–5, PMID 9174474.
- ^ (EN) .Wei MM & Gregory JF (1998) Organic acids in selected foods inhibit intestinal brush border pteroylpolyglutamate hydrolase in vitro: potential mechanism affecting the bioavailability of dietary polyglutamyl folate. Journal of Agricultural and Food Chemistry 46, 211–219. PMID 10554221
- ^ (EN) .Rosenberg IH & Godwin HA (1971) The digestion and absorption of dietary folate. Gastroenterology. 1971 Mar;60(3):445-63. PMID 4928811
- ^ (EN) Halsted C. H. The intestinal absorption of dietary folates in health and disease. J Am Coll Nutr. 1989 Dec;8(6):650-8. PMID 2695555
- ^ Colman N, Green R, Metz J, Prevention of folate deficiency by food fortification. II. Absorption of folic acid from fortified staple foods, in Am. J. Clin. Nutr., vol. 28, n. 5, maggio 1975, pp. 459–64, PMID 805518.
- ^ (EN) Devlin AM, et al.,(2000) Glutamate carboxypeptidase II: a polymorphism associated with lower levels of serum folate and hyperhomocysteinemia. Human Molecular Genetics 9, 2837–2844. PMID 11092759
- ^ (EN) Lievers KJA, et al., (2002) Influence of glutamate carboxypeptidase II (GCPII) polymorphism (1561C>T) on plasma homocysteine, folate and vitamin B12 levels and its relationship to cardiovascular disease risk. Atherosclerosis 164, 269–273. PMID 12204797
- ^ (EN) .Castenmiller JJM, et al., (2000) Bioavailability of folate from processed spinach in humans. Annals of Nutrition and Metabolism 44, 163–169. PMID 11111131
- ^ (EN) .Bhandari SD & Gregory JF (1990) Inhibition by selected food components of human and porcine intestinal pteroylpolyglutamate hydrolase activity. American Journal of Clinical Nutrition 51, 87–94. PMID 2296933
- ^ www.anmvi.it (PDF), su anmvi.it (archiviato dall'url originale il 5 ottobre 2013).
- ^ Wild C, Lehner P, Reiselhuber S, Schiller-Frühwirth I.Prevention of Neural Tube Defects: Regional Policies in Folic Acid Enrichment and Supplementation.Gesundheitswesen. 2010 Mar 2. [Epub ahead of print] PMID 20198564
- ^ L’EFSA pubblica il rapporto ESCO sui rischi e benefici dell’acido folico | Autorità europea per la sicurezza alimentare, su web.archive.org, 13 novembre 2017. URL consultato il 5 maggio 2020 (archiviato dall'url originale il 13 novembre 2017).
- ^ Burger; Alfred e Abraham, Donald J., 3, in Wiley (a cura di), Burger's medicinal chemistry and drug discovery,, vol. 4, 2003, p. 409, ISBN 0-471-37030-4.
- ^ (EN) .Purohit V, et al., Role of S-adenosylmethionine, folate, and betaine in the treatment of alcoholic liver disease: summary of a symposium. Am J Clin Nutr. 2007 Jul;86(1):14-24. PMID 17616758
- ^ Muszkat M, Bialer O, Blotnick S, Adar L, Xie HG, Ufer M, Cascorbi I, Caraco Y. Effects of folic acid supplementation on the pharmacokinetics and anticoagulant effect of warfarin: an open-label, prospective study of long-term administration in adults. Clin Ther. 2010 Feb;32(2):347-56. PubMed PMID 20206792.
- ^ Shojania AM, von Kuster K. Ordering folate assays is no longer justified for investigation of anemias, in folic acid fortified countries.BMC Res Notes. 2010 Jan 25;3:22.
- ^ Morris MS, Jacques PF, Rosenberg IH, Selhub J.Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors.Am J Clin Nutr. 2010 Mar 31. [Epub ahead of print] PMID 20357042
- ^ a b Pozharny Y, Lambertini L, Clunie G, Ferrara L, Lee MJ. Epigenetics in women's health care.Mt Sinai J Med. 2010 Mar;77(2):225-35. PMID 20309920
- ^ (EN) Genetics Home Reference, MTHFR gene, su Genetics Home Reference. URL consultato il 5 maggio 2020.
- ^ a b M Grandolfo et al., Annual Conference 2009 – Network Italiano Promozione Acido Folico per la Prevenzione Primaria di Difetti Congeniti – Organizzato dall'Istituto Superiore di Sanità - Roma, 9 ottobre 2009 ISSN 0393-5620
- ^ a b Rozen R. Genetic predisposition to hyperhomocysteinemia: deficiency of methylenetetrahydrofolate reductase (MTHFR). Thromb Haemost 1997; 78: 523-526. PMID
- ^ Copia archiviata (PDF), su iss.it. URL consultato il 2 maggio 2010 (archiviato dall'url originale il 4 marzo 2016).
- ^ Ortiz Z, Shea B, Suarez Almazor M. Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis. Cochrane Database Syst Rev. 2000 PMID
- ^ Massy ZA. Reversal of hyperhomocyst(e) inaemia in chronic renal failure-is folic or folinic acid the answer? Nephrol Dial Transplant 1999; 14: 2810-2 PMID
- ^ a b Pharmamedix: Acido Folico Acido Folico - Avvertenze (Pharmamedix)
- ^ Motulsky AG. Nutritional ecogenetics: Homocysteine related arteriosclerotic vascular disease, neural tube defects and folic acid. Am J Hum Genet. 1996; 58: 17–20.
- ^ Miller ER, Juraschek S, Pastor-Barriuso R, Bazzano LA, Appel LJ, Guallar E, Meta-Analysis of Folic Acid Supplementation Trials on Risk of Cardiovascular Disease and Risk Interaction With Baseline Homocysteine Levels, in Am J Cardiol, vol. 106, n. 4, agosto 2010, pp. 517–527, DOI:10.1016/j.amjcard.2010.03.064, PMID 20691310. URL consultato il 16 agosto 2010.
- ^ R. Clarke, J. Halsey, S. Lewington, E. Lonn, J. Armitage, JE. Manson, KH. Bønaa, JD. Spence e O. Nygård, Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals., in Arch Intern Med, vol. 170, n. 18, ottobre 2010, pp. 1622-31, DOI:10.1001/archinternmed.2010.348, PMID 20937919.
- ^ Wang X, Qin X, Demirtas H, Li J, Mao G, Huo Y, Sun N, Liu L, Xu X. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007 Jun 2;369(9576):1876-82. PMID 17544768
- ^ ER. Miller, S. Juraschek; R. Pastor-Barriuso; LA. Bazzano; LJ. Appel; E. Guallar, Meta-Analysis of Folic Acid Supplementation Trials on Risk of Cardiovascular Disease and Risk Interaction With Baseline Homocysteine Levels., in Am J Cardiol, vol. 106, n. 4, agosto 2010, pp. 517-527, DOI:10.1016/j.amjcard.2010.03.064, PMID 20691310.
- ^ B vitamins in patients with recent transient ischaemic attack or stroke in the VITAmins TO Prevent Stroke (VITATOPS) trial: a randomised, double-blind, parallel, placebo-controlled trial., in Lancet Neurol, agosto 2010, DOI:10.1016/S1474-4422(10)70187-3, PMID 20688574.
- ^ M. Lee, KS. Hong; SC. Chang; JL. Saver, Efficacy of homocysteine-lowering therapy with folic Acid in stroke prevention: a meta-analysis., in Stroke, vol. 41, n. 6, giugno 2010, pp. 1205-12, DOI:10.1161/STROKEAHA.109.573410, PMID 20413740.
- ^ Tinker SC, Cogswell ME, Devine O, Berry RJ.Folic Acid Intake Among U.S. Women Aged 15-44 Years, National Health and Nutrition Examination Survey, 2003-2006.Am J Prev Med. 2010 Mar 26. PMID 20347553
- ^ Blencowe H, Cousens S, Modell B, Lawn J. Folic acid to reduce neonatal mortality from neural tube disorders.Int J Epidemiol. 2010 Apr;39 Suppl 1:i110-21. PMID 20348114
- ^ Copia archiviata (PDF), su iss.it. URL consultato il 27 aprile 2010 (archiviato dall'url originale il 7 settembre 2012).
- ^ Copia archiviata (PDF), su iss.it. URL consultato il 2 maggio 2010 (archiviato dall'url originale il 7 settembre 2012).
- ^ https://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=eurekah&part=A52348
- ^ Burris HH, Werler MM. U.S. Provider Reported Folic Acid or Multivitamin Ordering for Non-Pregnant Women of Childbearing Age: NAMCS and NHAMCS, 2005-2006.Matern Child Health J. 2010 Mar 5. [Epub ahead of print]
- ^ Shookhoff JM, Ian Gallicano G.A new perspective on neural tube defects: Folic acid and microRNA misexpression.Genesis. 2010 Mar 12. [Epub ahead of print] PMID 20229516
- ^ Wang L, Wang F, Guan J, Le J, Wu L, Zou J, Zhao H, Pei L, Zheng X, Zhang T. Relation between hypomethylation of long interspersed nucleotide elements and risk of neural tube defects.Am J Clin Nutr. 2010 Feb 17. [Epub ahead of print] PMID 20164316
- ^ Alwan NA, Greenwood DC, Simpson NA, McArdle HJ, Cade JE. The relationship between dietary supplement use in late pregnancy and birth outcomes: a cohort study in British women. BJOG. 2010 Mar 29. PMID 20353456
- ^ Fall CH, Fisher DJ, Osmond C, Margetts BM; Maternal Micronutrient Supplementation Study Group.Multiple micronutrient supplementation during pregnancy in low-income countries: a meta-analysis of effects on birth size and length of gestation.Food Nutr Bull. 2009 Dec;30(4):S533-46. PMID 20120795
- ^ Christian P. Micronutrients, Birth Weight, and Survival.Annu Rev Nutr. 2010 Apr 23. [Epub ahead of print] PMID 20415580
- ^ Ahn E, Nava-Ocampo AA, Koren G. Multivitamin supplements for pregnant women. New insights. Can Fam Physician. 2004 May;50:705-6. PMID 1517167
- ^ van Oostrom O, de Kleijn DP, Fledderus JO, Pescatori M, Stubbs A, Tuinenburg A, Lim SK, Verhaar MC. Folic acid supplementation normalizes the endothelial progenitor cell transcriptome of patients with type 1 diabetes: a case-control pilot study. Cardiovasc Diabetol. 2009 Aug 25;8:47. PMID 19706161
- ^ Heinz J, Kropf S, Luley C, Dierkes J, Homocysteine as a risk factor for cardiovascular disease in patients treated by dialysis: a meta-analysis, in Am. J. Kidney Dis., vol. 54, n. 3, settembre 2009, pp. 478–89, DOI:10.1053/j.ajkd.2009.01.266, PMID 19359080.
- ^ Heinz J, Kropf S, Domröse U, et al., B vitamins and the risk of total mortality and cardiovascular disease in end-stage renal disease: results of a randomized controlled trial, in Circulation, vol. 121, n. 12, marzo 2010, pp. 1432–8, DOI:10.1161/CIRCULATIONAHA.109.904672, PMID 20231532.
- ^ Jamison RL, Hartigan P, Kaufman JS, et al., Effect of homocysteine lowering on mortality and vascular disease in advanced chronic kidney disease and end-stage renal disease: a randomized controlled trial, in JAMA, vol. 298, n. 10, settembre 2007, pp. 1163–70, DOI:10.1001/jama.298.10.1163, PMID 17848650.
- ^ Ebbing M, Bleie Ø, Ueland PM, et al., Mortality and cardiovascular events in patients treated with homocysteine-lowering B vitamins after coronary angiography: a randomized controlled trial, in JAMA, vol. 300, n. 7, agosto 2008, pp. 795–804, DOI:10.1001/jama.300.7.795, PMID 18714059.
- ^ Albert CM, Cook NR, Gaziano JM, et al., Effect of folic acid and B vitamins on risk of cardiovascular events and total mortality among women at high risk for cardiovascular disease: a randomized trial, in JAMA, vol. 299, n. 17, maggio 2008, pp. 2027–36, DOI:10.1001/jama.299.17.2027, PMC 2684623, PMID 18460663.
- ^ Brady CB, Gaziano JM, Cxypoliski RA, et al., Homocysteine lowering and cognition in CKD: the Veterans Affairs homocysteine study, in Am. J. Kidney Dis., vol. 54, n. 3, settembre 2009, pp. 440–9, DOI:10.1053/j.ajkd.2009.05.013, PMC 2748786, PMID 19628319.
- ^ Boxmeer JC, Set al., Seminal plasma cobalamin significantly correlates with sperm concentration in men undergoing IVF or ICSI procedures. J Androl. 2007Jul-Aug;28(4):521-7. Epub 2007 Feb 7. PMID 17287458
- ^ Forges T, et al.,Impact of folate and homocysteine metabolism on human reproductive health. Hum Reprod Update. 2007 May-Jun;13(3):225-38. Epub 2007 Feb 16. Review.PubMed PMID 17307774
- ^ Ebisch IM, et al., The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility. Hum Reprod Update. 2007 Mar-Apr;13(2):163-74. Epub 2006 Nov 11. Review. PMID 17099205
- ^ Mendiola J, Torres-Cantero AM, Vioque J, Moreno-Grau JM, Ten J, Roca M, Moreno-Grau S, Bernabeu R. Fertil Steril. 2010 Mar 1;93(4):1128-33. Epub 2009 Jan 14. PMID 19147135
- ^ Oliva A, Dotta A, Multigner L. Fertil Steril. 2009 Apr;91(4 Suppl):1536-9. Epub 2008 Nov 5. PMID 18990381
- ^ Lee HC, et al., Association study of four polymorphisms in three folate-related enzyme genes with non-obstructive male infertility. Hum Reprod. 2006 Dec;21(12):3162-70. Epub 2006 Jul 22. PMID 16861746
- ^ Ge YF, Wang CH, Ouyang LX, Shao Y, Yao B, Xia XY, Shang XJ, Huang YF. Zhonghua Nan Ke Xue. 2008 Dec;14(12):1112-4. PMID 19157234
- ^ Cavallini G. Male idiopathic oligoasthenoteratozoospermia. Asian J Androl.2006 Mar;8(2):143-57. Review. PubMed PMID 16491265
- ^ Singh K, Agrawal NK, Khanna A, Jain M, Pandey S. Reprod Sci. 2009 Aug 5. [Epub ahead of print] PMID 19657138
- ^ Ross C, Morriss A, Khairy M, Khalaf Y, Braude P, Coomarasamy A, El-Toukhy T. Reprod Biomed Online. 2010 Mar 10. [Epub ahead of print] PMID 20378409
- ^ Reyes-Engel A, Muñoz E, Gaitan MJ, Fabre E, Gallo M, Dieguez JL, Ruiz M, Morell M. Implications on human fertility of the 677C→T and 1298A→C polymorphisms of the MTHFR gene: consequences of a possible genetic selection. Mol Hum Reprod. 2002 Oct;8(10):952-7. PMID 12356947
- ^ Nilsen RM, Vollset SE, Gjessing HK, Magnus P, Meltzer HM, Haugen M, Ueland PM. Patterns and predictors of folic acid supplement use among pregnant women: the Norwegian Mother and Child Cohort Study. Am J Clin Nutr. 2006 Nov;84(5):1134-41. PMID 17093167
- ^ Forges T, Monnier-Barbarino P, Alberto JM, Guéant-Rodriguez RM, Daval JL, Guéant JL. Impact of folate and homocysteine metabolism on human reproductive health. Hum Reprod Update. 2007 May-Jun;13(3):225-38. Epub 2007 Feb 16. Review. PMID 17307774
- ^ Chavarro JE, Rich-Edwards JW, Rosner BA, Willett WC. Use of multivitamins,intake of B vitamins, and risk of ovulatory infertility. Fertil Steril. 2008 Mar;89(3):668-76. Epub 2007 Jul 10. PMID 17624345
- ^ Berrocal-Zaragoza MI, Fernandez-Ballart JD, Murphy MM, Cavallé-Busquets P, Sequeira JM, Quadros EV. Association between blocking folate receptor autoantibodies and subfertility. Fertil Steril. 2009 Apr;91(4 Suppl):1518-21. Epub 2008 Oct 23. PubMed PMID 18950755
- ^ Menezo Y, Elder K, Benkhalifa M, Dale B. DNA methylation and gene expression in IVF.Reprod Biomed Online. 2010 Mar 1. PMID 20381425
- ^ YH. Neggers, TR. Nansel, WW. Andrews, JR. Schwebke, KF. Yu, RL. Goldenberg e MA. Klebanoff, Dietary intake of selected nutrients affects bacterial vaginosis in women., in J Nutr, vol. 137, n. 9, settembre 2007, pp. 2128-33, PMID 17709453.
- ^ MS. Kramer, L. Goulet, J. Lydon, L. Séguin, H. McNamara, C. Dassa, RW. Platt, MF. Chen e H. Gauthier, Socio-economic disparities in preterm birth: causal pathways and mechanisms., in Paediatr Perinat Epidemiol, 15 Suppl 2, luglio 2001, pp. 104-23, PMID 11520404.
- ^ Arauz A, Hoyos L, Cantú C, Jara A, Martínez L, García I, Fernández Mde L, Alonso E. Mild hyperhomocysteinemia and low folate concentrations as risk factors for cervical arterial dissection. Cerebrovasc Dis. 2007;24(2-3):210-4. Epub 2007 Jun 27. PMID 17596690.
- ^ Galbussera A, Tremolizzo L, Longoni M, Facheris M, Tagliabue E, Appollonio I, Ferrarese C. Is elevated post-methionine load homocysteinaemia a risk factor for cervical artery dissection? Neurol Sci. 2006 Apr;27(1):78-9.PMID 16688606
- ^ Rosner AL.Spontaneous cervical artery dissections and implications for homocysteine.J Manipulative Physiol Ther. 2004 Feb;27(2):124-32. PMID 14970814
- ^ Gallai V, Caso V, Paciaroni M, Cardaioli G, Arning E, Bottiglieri T, Parnetti L.Mild hyperhomocyst(e) inemia: a possible risk factor for cervical artery dissection.Stroke. 2001 Mar;32(3):714-8.
- ^ Konrad C, Müller GA, Langer C, Kuhlenbäumer G, Berger K, Nabavi DG, Dziewas R, Stögbauer F, Ringelstein EB, Junker R.Plasma homocysteine, MTHFR C677T, CBS 844ins68bp, and MTHFD1 G1958A polymorphisms in spontaneous cervical artery dissections.J Neurol. 2004 Oct;251(10):1242-8. PMID 15503105.
- ^ Elnashar A, Abdelmageed E, Fayed M, Sharaf M. Clomiphene citrate and dexamethazone in treatment of clomiphene citrate-resistant polycystic ovary syndrome: a prospective placebo-controlled study. Hum Reprod. 2006 Jul;21(7):1805-8. Epub 2006 Mar 16. PMID 16543255
- ^ Kilicdag EB, Bagis T, Tarim E, Aslan E, Erkanli S, Simsek E, Haydardedeoglu B, Kuscu E. Administration of B-group vitamins reduces circulating homocysteine in polycystic ovarian syndrome patients treated with metformin: a randomized trial. Hum Reprod. 2005 Jun;20(6):1521-8. Epub 2005 Mar 24. PMID 15790610
- ^ Bayraktar F, Dereli D, Ozgen AG, Yilmaz C. Plasma homocysteine levels in polycystic ovary syndrome and congenital adrenal hyperplasia. Endocr J. 2004 Dec;51(6):601-8. PMID 15644580.
- ^ Kilicdag EB, Bagis T, Zeyneloglu HB, Tarim E, Aslan E, Haydardedeoglu B, Erkanli S. Homocysteine levels in women with polycystic ovary syndrome treated with metformin versus rosiglitazone: a randomized study. Hum Reprod. 2005 Apr;20(4):894-9. Epub 2004 Dec 23.PMID 15618250
- ^ Raffone E, Rizzo P, Benedetto VInsulin sensitiser agents alone and in co-treatment with r-FSH for ovulation induction in PCOS women.Gynecol Endocrinol. 2010 Apr;26(4):275-80. PMID 20222840
- ^ Refsum H, Nurk E, Smith AD, Ueland PM, Gjesdal CG, Bjelland I, Tverdal A, Tell GS, Nygård O, Vollset SE. The Hordaland Homocysteine Study: a community-based study of homocysteine, its determinants, and associations with disease. J Nutr. 2006 Jun;136(6 Suppl):1731S-1740S. Review. PubMed PMID 16702348.
- ^ Roblin X, Phelip JM, Genevois M, Ducros V, Bonaz B. Hyperhomocysteinaemia is associated with osteoporosis in patients with Crohn's disease. Aliment Pharmacol Ther. 2007 Apr 1;25(7):797-804. PMID 17373918
- ^ Brustolin S, Giugliani R, Félix TM. Genetics of homocysteine metabolism and associated disorders. Braz J Med Biol Res. 2010 Jan;43(1):1-7. Epub 2009 Dec 4. PubMed PMID 19967264.
- ^ Cagnacci A, Cannoletta M, Baldassari F, Volpe A. Low vitamin B12 and bone loss: a role for folate deficiency. J Clin Endocrinol Metab. 2004 Sep;89(9):4770-1; author reply 4771-2. PMID 1535609
- ^ McLean RR, Jacques PF, Selhub J, Fredman L, Tucker KL, Samelson EJ, Kiel DP,Cupples LA, Hannan MT. Plasma B vitamins, homocysteine, and their relation with bone loss and hip fracture in elderly men and women. J Clin Endocrinol Metab. 2008 Jun;93(6):2206-12. Epub 2008 Mar 25. PMID 18364381
- ^ Gjesdal CG, Vollset SE, Ueland PM, Refsum H, Drevon CA, Gjessing HK, Tell GS. Plasma total homocysteine level and bone mineral density: the Hordaland Homocysteine Study. Arch Intern Med. 2006 Jan 9;166(1):88-94. PMID 16401815
- ^ Fairfield KM, Fletcher RH. Vitamins for chronic disease prevention in adults: scientific review. JAMA. 2002 Jun 19;287(23):3116-26. Review. Erratum in: JAMA 2002 Oct 9;288(14):1720. PMID 12069675
- ^ Sato Y, Honda Y, Iwamoto J, Kanoko T, Satoh K. Effect of folate and mecobalamin on hip fractures in patients with stroke: a randomized controlled trial. JAMA. 2005 Mar 2;293(9):1082-8. Erratum in: JAMA. 2006 Jul 26;296(4):396. PMID 15741530.
- ^ Sato Y. [Immobilization and hip fracture]. Clin Calcium. 2006 Dec;16(12):1991-98. Review. Japanese. PMID 17142929
- ^ Leboff MS, Narweker R, LaCroix A, Wu L, Jackson R, Lee J, Bauer DC, Cauley J, Kooperberg C, Lewis C, Thomas AM, Cummings S. Homocysteine levels and risk of hip fracture in postmenopausal women. J Clin Endocrinol Metab. 2009 Apr;94(4):1207-13. Epub 2009 Jan 27. PMID 19174498
- ^ Williams JD, Jacobson MK. Photobiological implications of folate depletion and repletion in cultured human keratinocytes.J Photochem Photobiol B. 2010 Apr 2;99(1):49-61. Epub 2010 Feb 6. PMID 20211567
- ^ Knott A, Koop U, Mielke H, Reuschlein K, Peters N, Muhr GM, Lenz H, Wensorra U, Jaspers S, Kolbe L, Raschke T, Stäb F, Wenck H, Gallinat S.A novel treatment option for photoaged skin.J Cosmet Dermatol. 2008 Mar;7(1):15-22. PMID 18254806
- ^ .Dickey W, et al., Scand J Gastroenterol. 2008;43(6):682-8. PMID 18569985
- ^ Silvester JA, Rashid M.A Folloup Guide Lines. Can J Gastroenterol. settembre 2007, 21 (9):557-64. PMID 17853949
- ^ Saibeni S, et al., Clin Gastroenterol Hepatol. 2005 Jun;3(6):574-80. PMID 15952099
- ^ Hallert C, M Svensson, J Tholstrup, Hultberg B. Aliment Pharmacol Ecco. 2009 Apr 15; 29 (8) :811-6. Epub 2008 Gen 20.PMID 19154566
- ^ Presutti RJ, JR Cangemi, Cassidy HD, DA Hill. Celiachia. Am Fam Physician. 15 dicembre 2007; 76 (12) :1795-802. PMID 18217518
- ^ www.worldgastroenterology.org (PDF), su worldgastroenterology.org. URL consultato il 24 agosto 2010 (archiviato dall'url originale il 30 marzo 2010).
- ^ www.nice.org.uk (PDF), su nice.org.uk. URL consultato il 24 agosto 2010 (archiviato dall'url originale il 30 ottobre 2011).
- ^ AGA Institute Medical Position Statement on the Diagnosis and Management of Celiac Disease., in Gastroenterology, vol. 131, n. 6, dicembre 2006, pp. 1977-80, DOI:10.1053/j.gastro.2006.10.003, PMID 17087935.
- ^ Topic: Celiac Disease, su adaevidencelibrary.com. URL consultato il 24 agosto 2010 (archiviato dall'url originale il 27 maggio 2010).
- ^ E. Zintzaras, Genetic variants of homocysteine/folate metabolism pathway and risk of inflammatory bowel disease: a synopsis and meta-analysis of genetic association studies., in Biomarkers, vol. 15, n. 1, febbraio 2010, pp. 69-79, DOI:10.3109/13547500903297184, PMID 20085490.
- ^ V. Patel, JK. Macdonald; JW. McDonald; N. Chande, Methotrexate for maintenance of remission in Crohn's disease., in Cochrane Database Syst Rev, n. 4, 2009, pp. CD006884, DOI:10.1002/14651858.CD006884.pub2, PMID 19821390.
- ^ a b K. Hyland, J. Shoffner; SJ. Heales, Cerebral folate deficiency., in J Inherit Metab Dis, luglio 2010, DOI:10.1007/s10545-010-9159-6, PMID 20668945.
- ^ N. Gordon, Cerebral folate deficiency., in Dev Med Child Neurol, vol. 51, n. 3, marzo 2009, pp. 180-2, DOI:10.1111/j.1469-8749.2008.03185.x, PMID 19260931.
- ^ John D. Rogers, MD; Anna Sanchez-Saffon, BA; Alan B. Frol, PhD; Ramon Diaz-Arrastia, MD, PhD. Elevated Plasma Homocysteine Levels in Patients Treated With LevodopaArch Neurol. 2003;60:59-64 PMID
- ^ Thomas Mu¨ ller, MD; Kathrin Renger, MD; Wilfried Kuhn, MD. Levodopa-Associated Increase of Homocysteine Levels and Sural Axonal Neurodegeneration. Arch Neurol. 2004;61:657-660 PMID
- ^ Dos Santos EF, et al.Evidence that folic acid deficiency is a major determinant of hyperhomocysteinemia in Parkinson s disease. Metab Brain Dis. 2009 Mar 18. [Epub ahead of print] PMID
- ^ Siniscalchi A, Gallelli L, Mercuri NB, Ibbadu GF, De Sarro G.Role of lifestyle factors on plasma homocysteine levels in Parkison's disease patients treated with levodopa. Nutr Neurosci. 2006 Feb-Apr;9(1-2):11-6.
- ^ Rodriguez-Oroz MC, et al., Homocysteine and cognitive impairment in Parkinson's disease: A biochemical, neuroimaging, and genetic study.Mov Disord. 2009 May 18. [Epub ahead of print] PMID
- ^ Padraig E. O'Suilleabhain, MB, BCh; Victor Sung, BS; Carlos Hernandez, BS; Laura Lacritz, PhD; Richard B. Dewey, Jr, MD; Teodoro Bottiglieri, PhD; Ramon Diaz-Arrastia, MD, PhD. Elevated Plasma Homocysteine Level in Patients With Parkinson DiseaseArch Neurol. 2004;61:865-868 PMID
- ^ T Müller, D Woitalla, W Kuhn Benefit of folic acid supplementation in parkinsonian patients treated with levodopa J Neurol Neurosurg Psychiatry 2003;74:549–552. PMID
- ^ Triantafyllou NI, Kararizou E, Angelopoulos E, Tsounis S, Boufidou F, Evangelopoulos ME, Nikolaou C, Vassilopoulos D. The influence of levodopa and the COMT inhibitor on serum vitamin B12 and folate levels in Parkinson's disease patients.Eur Neurol. 2007;58(2):96-9. Epub 2007 Jun 12. PMID 17565222
- ^ R. Prakash, Excess of folates in Huntington's chorea: a possible etiologic link., in South Med J, vol. 78, n. 10, ottobre 1985, p. 1268, PMID 2931805.
- ^ MJ. Brennan, J. van der Westhuyzen; S. Kramer; J. Metz, Neurotoxicity of folates: implications for vitamin B12 deficiency and Huntington's chorea., in Med Hypotheses, vol. 7, n. 7, luglio 1981, pp. 919-29, PMID 6270515.
- ^ J. Wu, T. Tang; I. Bezprozvanny, Evaluation of clinically relevant glutamate pathway inhibitors in vitro model of Huntington's disease., in Neurosci Lett, vol. 407, n. 3, ottobre 2006, pp. 219-23, DOI:10.1016/j.neulet.2006.08.036, PMID 16959411.
- ^ A. Hazra, P. Kraft; R. Lazarus; C. Chen; SJ. Chanock; P. Jacques; J. Selhub; DJ. Hunter, Genome-wide significant predictors of metabolites in the one-carbon metabolism pathway., in Hum Mol Genet, vol. 18, n. 23, dicembre 2009, pp. 4677-87, DOI:10.1093/hmg/ddp428, PMID 19744961.
- ^ J. Jentink, MK. Bakker; CM. Nijenhuis; B. Wilffert; LT. de Jong-van den Berg, Does folic acid use decrease the risk for spina bifida after in utero exposure to valproic acid?, in Pharmacoepidemiol Drug Saf, vol. 19, n. 8, agosto 2010, pp. 803-7, DOI:10.1002/pds.1975, PMID 20680999.
- ^ a b (EN) .Young SN, Ghadirian AM. Folic acid and psychopathology. Prog Neuropsychopharmacol Biol Psychiatry. 1989;13(6):841-63. PMID 2682787
- ^ (EN) . Fafouti M, et al., Mood disorder with mixed features due to vitamin B(12) and folate deficiency. Gen Hosp Psychiatry. 2002 Mar-Apr;24(2):106-9. PMID 11869745
- ^ a b (EN) . Muntjewerff JW, Blom HJ. Aberrant folate status in schizophrenic patients: what is the evidence? Prog Neuropsychopharmacol Biol Psychiatry. 2005 Sep;29(7):1133-9. Review. PMID 16111796
- ^ (EN) . Roberts SH, et al., Folate augmentation of treatment - evaluation for depression (FolATED): protocol of a randomised controlled trial. BMC Psychiatry. 2007 Nov 15;7:65. Erratum in: BMC Psychiatry. 2009;9. doi: 10.1186/1471-244X-9-14. Menkes, David B [added]; Thome, Johannes [added]. PMID 18005429
- ^ Lauritsen MB, Pedersen CB, Mortensen PB., Effects of familial risk factors and place of birth on the risk of autism: a nationwide register-based study, in J Child Psychol Psychiatry., vol. 46, settembre 2005, pp. 963-971..
- ^ Schendel D, Bhasin TK., Birth weight and gestational age characteristics of children with autism, including a comparison with other developmental disabilities., in Pediatrics., vol. 121, maggio 2008, pp. 1155-1164.
- ^ Limperopoulos C, Bassan H, Sullivan NR, Soul JS, Robertson RL Jr, Moore M, Ringer SA, Volpe JJ, du Plessis AJ., Positive screening for autism in ex-preterm infants: prevalence and risk factors., in Pediatrics., vol. 121, aprile 2008, pp. 758-765.
- ^ Mohammad NS, Jain JM, Chintakindi KP, Singh RP, Naik U, Akella RR. Aberrationsin folate metabolic pathway and altered susceptibility to autism. Psychiatr Genet. 2009 Aug;19(4):171-6. PubMed PMID 19440165.
- ^ Leeming RJ, Lucock M. Autism: Is there a folate connection? J Inherit Metab Dis. 2009 Jun;32(3):400-2. Epub 2009 Mar 16. Review. PubMed PMID 19277892.
- ^ James SJ, Melnyk S, Fuchs G, Reid T, Jernigan S, Pavliv O, Hubanks A, Gaylor DW. Efficacy of methylcobalamin and folinic acid treatment on glutathione redox status in children with autism. Am J Clin Nutr. 2009 Jan;89(1):425-30. Epub 2008 Dec 3. PubMed PMID 19056591
- ^ Currenti SA. Understanding and determining the etiology of autism. Cell Mol Neurobiol. 2010 Mar;30(2):161-71. Epub 2009 Sep 23. PubMed PMID 19774457.
- ^ PA. Main, MT. Angley; P. Thomas; CE. O'Doherty; M. Fenech, Folate and methionine metabolism in autism: a systematic review., in Am J Clin Nutr, vol. 91, n. 6, giugno 2010, pp. 1598-620, DOI:10.3945/ajcn.2009.29002, PMID 20410097.
- ^ W. Xia, Y. Zhou; C. Sun; J. Wang; L. Wu, A preliminary study on nutritional status and intake in Chinese children with autism., in Eur J Pediatr, aprile 2010, DOI:10.1007/s00431-010-1203-x, PMID 20422215.
- ^ (EN) .Feng J, Fan G. The role of DNA methylation in the central nervous system and neuropsychiatric disorders. Int Rev Neurobiol. 2009;89:67-84. Review. PMID 19900616
- ^ (EN) .Fallgatter AJ, et al., DTNBP1 (dysbindin) gene variants modulate prefrontal brain function in schizophrenic patients - support for the glutamate hypothesis of schizophrenias. Genes Brain Behav. 2010 Feb 17. [Epub ahead of print] PMID 20180862
- ^ (EN) .Kiss T, Hoffmann WE, Hajós M.Delta oscillation and short-term plasticity in the rat medial prefrontal cortex: modelling NMDA hypofunction of schizophrenia.Int J Neuropsychopharmacol. 2010 Mar 25:1-14. [Epub ahead of print] PMID 20334724
- ^ (EN) . Ben-Shachar D.T he interplay between mitochondrial complex I, dopamine and Sp1 in schizophrenia. J Neural Transm. 2009 Nov;116(11):1383-96. PMID 19784753
- ^ (EN) . Rollins B, et al.,Mitochondrial variants in schizophrenia, bipolar disorder, and major depressive disorder. PLoS One. 2009;4(3):e4913. Epub 2009 Mar 17. PMID 19290059
- ^ (EN) . Haidemenos A, et al.,Plasma homocysteine, folate and B12 in chronic schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2007 Aug 15;31(6):1289-96. Epub 2007 Jun 2. PMID 17597277
- ^ (EN) . Petronijević ND, et al., Plasma homocysteine levels in young male patients in the exacerbation and remission phase of schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2008 Dec 12;32(8):1921-6. Epub 2008 Sep 15. PMID 18824063
- ^ (EN) . Zammit S, et al., Schizophrenia and neural tube defects: comparisons from an epidemiological perspective. Schizophr Bull. 2007 Jul;33(4):853-8. Epub 2006 Sep 15. PMID 16980574
- ^ (EN) . García-Miss MD, et al., Folate, homocysteine, interleukin-6, and tumor necrosis factor alfa levels, but not the methylenetetrahydrofolate reductase C677T polymorphism, are risk factors for schizophrenia.J Psychiatr Res. 2009 Nov 23. [Epub ahead of print]. PMID 19939410
- ^ (EN) . Goff D.C. , et al., Folate, Homocysteine, and Negative Symptoms in Schizophrenia. Am J Psychiatry 2004; 161:1705–1708. PMID 15337665
- ^ (EN) . Roffman JL,et al.,Contribution of methylenetetrahydrofolate reductase (MTHFR) polymorphisms to negative symptoms in schizophrenia. Biol Psychiatry. 2008 Jan 1;63(1):42-8. Epub 2007 Jun 1. PMID 17543893
- ^ (EN) . Werneke U, Turner T, Priebe S.Complementary medicines in psychiatry: review of effectiveness and safety.Br J Psychiatry. 2006 Feb;188:109-21. .PMID 16449696
- ^ Burdge GC, Lillycrop KA. Nutrition, Epigenetics, and Developmental Plasticity: Implications for Understanding Human Diseas.Annu Rev Nutr. 2010 Apr 20. [Epub ahead of print] PMID 20415585
- ^ Glaser B, Ades AE, Lewis S, Emmet P, Lewis G, Smith GD, Zammit S. Perinatal folate-related exposures and risk of psychotic symptoms in the ALSPAC birth cohort. Schizophr Res. 2010 Apr 24. [Epub ahead of print] PMID 20418067
- ^ S. Gariballa, S. Forster, Effects of dietary supplements on depressive symptoms in older patients: a randomised double-blind placebo-controlled trial., in Clin Nutr, vol. 26, n. 5, ottobre 2007, pp. 545-51, DOI:10.1016/j.clnu.2007.06.007, PMID 17662509.
- ^ SH. Roberts, E. Bedson; D. Hughes; K. Lloyd; DB. Menkes; S. Moat; M. Pirmohamed; G. Slegg; J. Thome; R. Tranter; R. Whitaker, Folate augmentation of treatment - evaluation for depression (FolATED): protocol of a randomised controlled trial., in BMC Psychiatry, vol. 7, 2007, p. 65, DOI:10.1186/1471-244X-7-65, PMID 18005429.
- ^ MA. Gosney, MF. Hammond; A. Shenkin; S. Allsup, Effect of micronutrient supplementation on mood in nursing home residents., in Gerontology, vol. 54, n. 5, 2008, pp. 292-9, DOI:10.1159/000131886, PMID 18463429.
- ^ AH. Ford, L. Flicker; J. Thomas; P. Norman; K. Jamrozik; OP. Almeida, Vitamins B12, B6, and folic acid for onset of depressive symptoms in older men: results from a 2-year placebo-controlled randomized trial., in J Clin Psychiatry, vol. 69, n. 8, agosto 2008, pp. 1203-9, PMID 18557664.
- ^ GJ. Hankey, A. Algra; C. Chen; MC. Wong; R. Cheung; L. Wong; I. Divjak; J. Ferro; G. de Freitas; J. Gommans; S. Groppa, VITATOPS, the VITAmins TO prevent stroke trial: rationale and design of a randomised trial of B-vitamin therapy in patients with recent transient ischaemic attack or stroke (NCT00097669) (ISRCTN74743444)., in Int J Stroke, vol. 2, n. 2, maggio 2007, pp. 144-50, DOI:10.1111/j.1747-4949.2007.00111.x, PMID 18705976.
- ^ G. Resler, R. Lavie; J. Campos; S. Mata; M. Urbina; A. García; R. Apitz; L. Lima, Effect of folic acid combined with fluoxetine in patients with major depression on plasma homocysteine and vitamin B12, and serotonin levels in lymphocytes., in Neuroimmunomodulation, vol. 15, n. 3, 2008, pp. 145-52, DOI:10.1159/000151527, PMID 18716414.
- ^ PS. Aisen, LS. Schneider; M. Sano; R. Diaz-Arrastia; CH. van Dyck; MF. Weiner; T. Bottiglieri; S. Jin; KT. Stokes; RG. Thomas; LJ. Thal, High-dose B vitamin supplementation and cognitive decline in Alzheimer disease: a randomized controlled trial., in JAMA, vol. 300, n. 15, ottobre 2008, pp. 1774-83, DOI:10.1001/jama.300.15.1774, PMID 18854539.
- ^ C. Hallert, M. Svensson; J. Tholstrup; B. Hultberg, Clinical trial: B vitamins improve health in patients with coeliac disease living on a gluten-free diet., in Aliment Pharmacol Ther, vol. 29, n. 8, aprile 2009, pp. 811-6, DOI:10.1111/j.1365-2036.2009.03945.x, PMID 19154566.
- ^ a b AH. Ford, L. Flicker; K. McCaul; F. van Bockxmeer; S. Hegarty; V. Hirani; S. Fenner; OP. Almeida, The B-VITAGE trial: a randomized trial of homocysteine lowering treatment of depression in later life., in Trials, vol. 11, 2010, p. 8, DOI:10.1186/1745-6215-11-8, PMID 20096138.
- ^ G. Buhr, CW. Bales, Nutritional supplements for older adults: review and recommendations--Part II., in J Nutr Elder, vol. 29, n. 1, gennaio 2010, pp. 42-71, DOI:10.1080/01639360903586464, PMID 20391042.
- ^ RC. Shelton, O. Osuntokun; AN. Heinloth; SA. Corya, Therapeutic options for treatment-resistant depression., in CNS Drugs, vol. 24, n. 2, febbraio 2010, pp. 131-61, DOI:10.2165/11530280-000000000-00000, PMID 20088620.
- ^ (EN) . Fava M. Nutrition and depression: the role of folate. Nutr Rev. 1997;55(5):145–149. PMID 9212690
- ^ (EN) . Ramos MI, Allen LH, Mungas DM, et al. Low folate status is associated with impaired cognitive function and dementia in the Sacramento Area Latino Study on Aging. Am J Clin Nutr.2005;82(6):1346–1352. PMID 16332669
- ^ (EN) .M. Fava, Augmenting Antidepressants With Folate: A Clinical Perspective. J Clin Psychiatry 2007;68[suppl 10]:4–7. PMID 17900202
- ^ (EN) . Coppen A, Bailey J. Enhancement of the antidepressant action of fluoxetine by folic acid: a randomized, placebo controlled trial. J Affect Disord. 2000;60(2):121–130. PMID 10967371
- ^ Nanri A, Mizoue T, Matsushita Y, Sasaki S, Ohta M, Sato M, Mishima N. Serum folate and homocysteine and depressive symptoms among Japanese men and women. Eur J Clin Nutr. 2010 Mar;64(3):289-96. Epub 2010 Jan 20. PMID 20087384
- ^ Ford AH, Flicker L, McCaul K, van Bockxmeer F, Hegarty S, Hirani V, Fenner S, Almeida OP. The B-VITAGE trial: a randomized trial of homocysteine lowering treatment of depression in later life. Trials. 2010 Jan 25;11:8. PMID 20096138
- ^ AE. Van Dijk, M. Van Eijsden; K. Stronks; RJ. Gemke; TG. Vrijkotte, Maternal depressive symptoms, serum folate status, and pregnancy outcome: results of the Amsterdam Born Children and their Development study., in Am J Obstet Gynecol, settembre 2010, DOI:10.1016/j.ajog.2010.07.017, PMID 20833384.
- ^ IM. Anderson, IN. Ferrier; RC. Baldwin; PJ. Cowen; L. Howard; G. Lewis; K. Matthews; RH. McAllister-Williams; RC. Peveler; J. Scott; A. Tylee, Evidence-based guidelines for treating depressive disorders with antidepressants: a revision of the 2000 British Association for Psychopharmacology guidelines., in J Psychopharmacol, vol. 22, n. 4, giugno 2008, pp. 343-96, DOI:10.1177/0269881107088441, PMID 18413657.
- ^ Gilbody, S, Lightfoot, T, Sheldon, T. (2007a) Is low folate a risk factor for depression? A meta-analysis and exploration of heterogeneity. J Epidemiol Community Health 61: 631–637 PMID
- ^ Papakostas, GI, Petersen, T, Mischoulon, D, Ryan, JL, Nierenberg, AA, Bottiglieri, T, Rosenbaum, JF, Alpert, JE, Fava, M. (2004) Serum folate, vitamin B12, and homocysteine in major depressive disorder, Part 1: predictors of clinical response in fluoxetineresistant depression. J Clin Psychiatry 65: 1090–1095 PMID
- ^ Taylor, MJ, Carney, S, Geddes, J, Goodwin, G. (2003) Folate for depressive disorders. Cochrane Database Syst Rev 2: CD003390. doi: 10.1002/14651858.CD003390
- ^ KA. Skarupski, C. Tangney; H. Li; B. Ouyang; DA. Evans; MC. Morris, Longitudinal association of vitamin B-6, folate, and vitamin B-12 with depressive symptoms among older adults over time., in Am J Clin Nutr, vol. 92, n. 2, agosto 2010, pp. 330-5, DOI:10.3945/ajcn.2010.29413, PMID 20519557.
- ^ C. Lazarou, M. Kapsou, The role of folic acid in prevention and treatment of depression: an overview of existing evidence and implications for practice., in Complement Ther Clin Pract, vol. 16, n. 3, agosto 2010, pp. 161-6, DOI:10.1016/j.ctcp.2010.01.003, PMID 20621278.
- ^ MJ. Taylor, SM. Carney; GM. Goodwin; JR. Geddes, Folate for depressive disorders: systematic review and meta-analysis of randomized controlled trials., in J Psychopharmacol, vol. 18, n. 2, giugno 2004, pp. 251-6, DOI:10.1177/0269881104042630, PMID 15260915.
- ^ HK. Kuo, FA. Sorond; JH. Chen; A. Hashmi; WP. Milberg; LA. Lipsitz, The role of homocysteine in multisystem age-related problems: a systematic review., in J Gerontol A Biol Sci Med Sci, vol. 60, n. 9, settembre 2005, pp. 1190-201, PMID 16183962.
- ^ SJ. Lewis, DA. Lawlor; G. Davey Smith; R. Araya; N. Timpson; IN. Day; S. Ebrahim, The thermolabile variant of MTHFR is associated with depression in the British Women's Heart and Health Study and a meta-analysis., in Mol Psychiatry, vol. 11, n. 4, aprile 2006, pp. 352-60, DOI:10.1038/sj.mp.4001790, PMID 16402130.
- ^ S. Gilbody, S. Lewis; T. Lightfoot, Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review., in Am J Epidemiol, vol. 165, n. 1, gennaio 2007, pp. 1-13, DOI:10.1093/aje/kwj347, PMID 17074966.
- ^ S. Gilbody, T. Lightfoot; T. Sheldon, Is low folate a risk factor for depression? A meta-analysis and exploration of heterogeneity., in J Epidemiol Community Health, vol. 61, n. 7, luglio 2007, pp. 631-7, DOI:10.1136/jech.2006.050385, PMID 17568057.
- ^ OP. Almeida, K. McCaul; GJ. Hankey; P. Norman; K. Jamrozik; L. Flicker, Homocysteine and depression in later life., in Arch Gen Psychiatry, vol. 65, n. 11, novembre 2008, pp. 1286-94, DOI:10.1001/archpsyc.65.11.1286, PMID 18981340.
- ^ Hasanah CI, Khan UA, Musalmah M, Razali SM. Reduced red-cell folate in mania. J Affect Disord 1997; 46:95-99 PMID
- ^ (EN) .Ozbek Z, et al., Effect of the methylenetetrahydrofolate reductase gene polymorphisms on homocysteine, folate and vitamin B12 in patients with bipolar disorder and relatives. Prog Neuropsychopharmacol Biol Psychiatry. 2008 Jul 1;32(5):1331-7. Epub 2008 May 2. PMID 18513846
- ^ (EN) .Kennedy D, Koren G. Valproic acid use in psychiatry: issues in treating women of reproductive age. J Psychiatry Neurosci. 1998 Sep;23(4):223-8. PMID 9785701
- ^ A. H. Behzadi, et al., Folic acid efficacy as an alternative drug added to sodium valproate in the treatment of acute phase of mania in bipolar disorder: a double-blind randomized controlled trial. Acta Psychiatr Scand 2009: 1–5. DOI 10.1111/j.1600-0447.2009.01368.x
- ^ (EN) Christen WG, et al. Folic acid, pyridoxine, and cyanocobalamin combination treatment and age-related macular degeneration in women: the Women's Antioxidant and Folic Acid Cardiovascular Study. Arch Intern Med. 2009 Feb 23;169(4):335-41. PMID 19237716
- ^ B vitamins may be "silver bullet" for age-related macular degeneration. Daily supplementation with folic acid plus vitamins B6 and B12 may reduce risk of AMD by 35-40 percent., in Duke Med Health News, vol. 15, n. 5, maggio 2009, pp. 8-9, PMID 19743542.
- ^ (EN) Rochtchina E, et al. Elevated serum homocysteine, low serum vitamin B12, folate, and age-related macular degeneration: the Blue Mountains Eye Study. Am J Ophthalmol. 2007 Feb;143(2):344-6. PMID 17258528
- ^ (EN) Kamburoglu G, et al. Plasma homocysteine, vitamin B12 and folate levels in age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol. 2006 May;244(5):565-9. PMID 16163497
- ^ (PL) Nowak M, et al. Blood concentration of homocysteine, vitamin B (12), and folic acid in patients with exudative age related macular degeneration. Klin Oczna. 2004;106(3 Suppl):429-30. PMID 15636225
- ^ (EN) Chen B, et al. Vascular and cellular targeting for photodynamic therapy. Crit Rev Eukaryot Gene Expr. 2006;16(4):279-305. Review. PMID 17206921
- ^ L. Tranchina, M. Centofanti; F. Oddone; L. Tanga; G. Roberti; L. Liberatoscioli; C. Cortese; G. Manni, Levels of plasma homocysteine in pseudoexfoliation glaucoma., in Graefes Arch Clin Exp Ophthalmol, agosto 2010, DOI:10.1007/s00417-010-1487-6, PMID 20740289.
- ^ B. Turgut, M. Kaya; S. Arslan; T. Demir; M. Güler; MK. Kaya, Levels of circulating homocysteine, vitamin B6, vitamin B12, and folate in different types of open-angle glaucoma., in Clin Interv Aging, vol. 5, 2010, pp. 133-9, PMID 20458351.
- ^ T. Cumurcu, S. Sahin; E. Aydin, Serum homocysteine, vitamin B 12 and folic acid levels in different types of glaucoma., in BMC Ophthalmol, vol. 6, 2006, p. 6, DOI:10.1186/1471-2415-6-6, PMID 16504073.
- ^ AP. King, PK. Tai; C. Carter-Su, Cytochalasin B interferes with conformational changes of the human erythrocyte glucose transporter induced by internal and external sugar binding., in Biochemistry, vol. 30, n. 49, dicembre 1991, pp. 11546-53, PMID 1747373.
- ^ Shargorodsky J, Curhan SG, Eavey R, Curhan GC. A prospective study of vitamin intake and the risk of hearing loss in men.Otolaryngol Head Neck Surg. 2010 Feb;142(2):231-6. PMID 20115980
- ^ B. Gopinath, VM. Flood; E. Rochtchina; CM. McMahon; P. Mitchell, Serum homocysteine and folate concentrations are associated with prevalent age-related hearing loss., in J Nutr, vol. 140, n. 8, agosto 2010, pp. 1469-74, DOI:10.3945/jn.110.122010, PMID 20573942.
- ^ Stidley CA, Picchi MA, Leng S, Willink R, Crowell RE, Flores KG, Kang H, Byers T, Gilliland FD, Belinsky SA. Multivitamins, folate, and green vegetables protect against gene promoter methylation in the aerodigestive tract of smokers. Cancer Res. 2010 Jan 15;70(2):568-74. Epub 2010 Jan 12. PMID 20068159.
- ^ Role of folate in colon cancer development and progression, J Nutr. 2003 Nov;133(11 Suppl 1):3731S-3739S, PMID 14608107
- ^ null Folic acid: an update on scientific developments, su efsa.europa.eu (archiviato dall'url originale l'8 ottobre 2010).
- ^ Figueiredo JC, Grau MV, Haile RW, et al., Folic acid and risk of prostate cancer: results from a randomized clinical trial, in J. Natl. Cancer Inst., vol. 101, n. 6, marzo 2009, pp. 432–5, DOI:10.1093/jnci/djp019, PMC 2657096, PMID 19276452.
- ^ E. Giovannucci, AT. Chan, Role of Vitamin and Mineral Supplementation and Aspirin Use in Cancer Survivors., in J Clin Oncol, agosto 2010, DOI:10.1200/JCO.2009.27.3219, PMID 20697066.
- ^ Fonte: Ist. Sup. Sanità
- ^ Piyathilake CJ, Celedonio JE, Macaluso M, Bell WC, Azrad M, Grizzle WE. Mandatory fortification with folic acid in the United States is associated with increased expression of DNA methyltransferase-1 in the cervix. Nutrition. 2008 Jan;24(1):94-9. PMID 18065205
- ^ Fowler BM, Giuliano AR, Piyathilake C, Nour M, Hatch K. Hypomethylation in cervical tissue: is there a correlation with folate status? Cancer Epidemiol Biomarkers Prev. 1998 Oct;7(10):901-6. PMID 9796635
- ^ Piyathilake CJ, Macaluso M, Alvarez RD, Bell WC, Heimburger DC, Partridge EE. Cancer Prev Res (Phila Pa). 2009 Jul;2(7):658-64. Epub 2009 Jun 19.PMID 19542191
- ^ Piyathilake CJ.Update on micronutrients and cervical dysplasia. Ethn Dis. 2007 Spring;17(2 Suppl 2):S2-14-7. PMID 17684808
- ^ Piyathilake CJ, Macaluso M, Brill I, Heimburger DC, Partridge EE. Lower red blood cell folate enhances the HPV-16-associated risk of cervical intraepithelial neoplasia.Nutrition. 2007 Mar;23(3):203-10. Epub 2007 Feb 1. PMID 17276035.
- ^ Piyathilake CJ, Azrad M, Macaluso M, Johanning GL, Cornwell PE, Partridge EE, Heimburger DC. Protective association of MTHFR polymorphism on cervical intraepithelial neoplasia is modified by riboflavin status. Nutrition. 2007Mar;23(3):229-35. Epub 2007 Feb 14. PMID 17303386
- ^ Childers JM, Chu J, Voigt LF, Feigl P, Tamimi HK, Franklin EW, Alberts DS, Meyskens FL Jr. Chemoprevention of cervical cancer with folic acid: a phase III Southwest Oncology Group Intergroup study. Cancer Epidemiol Biomarkers Prev. 1995 Mar;4(2):155-9. PMID 7742723.
- ^ VanEenwyk J, Davis FG, Colman N. Folate, vitamin C, and cervical intraepithelial neoplasia. Cancer Epidemiol Biomarkers Prev. 1992 Jan-Feb;1(2):119-24. PMID 1306093.
- ^ Wang JT, Ma XC, Cheng YY, Ding L, Zhou Q. A case-control study on the association between folate and cervical cancer. Zhonghua Liu Xing Bing Xue Za Zhi. 2006 May;27(5):424-7.PMID 16981341.
- ^ F. Abike, AB. Engin; I. Dunder; OL. Tapisiz; C. Aslan; L. Kutluay, Human papilloma virus persistence and neopterin, folate and homocysteine levels in cervical dysplasias., in Arch Gynecol Obstet, agosto 2010, DOI:10.1007/s00404-010-1650-7, PMID 20740364.
- ^ JE. Flatley, K. McNeir; L. Balasubramani; J. Tidy; EL. Stuart; TA. Young; HJ. Powers, Folate status and aberrant DNA methylation are associated with HPV infection and cervical pathogenesis., in Cancer Epidemiol Biomarkers Prev, vol. 18, n. 10, ottobre 2009, pp. 2782-9, DOI:10.1158/1055-9965.EPI-09-0493, PMID 19755648.
- ^ D. Iliopoulos, P. Oikonomou; I. Messinis; A. Tsezou, Correlation of promoter hypermethylation in hTERT, DAPK and MGMT genes with cervical oncogenesis progression., in Oncol Rep, vol. 22, n. 1, luglio 2009, pp. 199-204, PMID 19513524.
- ^ F. Lattario, YL. Furtado; R. Fonseca; FA. Silveira; IC. do Val; G. Almeida; MG. Carvalho, Analysis of human papillomavirus and Epstein-Barr virus infection and aberrant death-associated protein kinase methylation in high-grade squamous intraepithelial lesions., in Int J Gynecol Cancer, vol. 18, n. 4, pp. 785-9, DOI:10.1111/j.1525-1438.2007.01060.x, PMID 17868341.
- ^ Castle PE, Giuliano AR, Chapter 4: Genital tract infections, cervical inflammation, and antioxidant nutrients--assessing their roles as human papillomavirus cofactors, in J. Natl. Cancer Inst. Monographs, n. 31, 2003, pp. 29–34, PMID 12807942.
- ^ Kwaśniewska A, Tukendorf A, Semczuk M, Folate deficiency and cervical intraepithelial neoplasia, in Eur. J. Gynaecol. Oncol., vol. 18, n. 6, 1997, pp. 526–30, PMID 9443028.
Bibliografia
modifica- Mariani Costantini, Aldo. e Tomassi, Gianni., Fondamenti di nutrizione umana, Il pensiero scientifico, 1999, ISBN 88-7002-847-X, OCLC 849259753.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su acido folico
Collegamenti esterni
modifica- folico, acido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) folic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Acido folico, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- Società Italiana di Nutrizione Umana, su sinu.it. URL consultato il 18 ottobre 2004 (archiviato dall'url originale il 12 gennaio 2012).
- Acido folico, alimentazione e Spina bifida, su spinabifidaitalia.it. URL consultato il 13 novembre 2009 (archiviato dall'url originale l'11 novembre 2009).
- Inran.it.
- Ist. Superiore della Sanità - Epicentro - Pagina: Ac. Folico, su epicentro.iss.it.
- (EN) CDC - Folic Acid Homepage - NCBDDD, su cdc.gov.
- (EN) NIH - Dietary Supplement Fact Sheet: Folate, su ods.od.nih.gov.
| Controllo di autorità | Thesaurus BNCF 14063 · LCCN (EN) sh85143995 · GND (DE) 4121288-5 · J9U (EN, HE) 987007543706805171 · NDL (EN, JA) 00574353 |
|---|