Dicloruro di titanocene
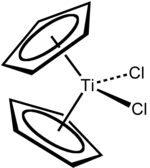
Dicloruro di titanocene è il nome comune del composto organometallico con formula (η5-C5H5)2TiCl2, in genere abbreviato come Cp2TiCl2. In condizioni normali è un solido di colore rosso vivo, stabile all'aria.[2] Il composto è disponibile in commercio e costituisce la base di partenza per moltissimi derivati contenenti il frammento Cp2Ti2+. Il dicloruro di titanocene mostra anche attività antitumorali ed è stato il primo complesso non di platino ad essere impiegato in studi clinici come chemioterapico.[3]
| Dicloruro di titanocene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diclorobis(η5-2,4-ciclopentadienil)titanio | |
| Nomi alternativi | |
| Dicloruro di bis(η5-ciclopentadienil)titanio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H10Cl2Ti |
| Massa molecolare (u) | 248,96 |
| Aspetto | solido rosso vivo |
| Numero CAS | |
| Numero EINECS | 215-035-9 |
| PubChem | 5284468, 129728770, 53384597 e 76030824 |
| SMILES | [cH-]1cccc1.[cH-]1cccc1.[Cl-].[Cl-].[Ti+4] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,6[1] |
| Temperatura di fusione | 260-280 °C (dec)[1] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 25 (intraperitoneale, ratto)[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 - 335 |
| Consigli P | 261 |
Nomenclatura
modificaIl nome dicloruro di titanocene deriva dal fatto che il composto Cp2TiCl2 è impropriamente considerato un metallocene dato che contiene due anelli ciclopentadienilici. In base alla nomenclatura IUPAC, tuttavia, il termine metallocene va riservato ai complessi dove un metallo di transizione è legato solo a due anelli ciclopentadienilici tra loro paralleli, come succede ad esempio nel ferrocene.[4]
Storia
modificaIl composto Cp2TiCl2 fu descritto per la prima volta nel 1954 da G. Wilkinson e J. G. Birmingham.[5] Wilkinson ricevette il Premio Nobel per la chimica nel 1973 per i contributi dati alla chimica metallorganica sui composti a sandwich.
Struttura molecolare e configurazione elettronica
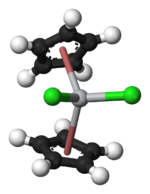
modificaIl composto cristallizza nel sistema triclino, gruppo spaziale P1, con costanti di reticolo a = 788, b = 195, c = 122 pm, α = 90,5, β = 102,6 e γ = 143,5°, quattro unità di formula per cella elementare. Ciascun anello Cp è coordinato in modo η5. La coordinazione del titanio risulta approssimativamente tetraedrica rispetto alla posizione del centro dei due anelli Cp e dei due atomi di cloro.[6]
Sintesi
modificaIl composto Cp2TiCl2 si prepara a partire dal tetracloruro di titanio, seguendo la procedura originariamente sviluppata da Wilkinson e Birmingham:[5]
- 2NaC5H5 + TiCl4 → (C5H5)2TiCl2 + 2NaCl
La reazione è condotta in tetraidrofurano. Lavaggi con acido cloridrico servono per convertire a dicloruro possibili derivati idrolizzati. Ricristallizzando da toluene si ottengono cristalli aghiformi.
Cp2TiCl2 si può preparare anche con ciclopentadiene distillato di fresco:
- 2C5H6 + TiCl4 → (C5H5)2TiCl2 + 2HCl
Questa reazione è condotta in tetraidrofurano sotto atmosfera inerte. Il prodotto è purificato usando un estrattore Soxhlet e toluene come solvente.[7]
Reattività
modificaCp2TiCl2 è un composto a 16 elettroni ed è quindi piuttosto reattivo. Gli atomi di cloro possono essere sostituiti facilmente da molti nucleofili sia organici che inorganici, senza alterare sostanzialmente l'unità Cp2Ti2+ e la geometria del complesso.[2] Alcuni esempi sono:
- Il reattivo di Petasis, Cp2TiMe2, che si ottiene facendo reagire Cp2TiCl2 con cloruro di metilmagnesio[8] o metillitio.[9] Questo reattivo è utile per convertire esteri in eteri vinilici.
- Il reattivo di Tebbe, Cp2TiCl(CH2)AlMe2, ottenuto trattando Cp2TiCl2 con due equivalenti di trimetilalluminio.[10][11]
- Il pentasolfuro di titanocene, Cp2TiS5, che si ottiene trattando Cp2TiCl2 con polisolfuri, ed è precursore di specie cicliche di zolfo di varie dimensioni.[12]
Riducendo Cp2TiCl2 con reattivi di Grignard, reattivi di organo-litio o altri riducenti si ottengono specie di Ti(III) o Ti(II), come schematizzato negli esempi seguenti:[13]
- Cp2TiCl2 + 2CO + Mg → Cp2Ti(CO)2 + MgCl2
- Cp2TiCl2 + 2PR3 + Mg → Cp2Ti(PR3)2 + MgCl2
- Cp2TiCl2 + 2Me3SiCCSiMe3 + Mg → Cp2TiMe3SiCCSiMe3 + MgCl2
- Cp2TiCl2 + LiCH(SiMe3)2 → Cp2TiCl
- Cp2TiCl2 + 2LiCH(SiMe3)2 → Cp2TiCH(SiMe3)2
Usi in medicina
modificaCp2TiCl2 è stato studiato come medicinale antitumorale.[14] È stato il primo complesso metallico non di platino e il primo "metallocene" ad essere impiegato in studi clinici.[3] Il meccanismo d'azione non è del tutto chiaro, ma si pensa che sia implicata una interazione tra il composto e la proteina transferrina.[3][15]
Tossicità / Indicazioni di sicurezza
modificaCp2TiCl2 è disponibile in commercio. Il composto è irritante per le vie respiratorie e per contatto con la pelle. Non ci sono evidenze di effetti cancerogeni. Non sono disponibili dati su effetti ambientali.[1]
Note
modifica- ^ a b c d Sigma-Aldrich
- ^ a b Greenwood e Earnshaw 1997
- ^ a b c Roat-Malone 2007, pp. 19-20.
- ^ IUPAC 2014
- ^ a b Wilkinson e Birmingham 1954
- ^ Clearfield et al. 1975
- ^ Birmingham 1965
- ^ Payack et al. 2002
- ^ Clauss e Bestian 1962
- ^ Herrmann 1982
- ^ Straus 2000
- ^ Cotton et al. 1999
- ^ Mintz 2006
- ^ Knox e McGowan 2004
- ^ Waern et al. 2005
Bibliografia
modifica- J. M. Birmingham, Synthesis of Cyclopentadienyl Metal Compounds, in Adv. Organomet. Chem., vol. 2, 1965, pp. 365-413, DOI:10.1016/S0065-3055(08)60082-9. URL consultato l'11 marzo 2014.
- K. Clauss e H. Bestian, Über die Einwirkung von Wasserstoff auf einige metallorganische Verbindungen und Komplexe, in Justus Liebigs Ann. Chem., vol. 654, n. 1, 1962, pp. 8-19, DOI:10.1002/jlac.19626540103. URL consultato l'11 marzo 2014.
- A. Clearfield, D. K. Warner, C. H. Saldarriaga-Molina, R. Ropal e I. Bernal, Structural Studies of (π-C5H5)2 MX2 Complexes and their Derivatives. The Structure of Bis(π-cyclopentadienyl)titanium Dichloride, in Can. J. Chem., vol. 53, n. 11, 1975, pp. 1622-1629, DOI:10.1139/v75-228. URL consultato l'11 marzo 2014.
- (EN) F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0-471-19957-1.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- W.A. Herrmann, The Methylene Bridge, in Adv. Organomet. Chem., vol. 20, 1982, pp. 159-263, DOI:10.1016/S0065-3055(08)60522-5. URL consultato l'11 marzo 2014.
- IUPAC, Metallocenes, su IUPAC Goldbook, 2014. URL consultato l'11 marzo 2014.
- R. J. Knox e P. C. McGowan, Metallocenes as Anti-Tumour Reagents, in International patent application, WO 2004/005305.
- (EN) E. A. Mintz, Titanium: Organometallic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia247, ISBN 978-0-470-86210-0.
- J. F. Payack, D. L. Hughes, D. Cai, I. F. Cottrell e T. R. Verhoeven, Dimethyltitanocene, in Org. Synth., vol. 79, 2002, p. 19, DOI:10.15227/orgsyn.079.0019. URL consultato l'11 marzo 2014.
- (EN) R. M. Roat-Malone, Bioinorganic Chemistry: A Short Course, 2ª ed., John Wiley & Sons, 2007, ISBN 978-0-471-76113-6.
- Sigma-Aldrich, Scheda di dati di sicurezza del Bis(cyclopentadienyl)titanium(IV) dichloride, 2011.
- (EN) D. A. Straus, μ-Chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium, in Encyclopedia of Reagents for Organic Synthesis, London, John Wiley, 2000.
- J. B. Waern, H. H. Harris, B. Lai, Z. Cai, M. M. Harding e C. T. Dillon, Intracellular Mapping of the Distribution of Metals Derived from the Antitumor Metallocenes, in J. Biol. Inorg. Chem., vol. 10, n. 5, 2005, pp. 443–452, DOI:10.1007/s00775-005-0649-1. URL consultato l'11 marzo 2014.
- G. Wilkinson e J. G. Birmingham, Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta, in J. Am. Chem. Soc., vol. 76, n. 17, 1954, pp. 4281–4284, DOI:10.1021/ja01646a008. URL consultato l'11 marzo 2014.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su dicloruro di titanocene